Chng 3 LIN KT HO HC V sao


















- Slides: 29


Chương 3 LIÊN KẾT HOÁ HỌC - Vì sao nguyên tử các nguyên tố (trừ khí hiếm) có xu hướng liên kết với nhau tạo thành phân tử hay tinh thể ? - Có mấy loại liên kết hóa học ? Các nguyên tử liên kết với nhau như thế nào ?

Tiết 22 LIÊN KẾT ION – TINH THỂ ION * Ion là gì ? Khi nào nguyên tử trở thành ion ? Có mấy loại ion ? * Liên kết ion được hình thành như thế nào? Liên kết ion ảnh hưởng như thế nào đến tính chất của các hợp chất ion ?

SỰ HÌNH THÀNH ION ? Ion là gì ? Khi nào nguyên tử trở thành ion ?

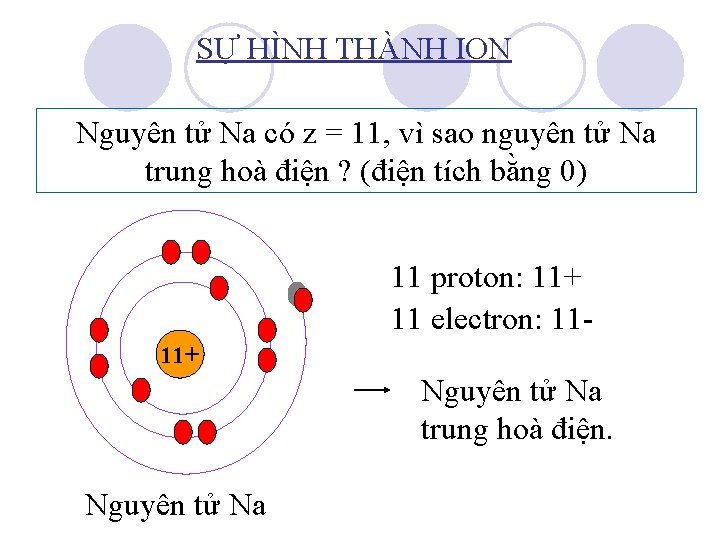
SỰ HÌNH THÀNH ION Nguyên tử Na có z = 11, vì sao nguyên tử Na trung hoà điện ? (điện tích bằng 0) 11 proton: 11+ 11 electron: 1111+ Nguyên tử Na trung hoà điện. Nguyên tử Na

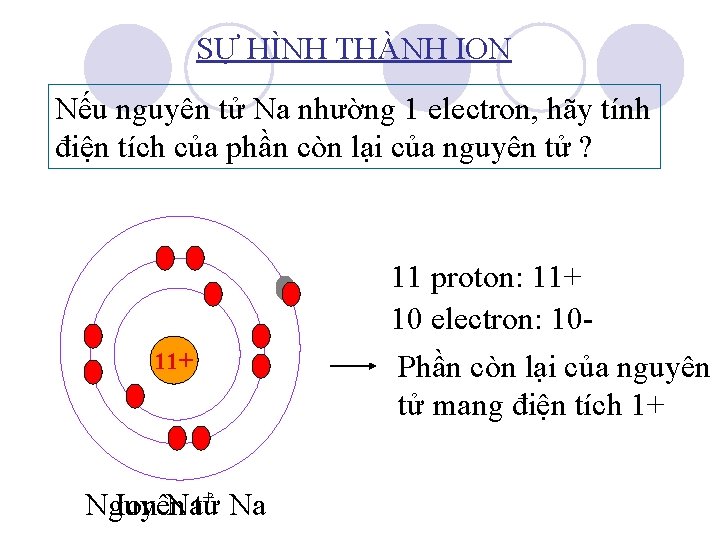
SỰ HÌNH THÀNH ION Nếu nguyên tử Na nhường 1 electron, hãy tính điện tích của phần còn lại của nguyên tử ? 11+ + Na Nguyên Ion Natử 11 proton: 11+ 10 electron: 10 Phần còn lại của nguyên tử mang điện tích 1+

SỰ HÌNH THÀNH ION KẾT LUẬN - Nguyên tử trung hoà về điện. - Khi nguyên tử nhường hay nhận electron nó trở thành phần tử mang điện gọi là ion. Có mấy loại ion ?

CATION Nguyên tử kim loại có bao nhiêu e lớp ngoài cùng ? Để đạt cấu hình e bền vững của khí hiếm thì nguyên tử kim loại có khuynh hướng gì ?

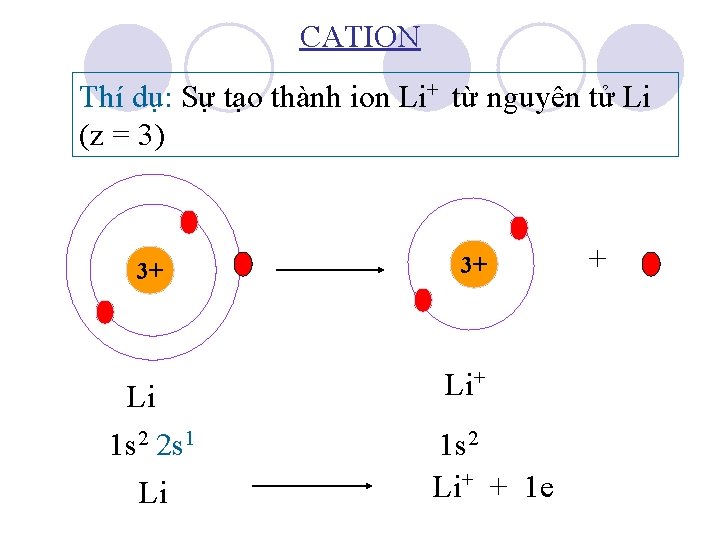
CATION Thí dụ: Sự tạo thành ion Li+ từ nguyên tử Li (z = 3) 3+ Li 1 s 2 2 s 1 Li 3+ Li+ 1 s 2 Li+ + 1 e +

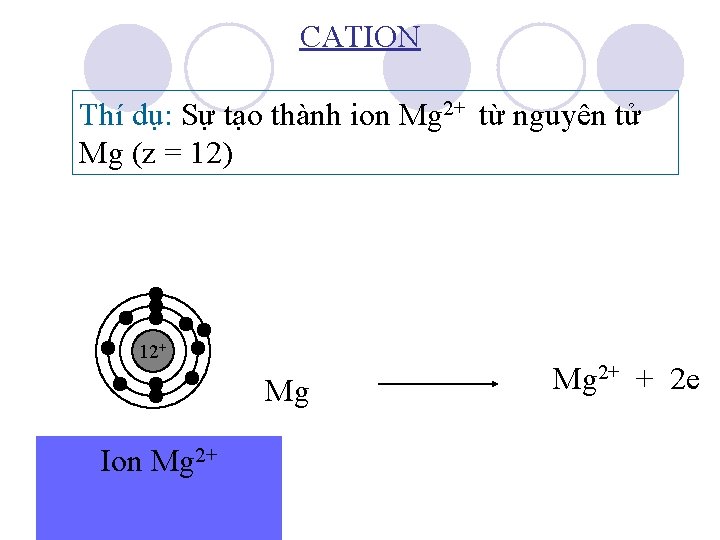
CATION Thí dụ: Sự tạo thành ion Mg 2+ từ nguyên tử Mg (z = 12) 12+ Mg Ion Mg Nguyên tử 2+ Mg Mg 2+ + 2 e

CATION Hãy biểu diễn sự hình thành ion dương (cation) từ các nguyên tử : Na (z = 11), Al (z =13), K (z = 19), Ca (z = 20).

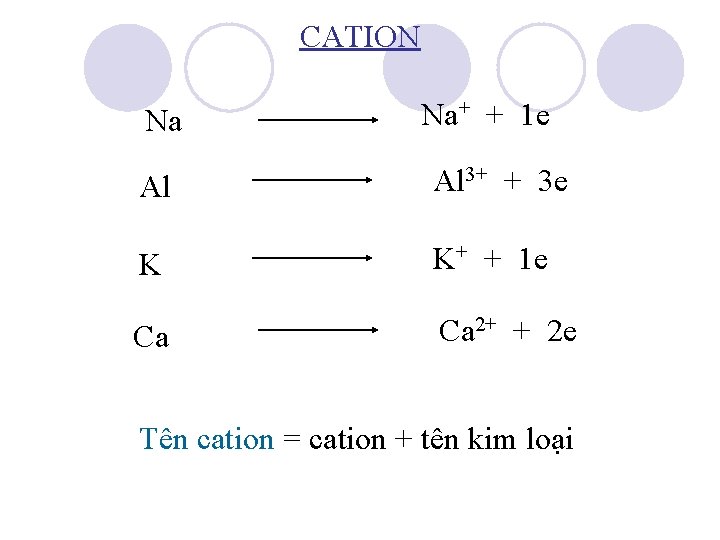
CATION Na Na+ + 1 e Al Al 3+ + 3 e K K+ + 1 e Ca Ca 2+ + 2 e Tên cation = cation + tên kim loại

CATION KẾT LUẬN Những nguyên tử kim loại lớp ngoài cùng có 1, 2, 3 electron đều dễ nhường electron để trở thành ion dương (cation).

ANION Nguyên tử phi kim có bao nhiêu e lớp ngoài cùng ? Để đạt cấu hình e bền vững của khí hiếm thì nguyên tử phi kim có khuynh hướng gì ?

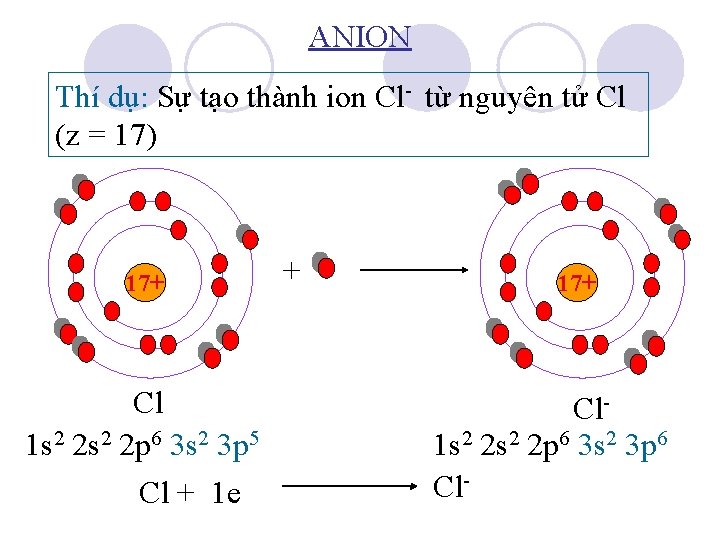
ANION Thí dụ: Sự tạo thành ion Cl- từ nguyên tử Cl (z = 17) 17+ Cl 1 s 2 2 p 6 3 s 2 3 p 5 Cl + 1 e + 17+ Cl 1 s 2 2 p 6 3 s 2 3 p 6 Cl-

ANION Hãy biểu diễn sự hình thành ion âm (anion) từ các nguyên tử : F(z = 9), O (z = 8), N (z =7), S (z = 16), Br (z = 35).

ANION F + 1 e F- Anion florua O + 2 e N + 3 e S + 2 e O 2 - Anion oxit N 3 - Anion nitrua S 2 - Anion sunfua Br + 1 e Br- Anion bromua Tên anion = Anion +tên gốc axit (trừ O 2 - gọi là anion oxit)

ANION KẾT LUẬN Những nguyên tử phi kim lớp ngoài cùng có 5, 6, 7 electron có khả năng nhận thêm 3, 2 hay 1 electron để trở thành ion âm (anion).

ION ĐƠN NGUYÊN TỬ VÀ ION ĐA NGUYÊN TỬ Những ion nào sau đây là ion đơn nguyên tử, ion đa nguyên tử ? Na+, NH 4+, Mg 2+, Al 3+, OH-, Li+, S 2 -, SO 42 -, Cl-, PO 43 -. -Ion đơn nguyên tử: Na+, Mg 2+, Al 3+, Li+, S 2 -, Cl-. -Ion đa nguyên tử: NH 4+, OH-, SO 42 -, PO 43 -.

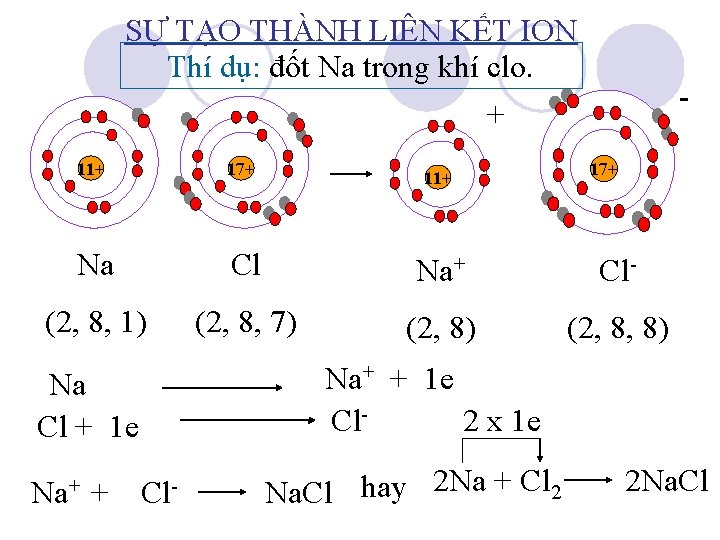
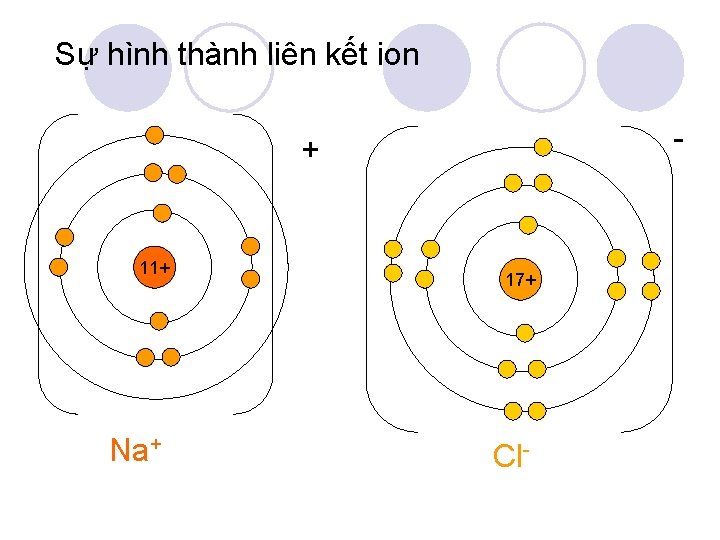
SỰ TẠO THÀNH LIÊN KẾT ION Thí dụ: đốt Na trong khí clo. + - 11+ 17+ Na Cl Na+ Cl- (2, 8, 1) (2, 8, 7) (2, 8, 8) 17+ Na+ + 1 e Cl 2 x 1 e Na Cl + 1 e Na+ + 11+ Cl- Na. Cl hay 2 Na + Cl 2 2 Na. Cl

Sự hình thành liên kết ion - + 11+ Na+ 17+ Cl-

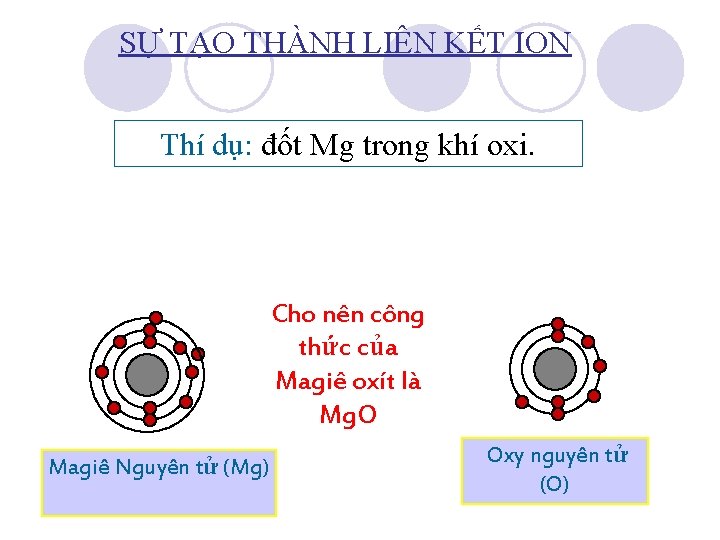
SỰ TẠO THÀNH LIÊN KẾT ION Thí dụ: đốt Mg trong khí oxi. Cho nên công thức của Magiê oxít là Mg. O Magiê Nguyên tử 2+(Mg) Ion Magiê (Mg ) Oxy oxitnguyên ion (O 2 -tử ) (O)

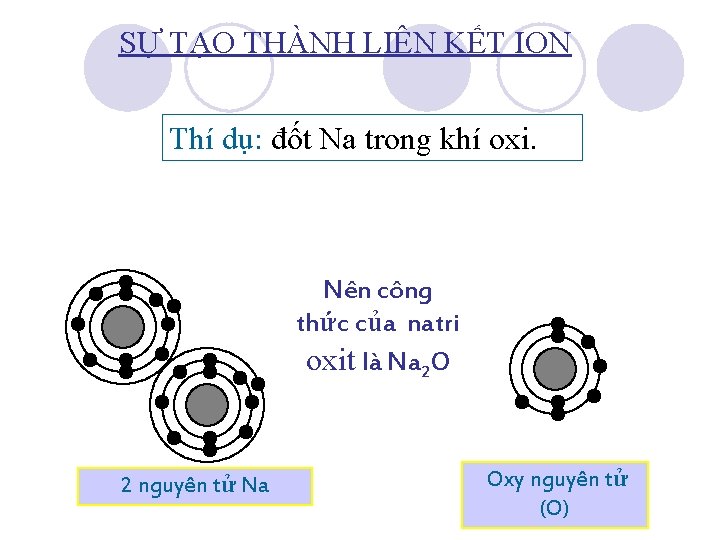
SỰ TẠO THÀNH LIÊN KẾT ION Thí dụ: đốt Na trong khí oxi. Nên công thức của natri oxit là Na 2 O 22 nguyên ion Natri tử(Na Na+) Oxy ion nguyên oxit (O 2 -tử ) (O)

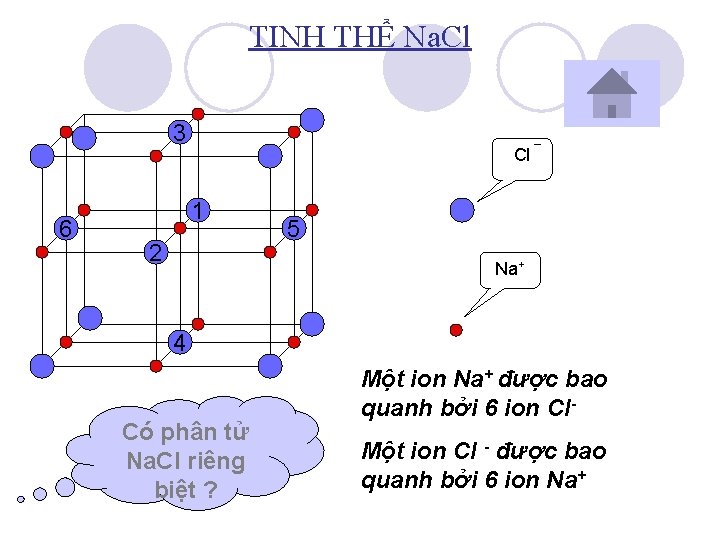
TINH THỂ Na. Cl 3 6 Cl 1 2 5 Na+ 4 Có phân tử Na. Cl riêng biệt ? Một ion Na+ được bao quanh bởi 6 ion Cl. Một ion Cl - được bao quanh bởi 6 ion Na+

TÍNH CHẤT CHUNG CỦA HỢP CHẤT ION -Vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn nên tinh thể ion rất bền vững: Các hợp chất ion đều khá rắn, khó bay hơi, khó nóng chảy. -Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy và khi hoà tan trong nước, chúng dẫn điện.

BÀI TẬP Cho các nguyên tố X (z = 3 ), M (z = 11), R (z = 19). Từ nguyên tử các nguyên tố trên tạo được các ion A. M+ , R+ , X 2+. B. M+ , R+ , X+. C. M 2+, R+ , X 2+. D. M+ , R 2+ , X 2+. ĐÁ PÁ N B.

BÀI TẬP Ion X 2 - do nguyên tử X tạo ra có cấu hình electron là 1 s 22 p 63 s 23 p 6. Nguyên tử X có cấu hình electron là A. 1 s 22 p 63 s 23 p 64 s 1. B. 1 s 22 p 63 s 23 p 4. C. 1 s 22 p 63 s 23 p 5. D. 1 s 22 p 63 s 23 p 6. ĐÁ PÁ N B.

BÀI TẬP Trong tinh thể Na. Cl A. các ion Na+ và ion Cl- góp chung cặp electron hình thành liên kết. B. các nguyên tử Na và Cl góp chung cặp electron hình thành liên kết. C. nguyên tử natri và nguyên tử clo hút nhau bằng lực hút tĩnh điện. D. các ion Na+ và ion Cl- hút nhau bằng lực hút tĩnh điện. ĐÁP ÁN D.

KÍNH CHÚC QUÝ THẦY CÔ GIÁO SỨC KHỎE, CHÚC CÁC EM HỌC TỐT !
 Chng finance
Chng finance Dave lin
Dave lin Lin shan lee
Lin shan lee Lin enum
Lin enum Kopper bence
Kopper bence Kaylee lin
Kaylee lin Dr lin-fan wang
Dr lin-fan wang Magistrala lin bmw
Magistrala lin bmw Alison lin nih
Alison lin nih Dr karen lin
Dr karen lin Lin da652q
Lin da652q Chen lin finance
Chen lin finance V lin
V lin Hi lin
Hi lin Lin donn
Lin donn Mot lin blinds
Mot lin blinds Lin and dyer
Lin and dyer Chi lin purse
Chi lin purse Sebebi med harfleri
Sebebi med harfleri Lin donn
Lin donn Meddi arız tul tevassut kasr
Meddi arız tul tevassut kasr Mdconsult
Mdconsult Doctor good morning what can i do for you
Doctor good morning what can i do for you Suzanne lin
Suzanne lin Lin evola smidt
Lin evola smidt Yifei lin
Yifei lin The vision of maya ying lin
The vision of maya ying lin Field stop vs aperture stop
Field stop vs aperture stop Fracture type
Fracture type Linda mei-lin koh
Linda mei-lin koh