Chng 3 3 Tit C CH PHN NG
















- Slides: 25

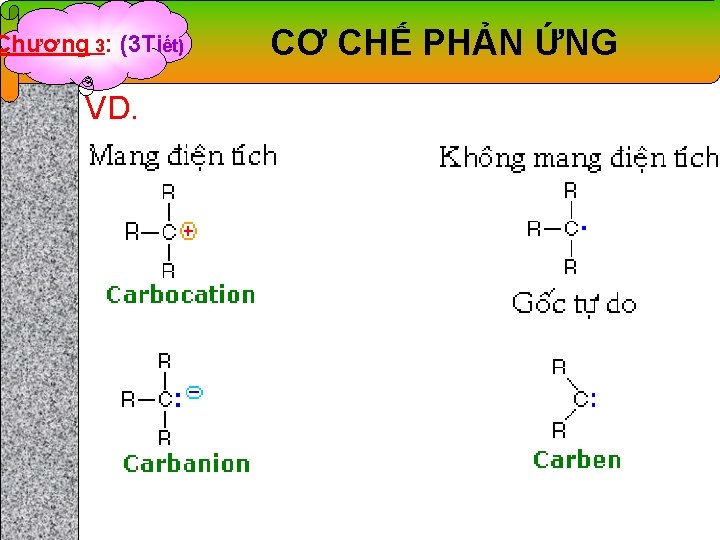
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 1. Gốc tự do, carbocation, carbanion, carben, arin 1. 1. Gốc tự do: là chất trung gian có ít nhất một điện tử độc thân trên một nguyên tử. 1. 2. Carbocation: Những nhóm thế đẩy điện tử gắn vào cacbon mang đtích (+), làm ổn định carbocation. Độ bền giảm dần từ carbocation bậc 3 đến carbocation bậc 1. 1. 3. Carbanion: là chất trung gian có một đtích (-) trên một cacbon. Xung quanh cacbon mang đtích (-) đã có 8 đtử. 1. 4. Carben: là những chất trung hòa của cacbon hóa trị 2, xquanh C có 6 đtử gồm 4 đtử đã liên kết và 2 đtử tự do. 1. 5. Arin: là chất trung gian có hoạt tính mạnh, có thể xem như dẫn xuất aren bằng cách tách 2 H.

Chương 3: (3 Tiết) VD. CƠ CHẾ PHẢN ỨNG

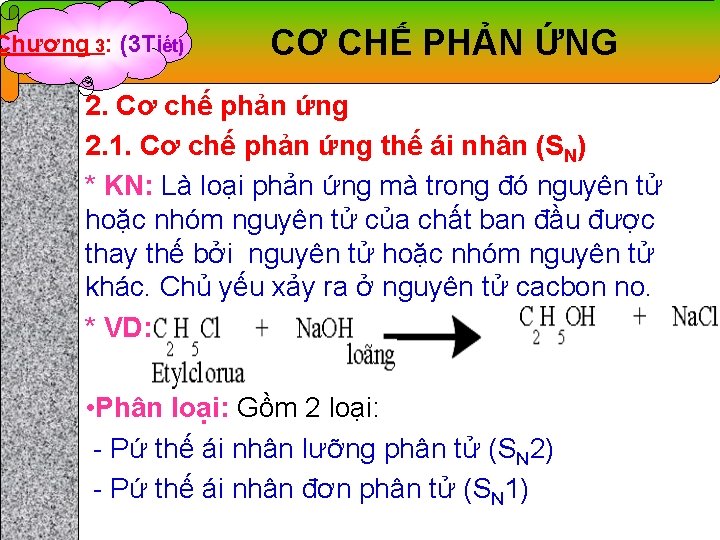
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. Cơ chế phản ứng 2. 1. Cơ chế phản ứng thế ái nhân (SN) * KN: Là loại phản ứng mà trong đó nguyên tử hoặc nhóm nguyên tử của chất ban đầu được thay thế bởi nguyên tử hoặc nhóm nguyên tử khác. Chủ yếu xảy ra ở nguyên tử cacbon no. * VD: • Phân loại: Gồm 2 loại: - Pứ thế ái nhân lưỡng phân tử (SN 2) - Pứ thế ái nhân đơn phân tử (SN 1)

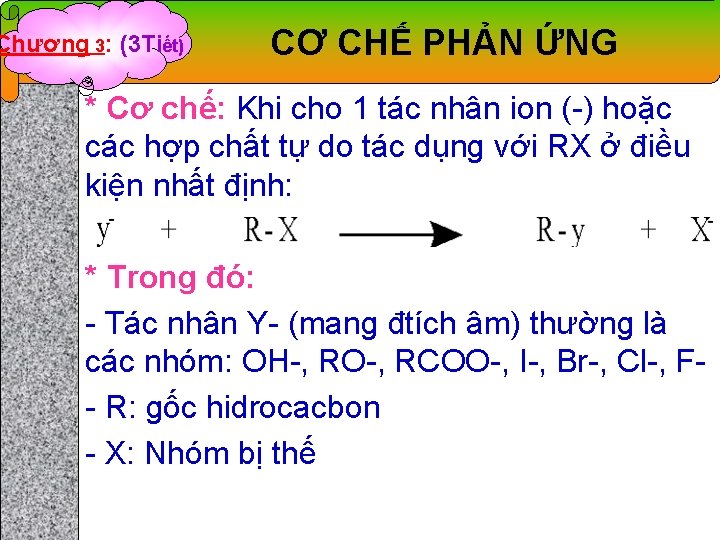
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG * Cơ chế: Khi cho 1 tác nhân ion (-) hoặc các hợp chất tự do tác dụng với RX ở điều kiện nhất định: * Trong đó: - Tác nhân Y- (mang đtích âm) thường là các nhóm: OH-, RO-, RCOO-, I-, Br-, Cl-, F- R: gốc hidrocacbon - X: Nhóm bị thế

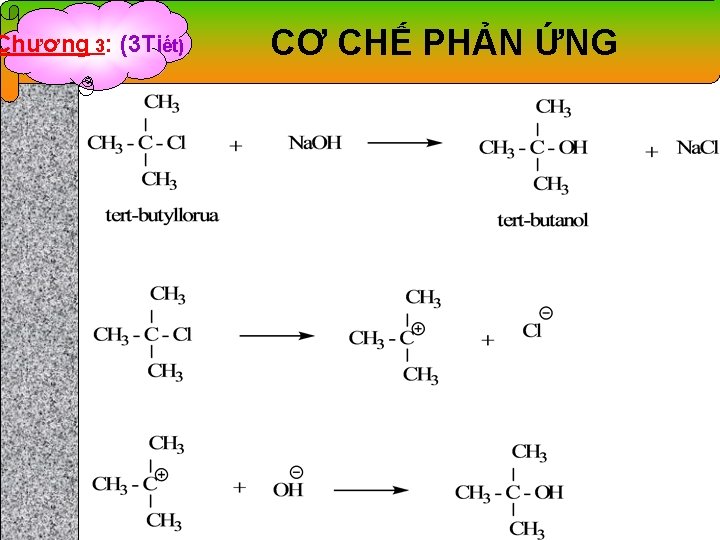
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 1. 1. Cơ chế thế ái nhân lưỡng phân tử (SN 2) - Là phản ứng xảy ra theo cơ chế 1 giai đoạn có qua trạng thái chuyển tiếp. - Các phản ứng thủy phân của dẫn xuất halogen no bậc 1 thường xảy ra theo cơ chế SN 2

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 1. 2. Cơ chế thế ái nhân đơn phân tử (SN 1) - Là phản ứng xảy ra theo cơ chế 2 giai đoạn ion hóa và kết hợp cation: * Giai đoạn 1: ion hóa, chậm * Giai đoạn 2: kết hợp cation, nhanh - Các phản ứng thủy phân của dẫn xuất halogen no bậc 3 thường xảy ra theo cơ chế SN 1

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 1. 3. Các yếu tố ảnh hưởng đến phản ứng thế ái nhân - Cation tạo thành càng bền, SN 1 càng mạnh: - Tính ái nhân đồng biến với tính bazơ, ngoại trừ dãy halogen. - Tính ái nhân trong dãy halogen: I- > Br- > Cl- > F- Tính ái nhân càng cao càng ưu tiên xảy ra cơ chế SN 2:

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 1. 4. Cạnh tranh giữa SN 1 và SN 2 - Các tác chất có tính nucleophil nghèo như: H 20, CH 3 OH : SN 1 - Các tác chất có tính nucleophil giàu: HO-, CH 3 O- : SN 2 - Metyl và halogenur alkyl bậc 1 : SN 2 - Halogenur alkyl bậc 2 : SN 1 và SN 2 - Halogenur alkyl bậc 3 : SN 1

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG ÞTóm lại: - Khi halogenur alkyl có thể xảy ra phản ứng SN 1 và SN 2, phản ứng SN 2 sẽ ưu tiên khi nucleophil giàu điện âm trong dung môi phân cực phi proton như: (CH 3)2 SO (DMSO), CH 3 CN (Me. CN), (CH 3)2 NCHO (DMF), (CH 3)2 CO (Me 2 CO), CH 3 Cl 2. - Ngược lại, phản ứng SN 1 ưu tiên khi nucleophil nghèo trong dung môi phân cực proton như: H 2 O, HCOOH, CH 3 OH, C 2 H 5 OH, CH 3 COOH (Ac. OH), (CH 3)3 OH

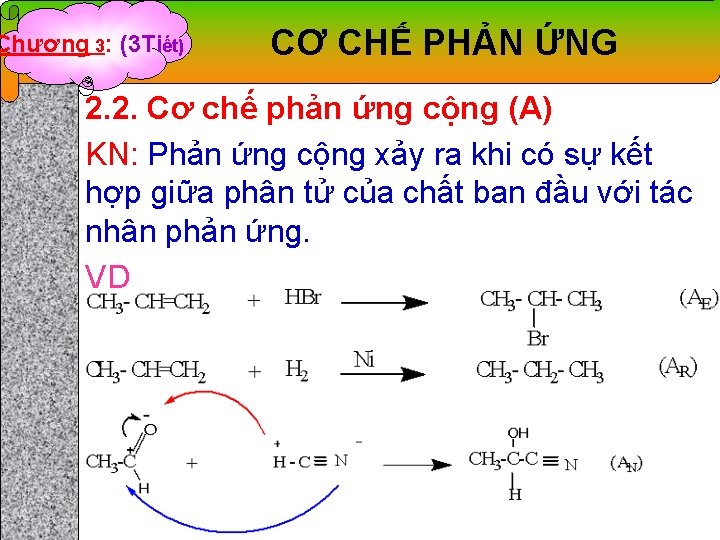
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 2. Cơ chế phản ứng cộng (A) KN: Phản ứng cộng xảy ra khi có sự kết hợp giữa phân tử của chất ban đầu với tác nhân phản ứng. VD

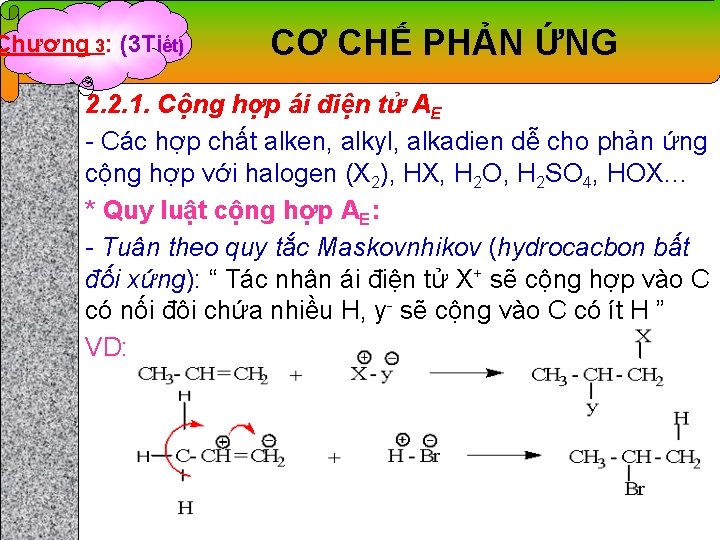
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 2. 1. Cộng hợp ái điện tử AE - Các hợp chất alken, alkyl, alkadien dễ cho phản ứng cộng hợp với halogen (X 2), HX, H 2 O, H 2 SO 4, HOX… * Quy luật cộng hợp AE: - Tuân theo quy tắc Maskovnhikov (hydrocacbon bất đối xứng): “ Tác nhân ái điện tử X+ sẽ cộng hợp vào C có nối đôi chứa nhiều H, y- sẽ cộng vào C có ít H ” VD:

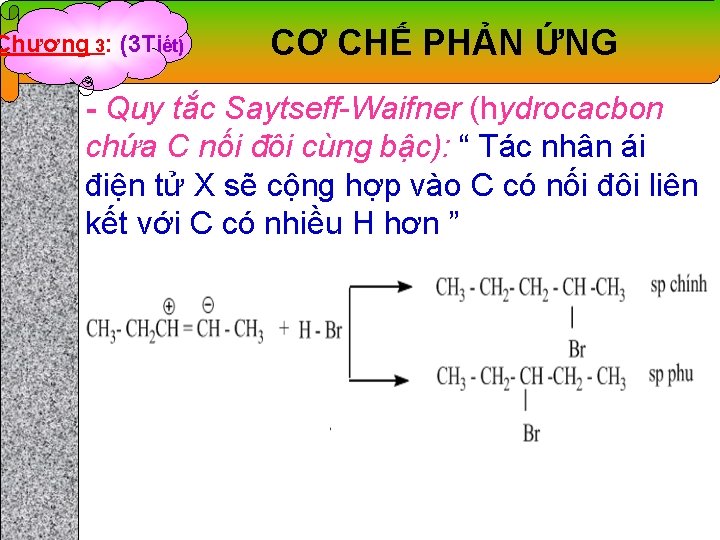
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG - Quy tắc Saytseff-Waifner (hydrocacbon chứa C nối đôi cùng bậc): “ Tác nhân ái điện tử X sẽ cộng hợp vào C có nối đôi liên kết với C có nhiều H hơn ”

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG * Ảnh hưởng của các nhóm thế: - Mật độ e- của liên kết càng nhiều =>Khả năng công hợp AE càng giảm. - Khả năng phản ứng của các olefin:

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 2. 2. Cộng hợp ái nhân AN - Là phản ứng đặc trưng của hydrocacbon, là phản ứng cộng hợp của ái nhân vào liên kết đôi. - Có sự chênh lệch lớn giữa 2 nguyên tử mang nối đôi. - Có sự đẩy e- ở nối đôi tạo nên sự phân cực: C = O. - Khi cộng hợp, tác nhân ái nhân (-) vào đầu mang điện tích (+), tác nhân ái điện tử cộng vào đầu (-).

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG * Ảnh hưởng của các nhóm thế: - Các nhóm thế mang hiệu ứng đẩy e- (+I, +R, +H) =>Giảm e- của C => Khả năng công hợp AN giảm. - Khả năng phản ứng của các hợp chất cacbonyl:

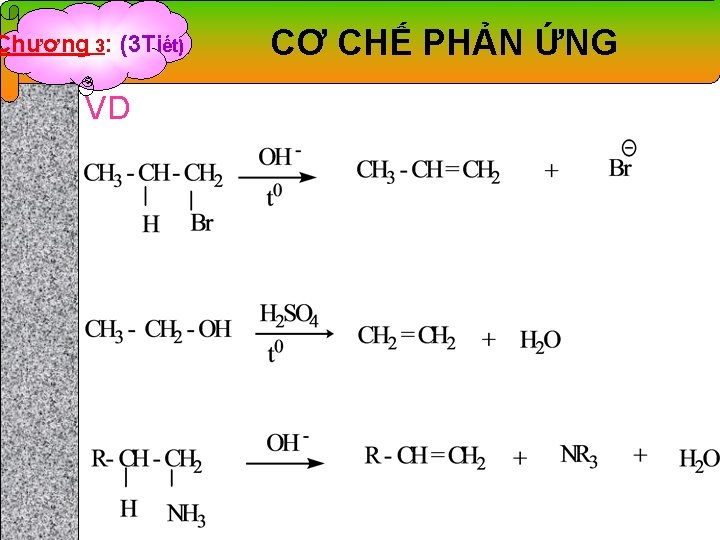
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 3. Cơ chế phản ứng tách loại (E) KN: Là loại phản ứng mà tách 1 phân tử ra khỏi hợp chất ban đầu mà không có sự thay thế bằng những nguyên tử khác, sản phẩm tạo thành là những hydrocacbon không no (alken, alkyn. . ) * Tổng quát:

Chương 3: (3 Tiết) VD CƠ CHẾ PHẢN ỨNG

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 3. 1. Phản ứng tách lưỡng phân tử E 2 Với: - X: Cl, Br, I, . . . - Y: OH-, RO-, NR 3, C 6 H 5 O- (Y- : một anion hay phân tử trung hòa với cặp e chưa sử dụng (baz) - V = K[RX][Y-]

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG VD. - Cơ chế 1 giai đoạn và trạng thái chuyển tiếp - Dẫn xuất hydrocacbon bậc 1 thường xảy ra - Tốc độ phản ứng tách E 2 giảm theo thứ tự: I> Br> Cl>F - Phản ứng khử E 2: ưu tiên với nucleophil nồng độ cao của bazơ mạnh và trong dung môi phân cực không proton như DMSO, DMF…

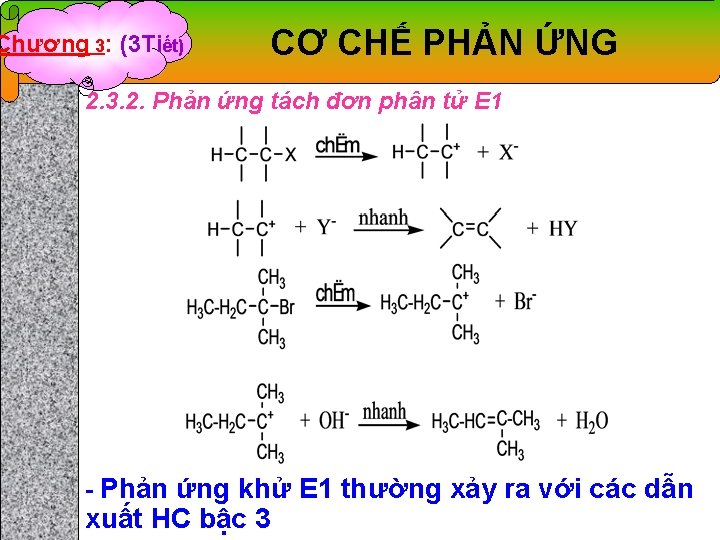
Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 3. 2. Phản ứng tách đơn phân tử E 1 - Phản ứng khử E 1 thường xảy ra với các dẫn xuất HC bậc 3

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG 2. 3. 3. Cạnh tranh giữa E 1 và E 2

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG * Quy tắc tách Quy tắc Zaixep: nhóm thế X bị tách ra cùng với nguyên tử β–H ở C có bậc cao nhất và tạo ra nối đôi có nhiều nhóm thế nhất.

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG - Quy tắc Zaixep áp dụng cho cả E 1 và E 2, nhưng đối với E 2 có trường hợp ngoại lệ sau: Trường hợp X là nhóm thế mang điện dương như : +NR 3, +SR 2 => Phản ứng tách E 2 sẽ xảy ra theo quy tắc Hopman: X bị tách cùng với nguyên tử β – H ở C có bậc thấp hơn ngược với quy tắc Zaixep

Chương 3: (3 Tiết) CƠ CHẾ PHẢN ỨNG BTVN -Bài tập mẫu. -Bài tập tự giải chương 3 trong giáo trình “Hóa hữu cơ”: bài 1 -20/trang 147 -150.