CHNG 1 CC KHI NIM V NH LUT
























































- Slides: 68

CHƯƠNG 1 CÁC KHÁI NIỆM VÀ ĐỊNH LUẬT CƠ BẢN 1

Nội dung 1. 1. Các khái niệm cơ bản 1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử 1. 1. 2. Khối lượng nguyên tử, phân tử, mol 1. 1. 3. Chất hóa học 1. 1. 4. Ký hiệu, công thức hóa học và phương trình hóa học 2

Nội dung 1. 2. Các định luật cơ bản 1. 2. 1. 1. 2. 2. 1. 2. 3. 1. 2. 4. 1. 2. 5. 1. 2. 6. 3 Định luật bảo toàn khối lượng Định luật thành phần không đổi Định luật tỷ lệ bội Đương lượng và định luật đương lượng Phương trình trạng thái khí Các phương pháp xác định KLPT và đương lượng

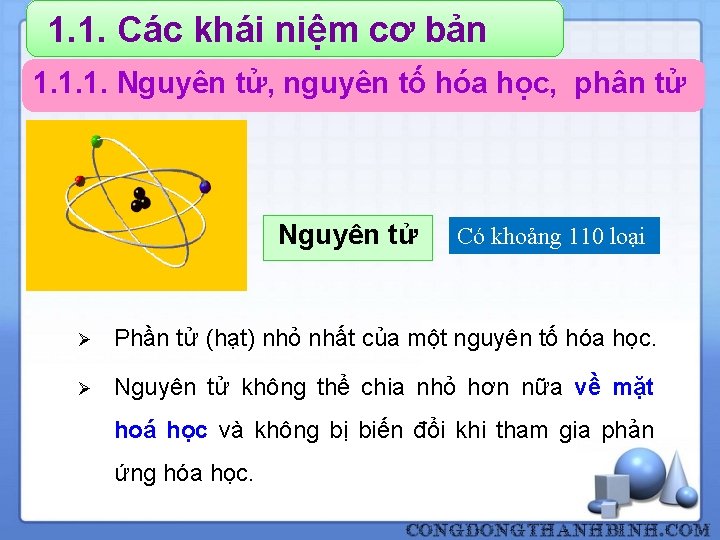
1. 1. Các khái niệm cơ bản 1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tử Có khoảng 110 loại Ø Phần tử (hạt) nhỏ nhất của một nguyên tố hóa học. Ø Nguyên tử không thể chia nhỏ hơn nữa về mặt hoá học và không bị biến đổi khi tham gia phản ứng hóa học. 4

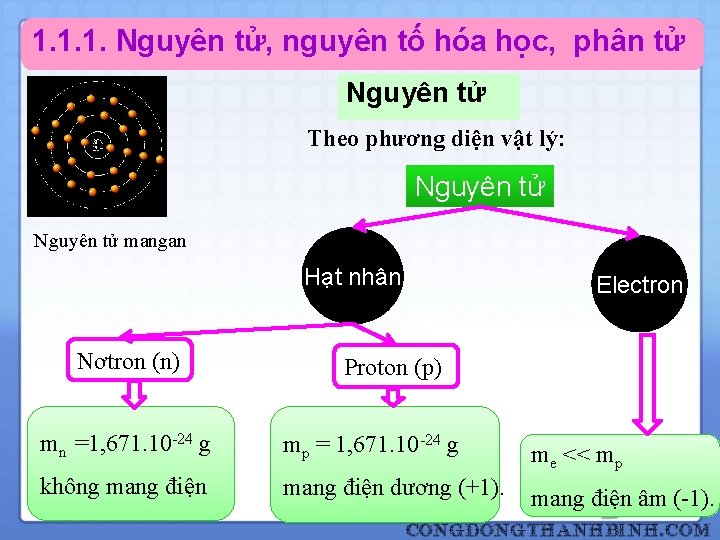
1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tử Theo phương diện vật lý: Nguyên tử mangan Hạt nhân Nơtron (n) 5 Electron Proton (p) mn =1, 671. 10 -24 g mp = 1, 671. 10 -24 g me << mp không mang điện dương (+1). mang điện âm (-1).

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tử v Đặc trưng nguyên tử + Số nguyên tử Z = số proton = số electron có trong nguyên tử. Hay số thứ tự trong bảng HTTH + Số khối nguyên tử A (A = P + N) + Kí hiệu nguyên tử : v Nguyên tử của các nguyên tố có kích thước và khối lượng khác nhau. 6

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tử Ví dụ về nguyên tử 7

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Năm 1923 theo quyê t đi nh cu a Uy ban quô c tê vê tro ng lươ ng nguyên tư , nguyên tô ho a ho c 8 NTHH la châ t ban đâ u tham gia va o ca c hơ p châ t va đơn châ t ma ca c nguyên tư cu a no co cu ng điê n ti ch ha t nhân va cu ng chiê m mô t chô trong ba ng HTTH. Chất mà các nguyên tử có điện tích hạt nhân giống nhau

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Ví dụ : § § 9 Nguyên tô hydro gô m ca c nguyên tử co tri sô điê n ti ch ha t nhân la +1; Nguyên tô oxy gô m ca c nguyên tư co tri sô điê n ti ch ha t nhân la +8.

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Trong hóa học, các nguyên tố được ký hiệu bằng một hay hai chữ cái lấy trong tên gọi Latinh của nó. Ví dụ H: Hydrogenium 10 Na: Natrium

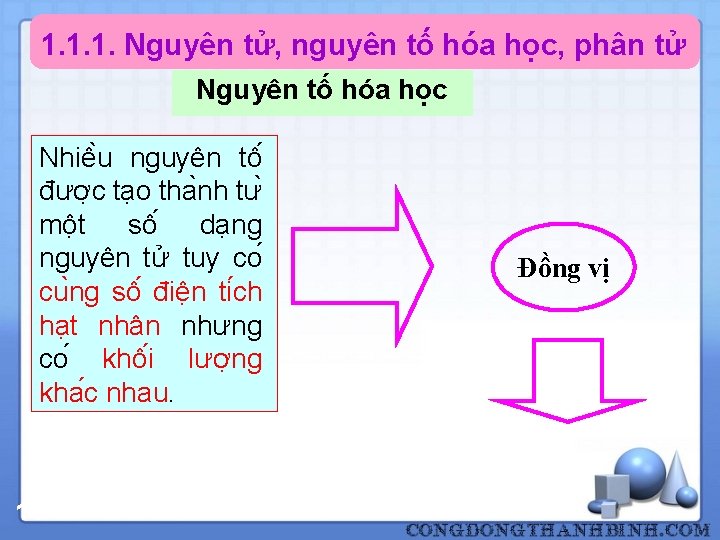
1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Nhiê u nguyên tô đươ c ta o tha nh tư mô t sô da ng nguyên tử tuy co cu ng sô điê n ti ch ha t nhân nhưng co khô i lươ ng kha c nhau. 11 Đồng vị

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Đồng vị Nguyên tử có cùng số proton, nhưng khác số nơtron. Khác số nơtron (số khối) Cùng số hiệu nguyên tử (số p) Ví dụ : Bao nhiêu proton, nơtron và electron cho mỗi nguyên tử sau: 12

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Đồng vị Ví dụ: § § 13 Oxy có 3 đồng vị : 16 O 8 , 17 O 8 18 O 8 với tỷ lệ 3150: 1: 5. Khí hyđro thiên nhiên là hỗn hợp của 2 đồng vị (proti) và (đơtơri D) với tỷ lệ 5000: 1.

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Nguyên tố hóa học Đồng vị Đô ng vi cu a ca c nguyên tô ho a ho c kha c nhau vê ti nh châ t ho a ho c va vâ t ly. Ví dụ: Ptră ng: pha t sa ng trong tô i, râ t đô c, Pđo : không pha t sa ng, không tư bô c cha y trong không khi , dê đô c, không tư bô c cha y trong tham gia va o ca c pha n ư ng ho a ho c không khi , tham gia pha n ư ng vơ i ca c nguyên tô kha c. ho a ho c ơ nhiê t đô cao vơ i ca c 14 nguyên tô kha c.

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Phân tử 15 – La phâ n tử (ha t) nho nhâ t cu a mô t châ t co kha năng tô n ta i đô c lâ p, mang đâ y đu ba n châ t ho a ho c cu a châ t đo. – Phân tử la tâ p hơ p mô t nho m ( 2) nguyên tử co thê cu ng loa i hoă c kha c loa i.

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Phân tử Các nguyên tử Nhiều Liên kết Hóa học Phân tử Kết quả Vô cùng lớn 16

1. 1. 1. Nguyên tử, nguyên tố hóa học, phân tử Phân tử Ví dụ: 17

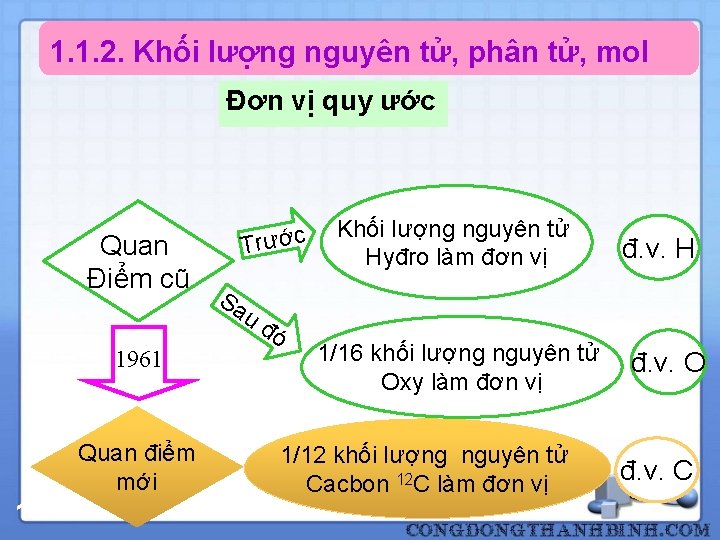
1. 1. 2. Khối lượng nguyên tử, phân tử, mol Khối lượng nguyên tử Khối lượng của một nguyên tử rất nhỏ. Ví dụ: m nguyên tử (O) = 2, 66. 10 -23 g = 2, 66. 10 -26 kg Để thuận tiện, người ta sẽ qui ước sử dụng một đơn vị khác thích hợp hơn Định nghĩa 18 Khô i lươ ng nguyên tư cu a mô t nguyên tô la khô i lươ ng ti nh bă ng đơn vi quy ươ c cu a mô t nguyên tư cu a nguyên tô đo.

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Đơn vị quy ước Quan Điểm cũ Trước Sa Khối lượng nguyên tử Hyđro làm đơn vị đ. v. H uđ 1961 Quan điểm mới 19 ó 1/16 khối lượng nguyên tử Oxy làm đơn vị 1/12 khối lượng nguyên tử Cacbon 12 C làm đơn vị đ. v. O đ. v. C

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Khái niệm lại Ø Khối lượng nguyên tử tương đối: tỉ số khối lượng nguyên tử của nó với 1/12 phần khối lượng của nguyên tử cacbon (12 C). Ký hiệu: A – số không có thứ nguyên Ø Khối lượng phân tử tương đối của một chất là tỉ số khối lượng phân tử của nó với 1/12 phần khối lượng của nguyên tử cacbon (12 C). Ký hiệu: M – số không có thứ nguyên 20

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Ví dụ: § Khô i lươ ng nguyên tư cu a Clo bă ng 35, 453 đ. v. C co nghi a la nguyên tư Clo co khô i lươ ng gâ p 35, 453 lâ n 1/12 khô i lươ ng nguyên tư 12 C. § AH = 1, 00797 đ. v. C § MH 2 O = 2 AH + AO = (1, 00797 x 2) + 15, 9994 = = 21 18, 0073 đ. v. C

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Nguyên tử gam, phân tử gam Theo đơn vị Khái niệm khác Nguyên tư gam của một nguyên tố la lượng tính bằng gam của nguyên tố đó có số đo bằng khối lượng nguyên tư của nó. Ví du : AH = 1, 00797 đ. v. C AH (g) = 1, 00797 g. Phân tư gam la khô i lươ ng phân tư ti nh bă ng gam. Vi du : MH 2 O = 18, 0073 đ. v. C MH 2 O(g) = 18, 0073 g. 22

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Mol – Khối lượng mol Mol là đơn vị đo lượng chất, 1 mol bất kỳ đều chứa số tiểu phân như nhau chính bằng số Avogadro. NA = 6, 02214199 x 1023 tiểu phân Khô i lươ ng mol nguyên tư la nguyên tư gam cu a mô t nguyên tô. Khô i lươ ng mol phân tư la phân tư gam cu a mô t châ t. 23

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Mol – Khối lượng mol Ví dụ Khối lượng phân tử H 2 O bằng 18 đv. C Khối lượng mol phân tử H 2 O bằng 18 g. Khối lượng phân tử CO 2 bằng 44 đv. C Khối lượng mol phân tử CO 2 bằng 44 g 24

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Mol – Khối lượng mol Nê u lâ y khô i lươ ng mol nguyên tư chia cho khô i lươ ng mô t nguyên tư ti nh bă ng gam thi thu đươ c sô Avogadro. Ví dụ Khô i lươ ng mol nguyên tư cu a oxy la 16 g, khô i lươ ng thư c cu a mô t nguyên tư oxy la 2, 6575. 10 -23 g. 25

1. 1. 2. Khối lượng nguyên tử, phân tử, mol Mol – Khối lượng mol Ví dụ Khô i lươ ng phân tư mol cu a phân tư hydro la 2 g. Khô i lươ ng mô t phân tư hydro ti nh bă ng gam la 0, 332. 10 -23 g. 26

1. 1. 3. Chất hóa học: đặc trưng la tâ p hơ p ca c phân tư cu ng loa i co tha nh phâ n va câ u ta o ho a ho c như nhau Đơn chất là những chất hóa học mà phân tử của chúng có cùng loại nguyên tử. 27 VD: khí H 2 , O 3 , S, Fe…, Đồng nhất Thành phần cố định Hợp chất là những chất hóa học mà phân tử của chúng bao gồm hai hay nhiều nguyên tử khác nhau. VD: CO, CO 2, NH 3, HNO 3, HCl…

1. 1. 3. Chất hóa học v. Dạng thù hình: những dạng phân tử hay dạng tinh thể khác nhau của một nguyên tố. Ví dụ: Oxi có 2 dạng thù hình: O 2, O 3 Cacbon có các dạng thù hình: Kim cương C 6, Than chì C 5 , … v. Hiện tượng đồng hình: Các chất khác nhau có thể kết tinh dưới cùng một dạng tinh thể có mạng tinh thể giống nhau. Ví dụ: Ca. CO 3, Fe. CO 3, Mg. CO 3 có cùng loại mạng tinh thể vĐồng phân: Những chất hóa học khác nhau nhưng có cùng công thức phân tử. Ví dụ: Công thức phân tử C 2 H 6 O có 2 đồng phân là: 28 etanol C 2 H 5 OH, đimetyl ete CH 3 -O-CH 3

1. 1. 4. Kí hiệu, công thức, phương trình hóa học Kí hiệu Ø Mỗi nguyên tố hóa học được kí hiệu bằng chữ cái đầu hay hai chữ cái trong tên Latinh của nguyên tố đó. Ø Nê u ca c nguyên tô co tên bă t đâ u cu ng mô t chư ca i thêm va o ca c chư phu đê phân biê t Ví dụ : Cacbon Canxi Clo Crom 29 C Ca Cl Cr

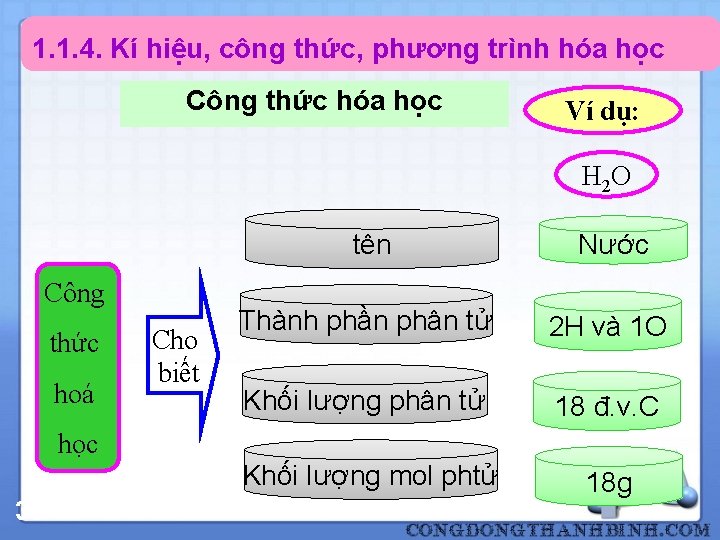
1. 1. 4. Kí hiệu, công thức, phương trình hóa học Công thức hóa học Ví dụ: H 2 O Công thức hoá Cho biết tên Nước Thành phần phân tử 2 H và 1 O Khối lượng phân tử 18 đ. v. C Khối lượng mol phtử 18 g học 30

1. 1. 4. Kí hiệu, công thức, phương trình hóa học Công thức hóa học Cách viết công thức hóa học: Phải nắm vững khái niệm hóa trị. Hóa trị là đại lượng đặc trưng cho khả năng của một nguyên tử của một nguyên tố đã cho có thể kết hợp (hay thế) một số xác định nguyên tử nguyên tố khác. Theo quy ước: Hóa trị hydro bằng 1 31 Hóa trị oxi bằng 2

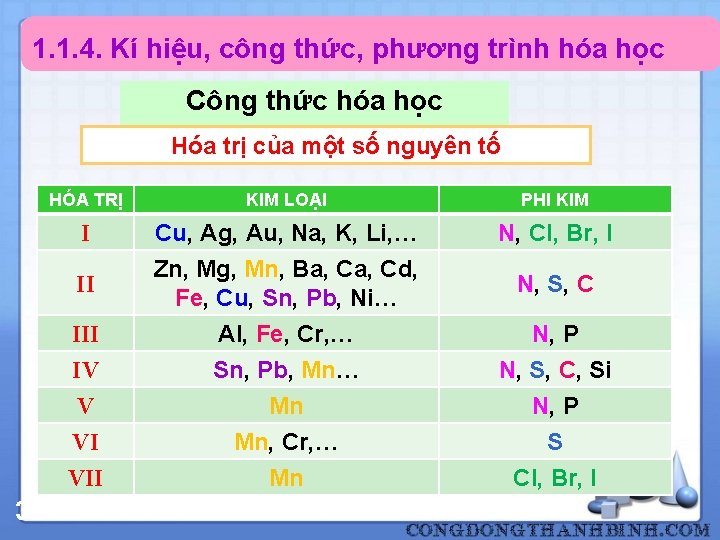
1. 1. 4. Kí hiệu, công thức, phương trình hóa học Công thức hóa học Hóa trị của một số nguyên tố 32 HÓA TRỊ KIM LOẠI PHI KIM I Cu, Ag, Au, Na, K, Li, … N, Cl, Br, I II Zn, Mg, Mn, Ba, Cd, Fe, Cu, Sn, Pb, Ni… N, S, C III IV V VI VII Al, Fe, Cr, … Sn, Pb, Mn… Mn Mn, Cr, … Mn N, P N, S, C, Si N, P S Cl, Br, I

1. 1. 4. Kí hiệu, công thức, phương trình hóa học Phương trình hóa học biểu thị các phản ứng hóa học bằng công thức hóa học. Bên trái: Chất tham gia p. ư (tác chất) Hệ số Bên phải: Chất tạo thành (sản phẩm) tho a ma n đi nh luâ t ba o toa n khô i lươ ng 33

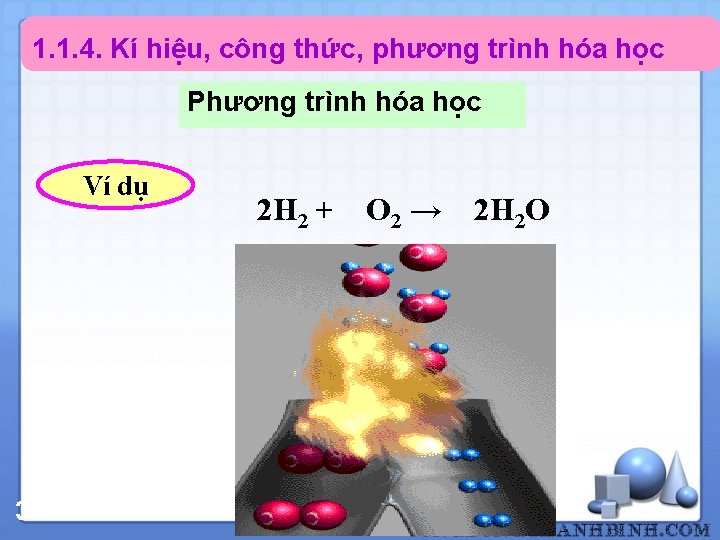
1. 1. 4. Kí hiệu, công thức, phương trình hóa học Phương trình hóa học Ví dụ 34 2 H 2 + O 2 → 2 H 2 O

1. 2. Các định luật cơ bản 1. 2. 1. Định luật bảo toàn khối lượng Mikhail Vasilyevich Lomonosov (1711 – 1765) 1748 35 Khối lượng các sản phẩm thu được đúng bằng khối lượng các chất ban đầu đã tác dụng.

1. 2. Các định luật cơ bản 1. 2. 2. Định luật thành phần không đổi Một hợp chất dù được điều chế bằng cách nào đi nữa bao giờ cũng có thành phần xác định và không đổi Ví dụ: – – 36 – H 2 O dù điều chế bằng cách nào khi phân tích thành phần đều cho tỷ lệ 11, 1% H : 88, 9% O hay 1 g H : 8 g O. Na. Cl: có 39, 34% Na và 60, 66% Cl Trừ trường hợp các khuyết tật trong mạng tinh thể.

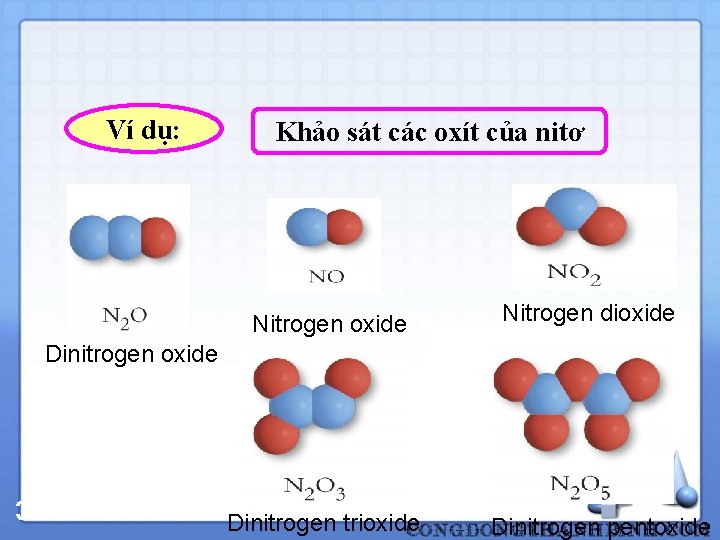
Ví dụ: Khảo sát các oxít của nitơ Nitrogen oxide Nitrogen dioxide Dinitrogen oxide 37 Dinitrogen trioxide Dinitrogen pentoxide

1. 2. Các định luật cơ bản 1. 2. 3. Định luật tỷ lệ bội Ví dụ: Nitơ kết hợp với oxi tạo thành 5 oxit có công thức phân tử lần lượt là: N 2 O, N 2 O 3, NO 2, N 2 O 5. Nếu ứng với một đơn vị khối lượng nitơ thì khối lượng của oxy trong các oxit đó lần lượt là: 0, 57 : 1, 14 : 1, 71 : 2, 28 : 2, 85 = 1 : 2 : 3 : 4 : 5 38

1. 2. Các định luật cơ bản 1. 2. 3. Định luật tỷ lệ bội Nếu hai nguyên tố kết hợp với nhau cho một số hợp chất thì ứng với cùng một khối lượng nguyên tố này, các khối lượng nguyên tố kia tỷ lệ với nhau như những số nguyên đơn giản. 39

1. 2. 4. Đương lượng – Định luật đương lượng Định nghĩa Đương lượng của một nguyên tố là số phần khối lượng của nguyên tố đó kết hợp (thay thế) hết với 1, 008 phần khối lượng của hyđro hoặc 8 phần khối lượng của oxy. Kí hiệu: Đ Từ định nghĩa ta có: Đương lượng của hyđro là ĐH=1, 008; ĐO=8 40

1. 2. 4. Đương lượng – Định luật đương lượng Đương lượng gam Đương lươ ng gam một châ t là khối lượng một lượng chất đó tính bằng gam có con số trùng với đương lượng của nó Ví dụ Nếu đương lượng H 2 SO 4 là 49 thì 1 đương lượng gam bằng 49 g 41

1. 2. 4. Đương lượng – Định luật đương lượng Số đương lượng Sô đương lươ ng cu a châ t tham gia pha n ư ng la ty sô giư a khô i lươ ng châ t tham gia pha n ư ng vơ i đương lươ ng cu a no Sô đương lươ ng (n’) = 42

1. 2. 4. Đương lượng – Định luật đương lượng Dalton Ca c nguyên tô ho a ho c kê t hơ p vơ i nhau theo như ng lươ ng khô i lươ ng ty lê vơ i đương lươ ng cu a chu ng hoă c no i ca ch kha c la sô đương lươ ng cu a chu ng pha i bă ng nhau. n’A = n’B 43

1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Nguyên tố trong hợp chất Ví dụ: 44 CO : ĐC = 12/2 = 6; CO 2 : ĐC = 12/4 = 3 Fe. S : ĐFe = 56/2 = 28; ĐS = 32/2 = 16 SO 2 : ĐS = 8; ĐO = 8

1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Nguyên tố trong hợp chất Ví dụ Xác định đương lượng nitơ trong các oxít của nitơ: N 2 O, N 2 O 3, NO 2, N 2 O 5 45

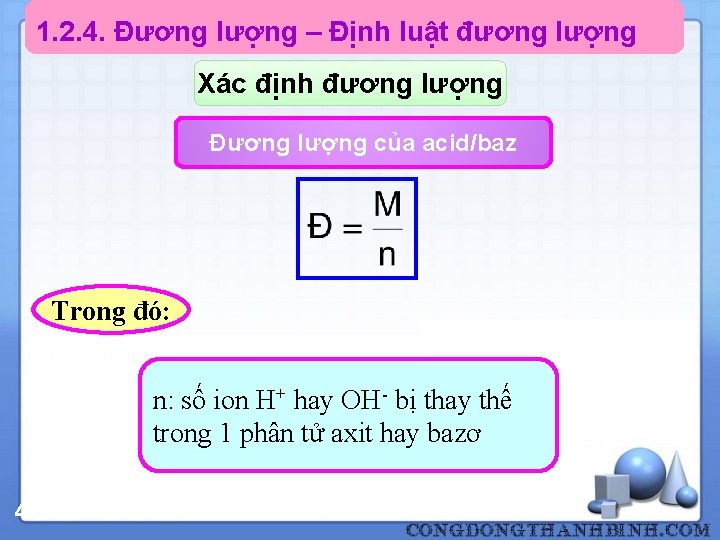
1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của acid/baz Trong đó: n: số ion H+ hay OH- bị thay thế trong 1 phân tử axit hay bazơ 46

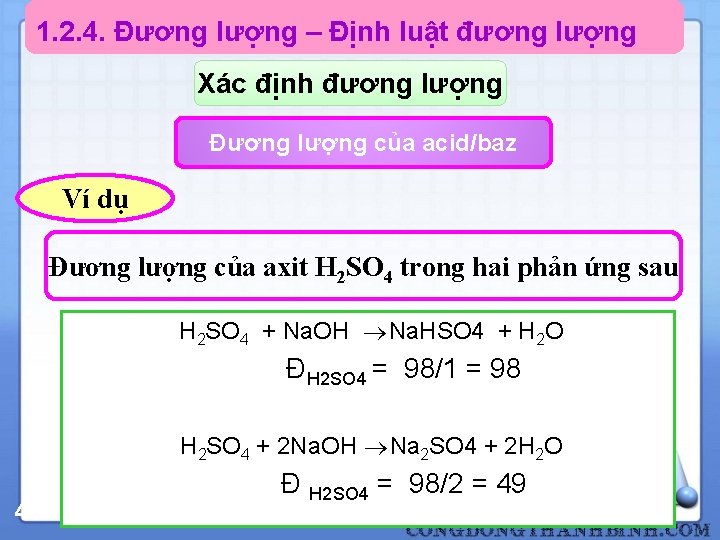
1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của acid/baz Ví dụ Đương lượng của axit H 2 SO 4 trong hai phản ứng sau H 2 SO 4 + Na. OH Na. HSO 4 + H 2 O ĐH 2 SO 4 = 98/1 = 98 H 2 SO 4 + 2 Na. OH Na 2 SO 4 + 2 H 2 O 47 Đ H 2 SO 4 = 98/2 = 49

1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của muối Trong đó: 48 n : số ion đã thay thế z : tổng điện tích dương hoặc âm tính cho 1 phân tử muối đó.

1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của muối Ví dụ Đương lượng của các chất trong phản ứng sau Fe 2(SO 4)3 + 6 Na. OH 2 Fe(OH)3 + 3 Na 2 SO 4 ĐFe 2(SO 4)3 = 400/6 = 66, 66 49

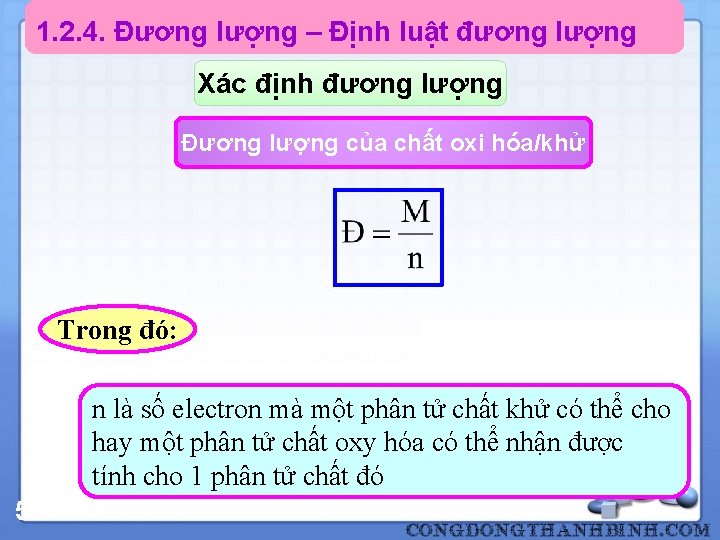
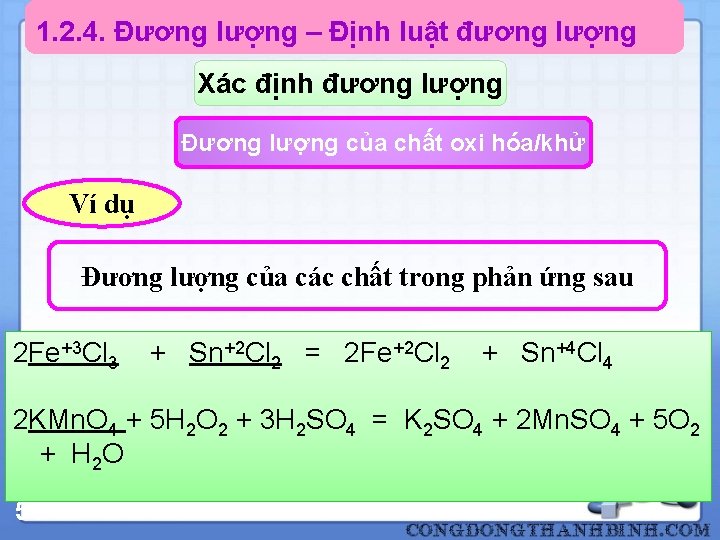
1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của chất oxi hóa/khử Trong đó: n là số electron mà một phân tử chất khử có thể cho hay một phân tử chất oxy hóa có thể nhận được tính cho 1 phân tử chất đó 50

1. 2. 4. Đương lượng – Định luật đương lượng Xác định đương lượng Đương lượng của chất oxi hóa/khử Ví dụ Đương lượng của các chất trong phản ứng sau 2 Fe+3 Cl 3 + Sn+2 Cl 2 = 2 Fe+2 Cl 2 + Sn+4 Cl 4 2 KMn. O 4 + 5 H 2 O 2 + 3 H 2 SO 4 = K 2 SO 4 + 2 Mn. SO 4 + 5 O 2 + H 2 O 51

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Khí lý tưởng Khi ly tươ ng la khi đươ c coi như không co thê ti ch riêng va không tương ta c vơ i nhau. 52

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Thông số trạng thái Thông số quy định trạng thái của các chất khí như P, V, T 53

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí lý tưởng Tra ng tha i cu a khi ly tươ ng đươ c biê u diê n bă ng phương tri nh cu a ca c thông sô tra ng tha i go i la phương tri nh tra ng tha i khi ly tươ ng. 54

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Phương trình Clapeyron – Mendenleev PV = n. RT hay PV = RT Trong đó R: Hằng số khí – ý nghĩa vật lý R: độ lớn công giãn nở của 1 mol khí lí tưởng khi tăng nhiệt độ lên 1° 55

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Phương trình Clapeyron – Mendenleev R = 8, 314. 107 erg/mol. đô = 8, 314 J/mol. đô = 62. 400 mm. Hg/mol. đô = 0, 082 atm. li t/mol. đô = 1, 987 cal/mol. đô 56

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Định luật Dalton A p suâ t chung cu a hô n hơ p ca c châ t khi không tham gia pha n ư ng ho a ho c vơ i nhau bă ng tô ng a p suâ t riêng phâ n cu a ca c châ t khi ta o nên hô n hơ p. 57

1. 2. Các định luật cơ bản 1. 2. 5. Phương trình trạng thái khí Định luật Dalton Trong đó: pi – áp suất riêng phần Ni – phần mol của khí P – Áp suất tổng của hỗn hợp khí 58

1. 2. Các định luật cơ bản 1. 2. 6. Xa c đi nh khô i lươ ng phân tư va nguyên tư Các phương pháp xác định khối lượng phân tử. 1. Phương pha p ho a ho c 2. Phương pha p vâ t ly (phương pha p quang phô khô i lươ ng) 59

1. 2. Các định luật cơ bản 1. 2. 6. Xa c đi nh khô i lươ ng phân tư va nguyên tư Xđ KLPT theo tỉ khối khí và hơi D được gọi là tỷ khối của khí A đối với khí B và: 60 Ví dụ: Tính khối lượng phân tử của khí A biết tỉ khối hơi của khí A so với khí oxy là 1, 375. Giải:

Xđ KLPT theo phương trình Claperon-Mendeleev Từ phương trình Clapeyron - Mendeleve có thể viết: Trong đó : m : khối lượng chất khí P : áp suất khí V : thể tích khí R : hằng số khí T : nhiệt độ tuyết đối 61

Xđ KLPT theo phương trình Claperon-Mendeleev Ví dụ: Tính khối lượng phân tử của một chất khí biết 3, 006 g khí này chứa trong bình kín có dung tích 26 lít, áp suất trong bình là 1, 64 atm, t = 730 C. Giải Áp dụng phương trình Clapeyron - Mendeleve: 62

Xác định khối lượng phân tử chất tan bằng phương pháp nghiệm sôi 63 Trong đó: k: hằng số nghiệm sôi hoặc nghiệm đông của dung môi m: lượng chất tan đã dùng với 1000 g dung môi ∆t: độ tăng điểm sôi hay độ giảm điểm đông đặc của dung dịch.

Xác định khối lượng phân tử chất tan bằng phương pháp nghiệm sôi Ví dụ: Dung dịch tạo thành do 9 gam chất tan hoà tan trong 100 gam nước có nhiệt độ sôi là 100, 260 C. Xác định khối lượng phân tử chất tan, biết hằng số nghiệm sôi của nước là 0, 52. Giải: Nhiệt độ sôi của nước nguyên chất: 1000 C nên Δt = 0, 26 Áp dụng công thức: 64

Xác định khối lượng phân tử chất tan bằng phương pháp thẩm thấu 65 Trong đó: m: khối lượng chất tan đã hoà tan vào dung môi (g) V: thể tích dung dịch thu được (l) R: hằng số khí T: nhiệt độ tuyệt đối (0 K) π: áp suất thẩm thấu của dung dịch (atm)

Xác định khối lượng phân tử chất tan bằng phương pháp thẩm thấu Ví dụ: Xác định khối lượng phân tử của chất A biết rằng áp suất thẩm thấu của dung dịch có 9 gam A trong 250 ml dung dịch ở 00 C là 4, 5 atm. Giải: Áp dụng công thức: 66

Xác định khối lượng phân tử chất tan bằng phương pháp Dulon – Peptit Phương pháp này áp dụng cho kim loại có khối lượng nguyên tử lớn hơn 35 đựa trên xác định nhiệt dung riêng của kim loại bằng thực nghiệm. Khối lượng nguyên tử được tính theo công thức: A: khối lượng nguyên tử kim loại c: nhiệt dung riêng của kim loại (cal) 6, 3: nhiệt dung nguyên tử của kim loại 67

Ví dụ: Xác định khối lượng nguyên tử của một kim loại có nhiệt dung riêng là 0, 093 cal/g và đương lượng là 32, 7. Giải: Khối lượng nguyên tử gần đúng của kim loại đó là: Hoá trị của kim loại là: Khối lượng nguyên tử chính xác của kim loại đó là: 68
 Chng finance
Chng finance Aka lut box
Aka lut box Cpld - pal0
Cpld - pal0 Lut moodle
Lut moodle Petteri laaksonen
Petteri laaksonen Freesurfer
Freesurfer Galati 2 20
Galati 2 20 Lut tenttiakvaario
Lut tenttiakvaario Lutram vs bram
Lutram vs bram Ev lut uskonto
Ev lut uskonto Lut to php
Lut to php Lut strategic finance
Lut strategic finance Lut msf
Lut msf Ce ti pasa tie chip de lut
Ce ti pasa tie chip de lut Lut gmdss
Lut gmdss Kauppatieteellinen ala
Kauppatieteellinen ala Lut to php
Lut to php Dhl galati
Dhl galati Freesurfer color lut
Freesurfer color lut 3-input lut example
3-input lut example Lut tenttiakvaario
Lut tenttiakvaario Vhdl full form
Vhdl full form Fornite
Fornite Vc b b
Vc b b Nim spiel
Nim spiel Nim+
Nim+ Power supply for nim instrumentation
Power supply for nim instrumentation Oh mo nim
Oh mo nim Nim dvir
Nim dvir Nim split string
Nim split string Nim esa unggul
Nim esa unggul Nim minimax
Nim minimax 9 nim sense
9 nim sense Nim allumettes
Nim allumettes Nim
Nim Nim,o
Nim,o Misere nim
Misere nim Sung nim
Sung nim Nim certificate
Nim certificate 9 nim sense
9 nim sense Income gap formula
Income gap formula Graniastosłup prosty siatka
Graniastosłup prosty siatka Nim chimsky
Nim chimsky Nim nersc
Nim nersc Siakad.uns.ac.id
Siakad.uns.ac.id Gra nim
Gra nim Nim model
Nim model Nim model police
Nim model police Khí sunfurơ kí hiệu
Khí sunfurơ kí hiệu Tiếng chổi tre
Tiếng chổi tre Nhân tế bào
Nhân tế bào Lưu ý khi sử dụng kĩ thuật khăn trải bàn
Lưu ý khi sử dụng kĩ thuật khăn trải bàn Biến đổi khí hậu ở việt nam
Biến đổi khí hậu ở việt nam Khi lên men dung dịch loãng của rượu etylic
Khi lên men dung dịch loãng của rượu etylic Vì sao cá sấu mời khỉ đến chơi nhà
Vì sao cá sấu mời khỉ đến chơi nhà Xin chúa thương gọi con về
Xin chúa thương gọi con về Anh em khỉ lấy chuối
Anh em khỉ lấy chuối Sự nuôi và dạy con của hươu
Sự nuôi và dạy con của hươu Khi cho nam châm chuyển động qua một mạch kín
Khi cho nam châm chuyển động qua một mạch kín Con hãy đưa tay khi thấy người vấp ngã
Con hãy đưa tay khi thấy người vấp ngã Khi tr
Khi tr Khi nhiệt độ của dầu vượt quá giới hạn
Khi nhiệt độ của dầu vượt quá giới hạn Khi con nghe tiếng kêu mời
Khi con nghe tiếng kêu mời Kikare tablosu
Kikare tablosu Thỏ bật nhảy xa khi chạy nhanh là nhờ
Thỏ bật nhảy xa khi chạy nhanh là nhờ Græsk tegn khi
Græsk tegn khi Rumus khi kuadrat standar deviasi
Rumus khi kuadrat standar deviasi Video ô nhiễm không khí
Video ô nhiễm không khí ôi tình yêu của chúa không bến bờ
ôi tình yêu của chúa không bến bờ