Chimie les dosages Dfinitions Raliser un dosage ou












- Slides: 15

Chimie: les dosages

Définitions Réaliser un dosage ou titrage consiste à déterminer la concentration d’une espèce en solution. Différents types de dosages: Dosage conductimétrique (TP n° 1) Dosage par étalonnage (TP n° 2) Dosage d’oxydo-réduction (TP n° 3) Dosage indirect ou par retour (TP n° 4) Dosage acido-basique (TP n° 5)

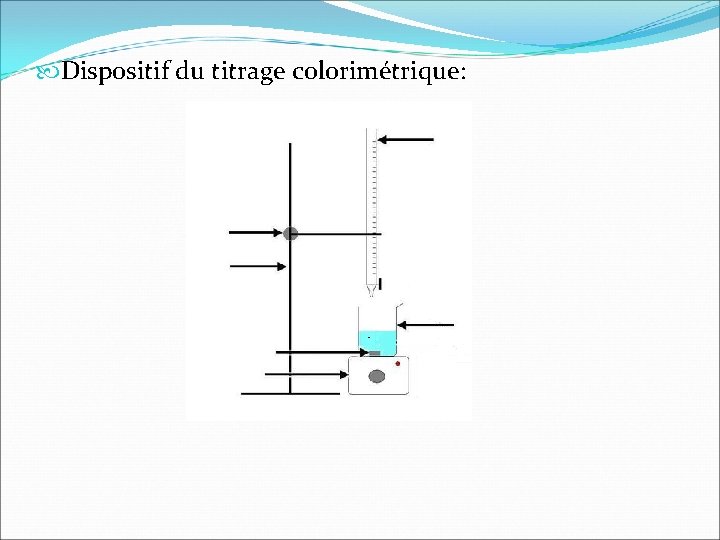
Schéma du dispositif de dosage

TPn° 1: dosage conductimétrique Formules à connaître

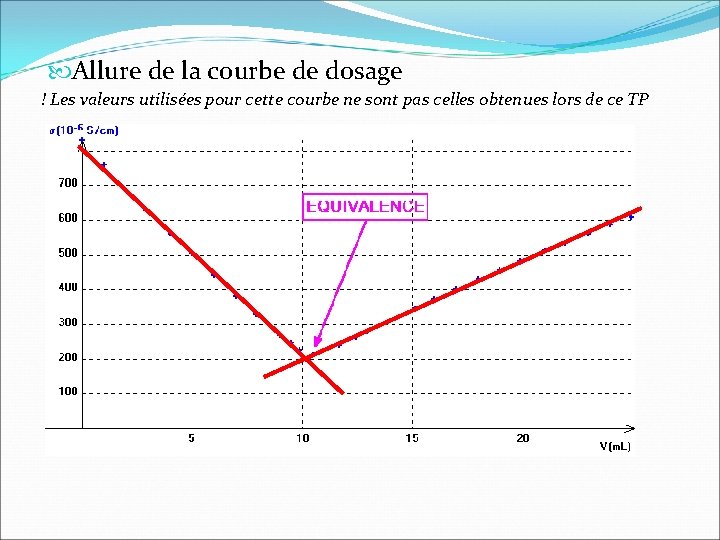
Allure de la courbe de dosage ! Les valeurs utilisées pour cette courbe ne sont pas celles obtenues lors de ce TP

TPn° 2: dosage par étalonnage On trace le graphique de l’absorbance en fonction de la concentration pour des solutions de concentration connue. On mesure l’absorbance de la solution de concentration inconnue. Puis on détermine graphiquement sa concentration

Dilution de la solution mère pour préparer les solutions de concentration connue. Lors d’une dilution la quantité de matière de soluté se conserve, donc: nmère = nfille C 0. V 0=C 1. V 1 Donc: C 1=C 0. V 0/V 1 C 1 = 1, 0. 10 -1 25, 0/50, 0 = 5, 0. 10 -2 mol/L

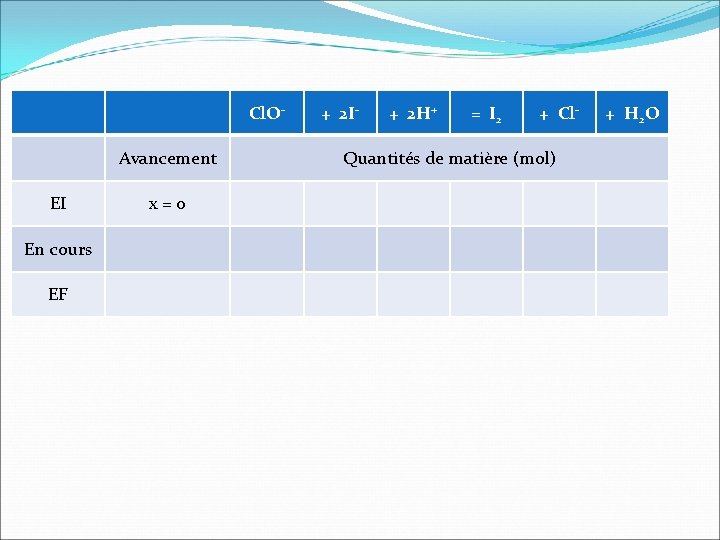
TPn° 3: Dosage d’oxydoréduction Réaction 1 Cl. O - (aq) + 2 H+(aq) + 2 e - = Cl - (aq) + H 2 O ( l ) I 2 (aq) + 2 e - = 2 I -(aq) (demi-éq à « retourner » ) Cl. O - (aq) + 2 H+(aq) + 2 I - (aq) = I 2 (aq) + Cl - (aq) + H 2 O ( l ) Réaction 2 I 2 (aq) + 2 e - = 2 I - (aq) S 4 O 6 2 - (aq) + 2 e - = 2 S 2 O 3 2 - (aq) (demi-éq à « retourner » ) I 2 (aq) + 2 S 2 O 3 2 - (aq)= S 4 O 6 2 - (aq) + 2 I - (aq)

La solution S’ est obtenue par dilution de la solution S d’un facteur 10. Lors d’une dilution la quantité de matière de soluté se conserve, donc: n. S = n. S’ C. V=C’. V’ Donc: V = C’. V’/C = (C/10). V’/C =V’/10 Il faut prélever 10, 0 m. L de solution S avec une pipette jaugée. Bécher contenant environ 20 m. L de S Pipette jaugée de 10, 0 m. L Fiole jaugée de 100 m. L

Dispositif du titrage colorimétrique:

Equivalence: introduction des réactifs en proportions stœchiométriques. Rappel: a. A +b. B c. C +d. D Les proportions stoechiométriques sont: n(A)/a =n(B) /b Equation du dosage: I 2 (aq) + 2 S 2 O 3 2 - (aq)=S 4 O 6 2 - (aq) +2 I - (aq) Donc à l’équivalence: n(I 2 )=n(S 2 O 3 2 - )/2

Cl. OAvancement EI En cours EF x = 0 + 2 I- + 2 H+ = I 2 + Cl- Quantités de matière (mol) + H 2 O

TPn° 4: dosage en retour Il existe deux types de dosages: direct indirect n (acide ascorbique) quantité inconnue n (diiode)total quantité connue n (diiode)qui a réagi avec l’acide ascorbique n (diiode)en excès déterminée par dosage

II. Dosage d’une solution de diiode 2. Demi-équations I 2 (aq) + 2 e - = 2 I - (aq) S 4 O 6 2 - (aq) + 2 e - = 2 S 2 O 3 2 - (aq) 3. Equation du dosage I 2 (aq) + 2 S 2 O 3 2 - (aq)= S 4 O 6 2 - (aq) + 2 I - (aq) 4. Relation entre les quantités de matière A l’équivalence, les réactifs de l’équation du dosage sont en proportion stœchiométrique, donc: n(I 2) = n(S 2 O 32 - ) / 2 Concentration en diiode: [I 2] VI 2 = [S 2 O 32 - ] VE / 2 1. Volume versé à l’équivalence VE = [I 2] = [S 2 O 32 - ] VE / ( 2 VI 2 ) [I 2] =

III. Dosage de la vitamine C Choix de la verrerie 4 - Prélever 10, 0 m. L de la solution S’ et les verser dans un bécher. Y ajouter environ 10 m. L de solution d’acide phosphorique à 5%, puis 10, 0 m. L de solution de diode de concentration connue (voir I). Enfin, rajouter un peu d’empois d’amidon. Laisser réagir quelques minutes.





























