Chimica organica percorso di recupero e ripasso Alcani












- Slides: 21

Chimica organica percorso di recupero e ripasso Alcani, isomeria

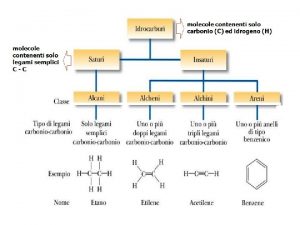
Una panoramica I più semplici composti organici sono gli idrocarburi formati da carbonio e idrogeno Idrocarburi Alcani Cicloalcani Alcheni Saturi Insaturi Aperti Ciclici X X X Alchini X X Aromatici X Di e polieni X X X 2

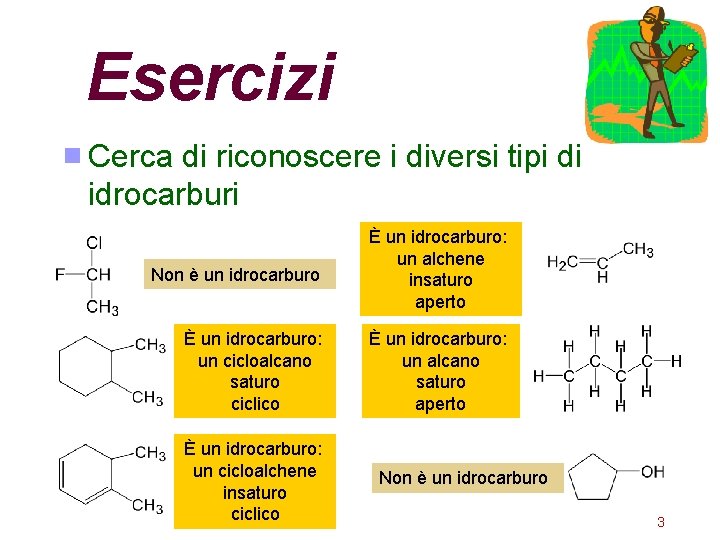
Esercizi Cerca di riconoscere i diversi tipi di idrocarburi Non è un idrocarburo È un idrocarburo: un alchene insaturo aperto È un idrocarburo: un cicloalcano saturo ciclico È un idrocarburo: un alcano saturo aperto È un idrocarburo: un cicloalchene insaturo ciclico Non è un idrocarburo 3

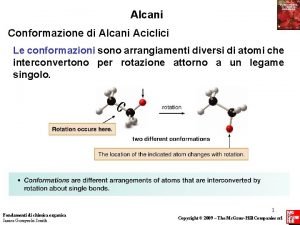
Alcani La formula generale degli alcani è Cn. H 2 n+2 Gli atomi di carbonio sono tutti ibridati sp 3 La geometria di tutti gli atomi di carbonio è tetraedrica (angoli di 109, 5°) La molecola è formata esclusivamente da legami di tipo L’alcano più semplice ha 1 atomo di carbonio e 4 atomi di idrogeno (CH 4) Il suo nome è metano 4

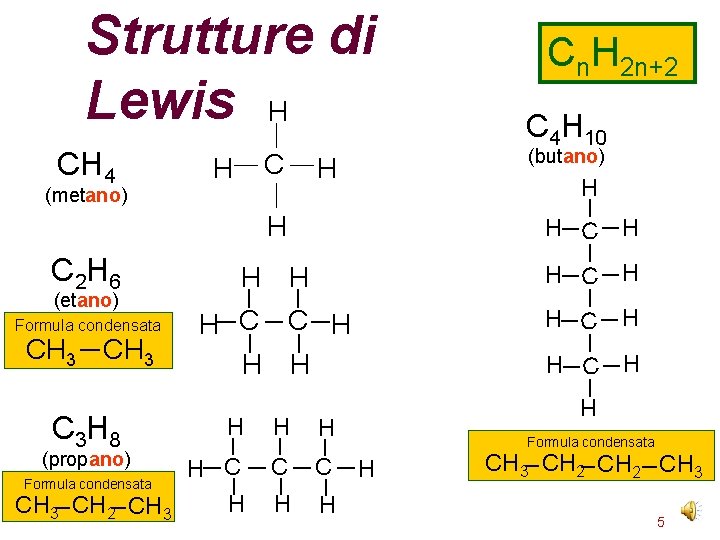
Strutture di Lewis H (metano) C 2 H 6 (etano) Formula condensata CH 3 C 3 H 8 (propano) Formula condensata CH 3 CH 2 CH 3 C H C 4 H 10 (butano) H H H H C C H H H H H C C H H H CH 4 Cn. H 2 n+2 Formula condensata H CH 3 CH 2 CH 3 5

La serie omologa La serie degli alcani rappresenta una serie omologa Ciascun composto ha un atomo di carbonio in più (la catena si allunga) Le proprietà fisiche variano con una certa regolarità (massa, p. f. , p. e. , solubilità) Certe proprietà chimiche vengono esaltate altre si affievoliscono Pentano (C 5 H 12 CH 3 -CH 2 - CH 3) Esano (C 6 H 14 CH 3 -CH 2 - CH 2 -CH 3) Eptano (C 7 H 16 CH 3 -CH 2 - CH 2 -CH 3) Ottano (C 8 H 18 CH 3 -CH 2 - CH 2 -CH 3) 6

Cicloalcani La formula generale dei cicloalcani è Cn. H 2 n Dove n =3, 4, ecc. Tutti gli atomi di carbonio sono ibridati sp 3 Tutti i legami sono di tipo Gli angoli dovrebbero essere tetraedrici (109, 5°) H H CH 2 C C 3 H 6 H C C H H 2 C 60° CH 2 7

La serie Gli angoli di legame aumentano come aumentano gli atomi di carbonio Quando diventano 6 gli angoli sono quelli tipici tetraedrici ciclobutano H 2 C CH 2 ciclopentano cicloesano CH 2 H 2 C CH 2 8

L’isomeria di catena Provate a costruire la molecola del C 4 H 10 Costruite altre molecole (sempre con 4 atomi di carbonio) modificando lo scheletro degli atomi di carbonio C C C C Tutti gli atomi di carbonio rossi sono atomi primari Gli atomi azzurri sono secondari L’atomo verde è terziario Verifica se gli atomi di idrogeno corrispondono nelle due strutture 9

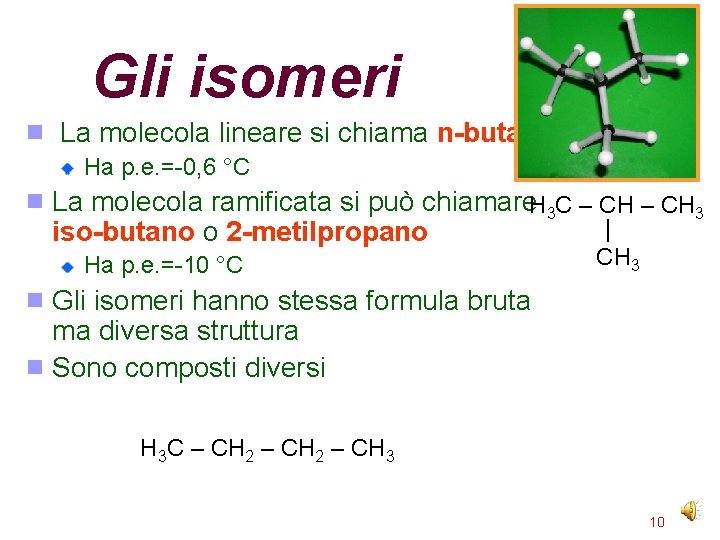
Gli isomeri La molecola lineare si chiama n-butano Ha p. e. =-0, 6 °C La molecola ramificata si può chiamare. H 3 C – CH 3 | iso-butano o 2 -metilpropano Ha p. e. =-10 °C CH 3 Gli isomeri hanno stessa formula bruta ma diversa struttura Sono composti diversi H 3 C – CH 2 – CH 3 10

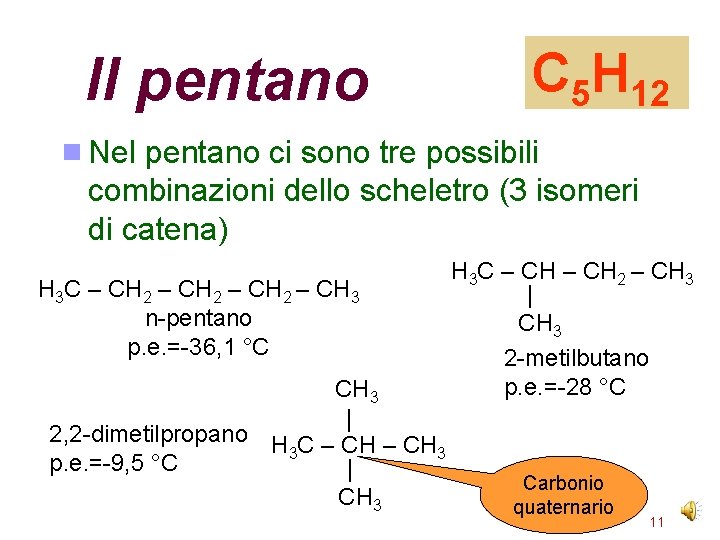
Il pentano C 5 H 12 Nel pentano ci sono tre possibili combinazioni dello scheletro (3 isomeri di catena) H 3 C – CH 2 – CH 3 n-pentano p. e. =-36, 1 °C CH 3 | 2, 2 -dimetilpropano H C – CH 3 3 p. e. =-9, 5 °C | CH 3 H 3 C – CH 2 – CH 3 | CH 3 2 -metilbutano p. e. =-28 °C Carbonio quaternario 11

Esercizi Disegna i 5 isomeri dell’esano 12

Isomeria nei cicloalcani Anche nei cicloalcani si può osservare il fenomeno di isomeria di posizione Per esempio nei derivati ramificati del ciclobutano Hanno stessa formula bruta ma diversa struttura 13

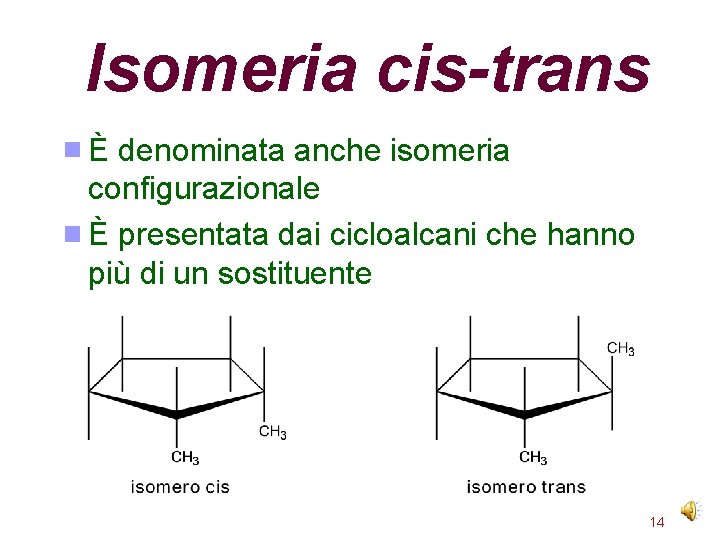
Isomeria cis-trans È denominata anche isomeria configurazionale È presentata dai cicloalcani che hanno più di un sostituente 14

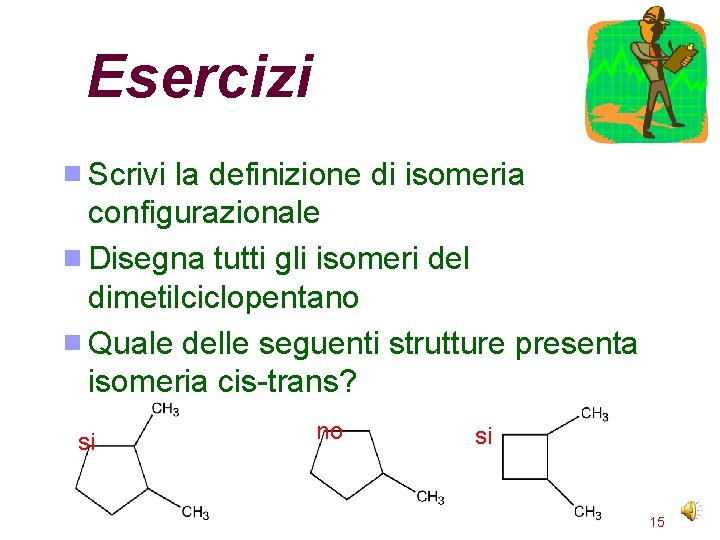
Esercizi Scrivi la definizione di isomeria configurazionale Disegna tutti gli isomeri del dimetilciclopentano Quale delle seguenti strutture presenta isomeria cis-trans? si no si 15

Nomenclatura La nomenclatura delle sostanze organiche è regolata dalla IUPAC I primi 4 alcani hanno nomi di fantasia Gli altri hanno nomi regolari (che derivano dal numero di atomi di carbonio nella molecola) Il nome deve essere seguito dal suffisso -ano Pentano Esano Eptano Ottano Nonano Decano 16

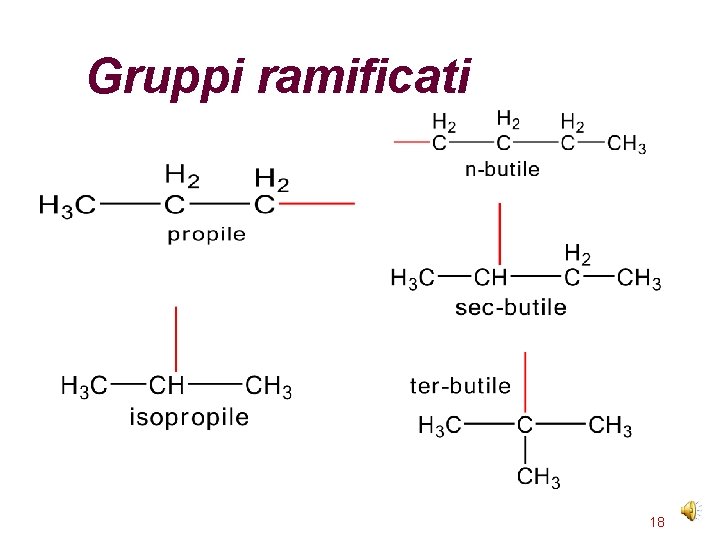
Gruppi alchilici Per gli idrocarburi ramificati bisogna saper dare un nome a particolari frammenti di strutture organiche Questi frammenti sono i gruppi alchilici Tali raggruppamenti si ottengono eliminando un atomo di idrogeno da una molecola e lasciando libero un legame Il nome del gruppo alchilico si ottiene sostituendo -ano con -ile CH 4 metano CH 3 - metile C 2 H 4 etano CH 3 -CH 2 - etile 17

Gruppi ramificati 18

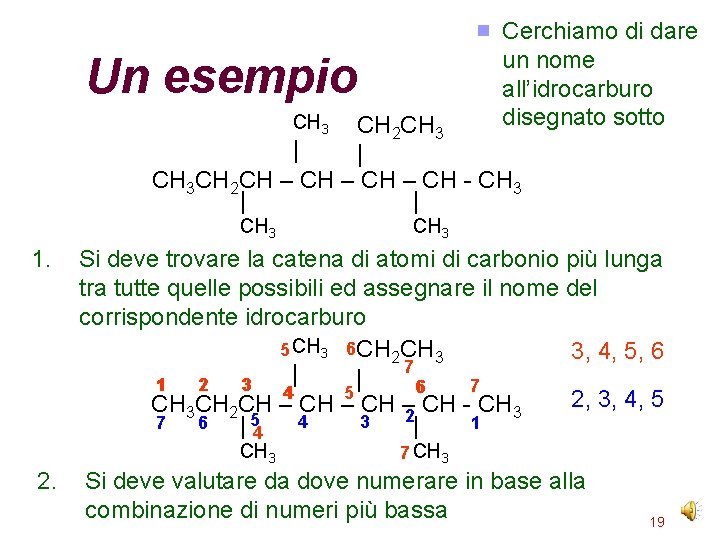
Cerchiamo di dare un nome all’idrocarburo disegnato sotto Un esempio CH 3 CH 2 CH 3 | | CH 3 CH 2 CH – CH - CH 3 | | CH 3 1. Si deve trovare la catena di atomi di carbonio più lunga tra tutte quelle possibili ed assegnare il nome del corrispondente idrocarburo 5 CH 3 6 CH 2 CH 3 3, 4, 5, 6 7 | | 1 2 3 7 6 5 4 2, 3, 4, 5 CH 3 CH 2 CH – 2 CH - CH 3 3 7 6 1 | 54 4 | CH 3 2. CH 3 7 CH 3 Si deve valutare da dove numerare in base alla combinazione di numeri più bassa 19

Esempio (continua) 3. Il composto quindi è un eptano (7 atomi di carbonio) CH CH 33 CH 2 CH 3 || | 3 - etil-2, 4, 5 -tri-metileptano CH 3 CH 2 CH – CH - CH 3 2 4 3 7 6 1 |5 | CH 3 4. Si devono aggiungere al nome di base i nomi dei gruppi che costituiscono le ramificazioni: Metile (metil) Etile (etil) 5. I gruppi devono essere ordinati in ordine alfabetico (etile, metile); devono essere preceduti dal numero dell’atomo di carbonio e si deve indicare quanti 20 sono i gruppi

Esercizio Assegnare il nome al seguente composto: CH 3 - CH 3 |5 1 2 3 4 6 7 8 9 CH 3 - CH 2 – CH 2 - CH 2 – CH 3 | C 3 H 7 C’è un gruppo propilico in posizione 4 C’è un gruppo iso-propilico in posizione 5 5 -isopropil- 4 -propil nonano 21
 Alcani chimica organica
Alcani chimica organica Carbonio metabolismo biotech soluzioni
Carbonio metabolismo biotech soluzioni Chimica organica
Chimica organica Composti organici mappa concettuale
Composti organici mappa concettuale Chimica organica
Chimica organica Chimica organica
Chimica organica Definizione chimica organica
Definizione chimica organica Chimica organica
Chimica organica Loudon chimica organica
Loudon chimica organica Gruppo funzionale benzene
Gruppo funzionale benzene Fondamenti di chimica organica smith usato
Fondamenti di chimica organica smith usato Recupero acque piovane normativa
Recupero acque piovane normativa Recupero fatti numerici
Recupero fatti numerici Recupero de gastos
Recupero de gastos Fatti numerici cosa sono
Fatti numerici cosa sono Simboli matematici significato
Simboli matematici significato Grammatica latina ripasso
Grammatica latina ripasso Ripasso disequazioni
Ripasso disequazioni Ripasso promessi sposi
Ripasso promessi sposi Occasa
Occasa Campolieti valpolicella ripasso 2010
Campolieti valpolicella ripasso 2010 Ripasso letteratura italiana
Ripasso letteratura italiana