Chimica Fisica Biologica Determinazione della struttura delle proteine

Chimica Fisica Biologica Determinazione della struttura delle proteine Gaetano M. M. Izzo

Introduzione Per lo studio della struttura di molecole proteiche vengono utilizzate diverse tecniche: Struttura Primaria Struttura Quaternaria di grosse proteine o aggregati (virus, ribosomi, etc. ) Metodi Biochimici (determinazione diretta della sequenza aa o indirettamente dalla sequenza nucleotidica del gene) Microscopia Elettron. (informazioni con risoluzioni molto basse o prive di dettagli, in alcuni casi il percorso della catena polipeptidica)

La determinazione della struttura secondaria e terziaria richiede una informazione dettagliata sulla disposizione degli atomi in una proteina. Le strutture proteiche a livello di struttura secondaria e terziaria vengono determinate mediante metodi fisici di cui i principali sono: ü Cristallografia a RX ü Metodi NMR La maggior parte delle strutture proteiche viene determinata mediante cristallografia a raggi X, mentre sono stati sviluppati metodi NMR per ottenere modelli tridimensionali di piccole molecole proteiche (informazioni sulle distanze tra gli atomi, NMR bidimensionale, spettri COSY e NOE).

Cristallografia a Raggi X La diffrazione di RX (o cristallografia RX) è la principale tecnica di determinazione strutturale per le proteine (80% strutture proteiche presenti in PDB, 95% di quelle con più di 80 aa). Principio fisico: Scattering dei RX da parte degli elettroni Richiede la disponibilità di cristalli. Permette di avere una risoluzione atomica. Si possono studiare proteine con PM fino a ca. 10000 KDa Applicazioni: piccole molecole, proteine, virus, ribosomi

Cristallografia RX di proteine • Cristallizzazione • Raccolta dati • Risoluzione, affinamento e analisi strutturale (determinazione della fase e model building).

Cristalli di proteine - Caratteristiche La cristallizzazione di una proteina è generalmente difficile, la crescita dei cristalli può essere molto lenta ed ottenere cristalli sufficientemente grandi (>0. 5 mm) può richiedere diversi mesi. Ciò che rende i cristalli proteici diversi da quelli di una piccola molecola è il contenuto in solvente: nei cristalli delle molecole tutti gli atomi possono essere descritti in termini di reticolo regolare, mentre per i cristalli proteici un reticolo cristallino coesiste con un elevata quantità di materia allo stato liquido. La soluzione madre, il cui contenuto nel cristallo può variare ca. dal 30 all’ 80%, ha una forte influenza sul comportamento dei cristalli stessi determinandone pregi e difetti caratteristici tra cui il principale è il fatto che i cristalli proteici sono molto meno ordinati dei cristalli classici, sia per l’elevato contenuto di materiale disordinato presente all’interno del cristallo, ma anche perché i gruppi sulla superficie della macromolecola in contatto con il solvente possono avere una forte mobilità.

Cristalli di proteine - Caratteristiche Per questo motivo, i dati di diffrazione non possono essere misurati con la risoluzione che normalmente si può ottenere con le piccole molecole. D’altra parte, però, l’ambiente in cui si trova la macromolecola nel cristallo non è molto diverso da quello della soluzione da cui è stato ottenuto (non va sottovalutata l’influenza del solvente sulla conformazione della proteina) e si può trarre vantaggio dalla presenza di solvente per la preparazione di derivati di atomi pesanti della proteina (MIR). I cristalli proteici sono quindi molto fragili e ‘morbidi’. Inoltre, nei cristalli proteici non sono permessi gli elementi di simmetria che implicano inversione, per cui il numero di possibili gruppi spaziali scende da 230 a 65.

Cristallizzazione Il processo di cristallizzazione di una macromolecola è molto complesso ed una spiegazione teorica di tutti i suoi aspetti è impossibile. Tuttavia dall’esperienza su di un elevato numero di proteine idrosolubili cristallizzate e con la disponibilità di una quantità di proteina sufficiente e ad elevata purezza, si hanno buone probabilità di ottenere cristalli utilizzabili per i RX. Molto più complessa la situazione per le proteine di membrana. La crescita di cristalli proteici avviene da una soluzione soprasatura della macromolecola attraverso uno stato termodinamicamente stabile nel quale la proteina è distribuita tra una fase solida e la soluzione. Il tempo necessario per raggiungere questo equilibrio ha una forte influenza sul risultato finale che può andare da un precipitato amorfo o microcristallino a grandi cristalli singoli. Le condizioni di soprasaturazione possono essere ottenute aggiungendo agenti precipitanti o modificando alcuni parametri interni alla soluzione come p. H e T. Vanno tuttavia evitate le condizioni estreme poiché la proteina e’ una molecola ‘labile’. Per comprendere meglio le proprietà biologiche e fisiologiche della macromolecola attraverso la determinazione della struttura 3 D è molto meglio crescere i cristalli in condizioni non troppo lontane da quelle fisiologiche in cui la molecola svolge la sua attività. Per studiare il processo di cristallizzazione si può far riferimento ai diagrammi di fase.

Cristallizzazione – Diagrammi di fase La solubilità di una proteina può essere rappresentata con un diagramma di fase (Curva di solubilità della proteina). • Asse orizzontale: parametro che viene variato (di solito la conc. di precipitante) • Asse verticale: Conc. proteina. • La saturazione si ottiene quando la velocità con cui la proteina passa nella fase solida è uguale a quella con cui passa in soluzione ed il sistema è all’equilibrio. • Salting-out sulla destra del diagramma • dove la solubilità della proteina diminuisce con l’aumento della conc. salina. Salting-in sulla sinistra del diagramma dove la solubilità della proteina aumenta all’aumentare dela conc. del sale.

• Come può diventare soprasatura una soluzione proteica? ü • ü ü Perché la proteina non precipita immediatamente appena si raggiunge la saturazione della soluzione? Perché permettere ad una proteina di cristallizzare deve essere superata una barriera energetica analoga a quella delle reazioni chimiche. Esiste una barriera energetica da superare per la cristallizzazione: Il nucleo critico di cristallizzazione corrisponde all’intermedio. Più elevata è la barriera energetica, minore è la velocità di nucleazione.

• La probabilità di nucleazione aumenta all’aumentare della soprasaturazione: ü Piu’ soprasatura è la soluzione proteica, maggiore è la probabilità che si formi un centro di nucleazione e minore sarà il numero di nuclei necessari per indurre la formazione di un cristallo. Tutto ciò si può rappresentare su un diagramma di fase suddividendo la zona di soprasaturazione in diverse regioni di probabilità crescente di nucleazione e precipitazione.

Cristallizzazione – Agenti precipitanti I precipitanti comunemente utilizzati possono essere suddivisi in 3 categorie: Ø Sali (inorganici: AS, Na 2 SO 4, Na. Cl, KCl, NH 4 Cl, Mg. SO 4, Ca. Cl 2, NH 4 NO 3, Li. Cl, etc. – organici: Citrato, Acetato, Formiato, etc. ) Ø Solventi organici (Et. OH, Isopropanolo, Acetone, Diossano, 2 metil-2, 4 -pentandiolo (MPD), etc. ) Ø PEG ( da 200 a 20 K e PEG MME).

Cristallizzazione – Fattori che la influenzano Parametri che influenzano la cristallizzazione: Ø p. H: il suo valore ha forte influenza sulla solubilità, la quale ha un minimo a p. H vicini al punto isoelettrico della mm. Ø Conc. Salina: La forza ionica può avere effetti opposti sulla solubilità della proteina, ad esempio la solubilità diminuisce all’aumentare della forza ionica (salting-out), ma ha anche un minimo a forza ionica molto bassa (salting-in). In pratica si può avere precipitazione aumentando la conc. Salina o dializzando la soluzione di proteina contro acqua. Ø Solventi organici: Le loro proprietà di precipitazione sono dovute al doppio effetto di sottrarre molecole d’acqua dalla soluzione e dal diminuire la costante dielettrica del mezzo. Essi però possono avere anche effetti sulla conformazione della proteina e vanno quindi utilizzati con cautela. Ø PEG: e’ un agente precipitante con proprietà peculiari: è un polimero, il suo effetto sulla solubilità è dovuto alla proprietà del volume di esclusione; il solvente viene ristrutturato e di conseguenza viene promossa la separazione di fase. Molti altri parametri possono influenzare il processo di cristallizzazione: la conc. di proteina, la temperatura, la presenza di cationi che a volte stabilizzano la conformazione della proteina, la purezza del campione. La presenza di contaminanti può essere molto importante nell’impedire la formazione di cristalli adatti all’analisi ai RX.

Cristallizzazione - Metodi Esistono diversi metodi per cristallizzare le proteine, i più usati sfruttano l’equilibrio in fase vapore e la dialisi: ØMetodi di diffusione di vapore ØTecniche di dialisi La crescita dei cristalli e la nucleazione non dipendono solo dai parametri visti, ma anche dal metodo utilizzato. Si usano incubatori termici per mantenere la T costante.
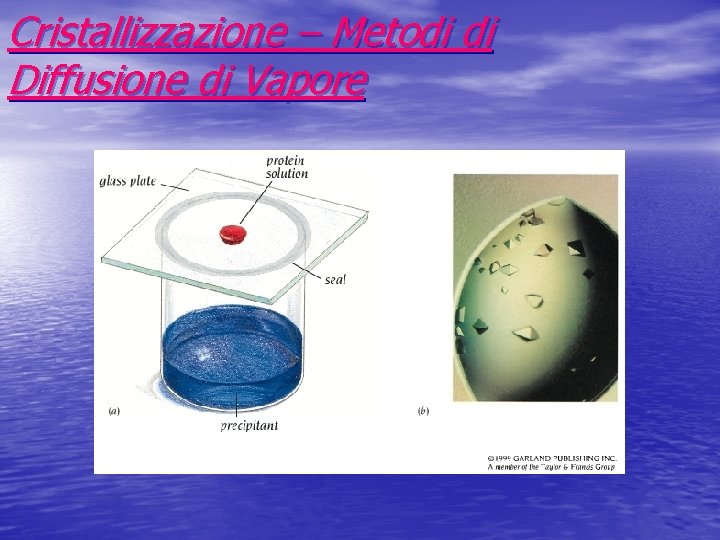
Cristallizzazione – Metodi di Diffusione di Vapore
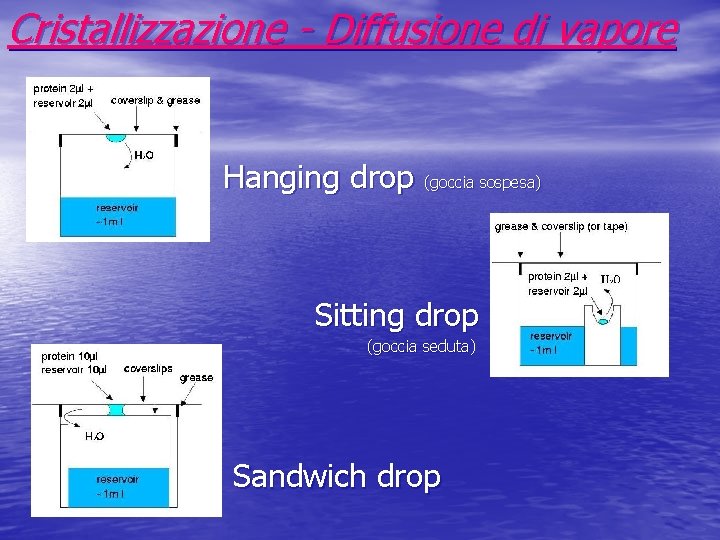
Cristallizzazione - Diffusione di vapore Hanging drop (goccia sospesa) Sitting drop (goccia seduta) Sandwich drop
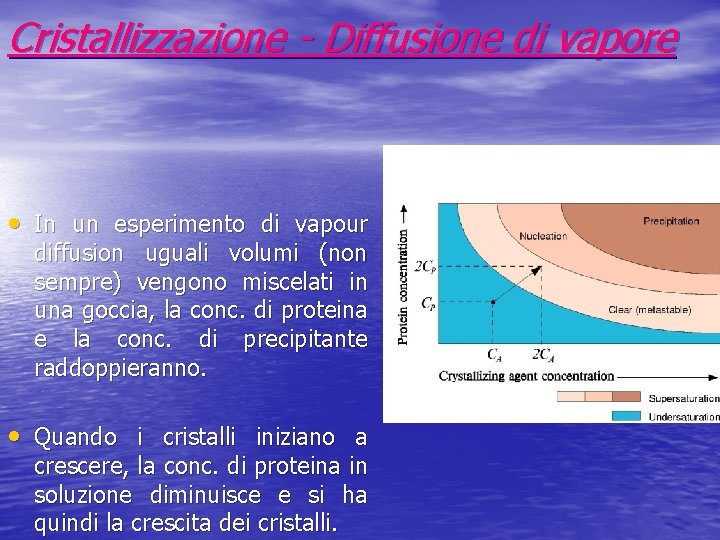
Cristallizzazione - Diffusione di vapore • In un esperimento di vapour diffusion uguali volumi (non sempre) vengono miscelati in una goccia, la conc. di proteina e la conc. di precipitante raddoppieranno. • Quando i cristalli iniziano a crescere, la conc. di proteina in soluzione diminuisce e si ha quindi la crescita dei cristalli.

Setting esperimenti di cristallizzazione

Cristallizzazione - Dialisi Microdialisi: Set up di un esperimento con un bottone di dialisi.
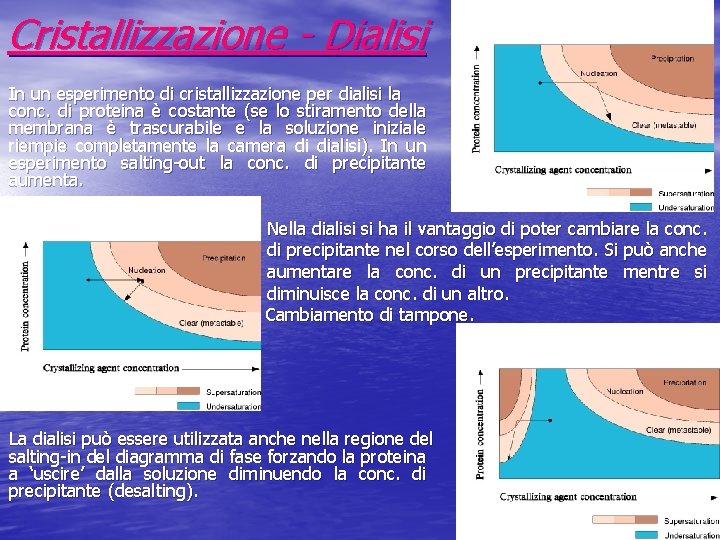
Cristallizzazione - Dialisi In un esperimento di cristallizzazione per dialisi la conc. di proteina è costante (se lo stiramento della membrana è trascurabile e la soluzione iniziale riempie completamente la camera di dialisi). In un esperimento salting-out la conc. di precipitante aumenta. Nella dialisi si ha il vantaggio di poter cambiare la conc. di precipitante nel corso dell’esperimento. Si può anche aumentare la conc. di un precipitante mentre si diminuisce la conc. di un altro. Cambiamento di tampone. La dialisi può essere utilizzata anche nella regione del salting-in del diagramma di fase forzando la proteina a ‘uscire’ dalla soluzione diminuendo la conc. di precipitante (desalting).

Cristalli proteici Poiché in un cristallo proteico vi sono poche interazioni dirette di impaccamento tra le molecole di proteina, piccole variazioni della soluzione di cristallizzazione, come ad esempio piccole variazioni nel p. H, possono portare ad avere impaccamenti diversi e si possono quindi ottenere forme cristalline differenti. Le strutture di alcune molecole di proteina (ad esempio il lisozoma e la mioglobina) sono quindi state determinate in diverse forme cristalline, ma risultano sostanzialmente uguali, ad eccezione di alcune catene laterali che sono coinvolte nell’impaccamento. Proprio perché le interazioni tra le molecole proteiche in un cristallo sono poche, esse non modificano la struttura complessiva della proteina anche avendo un diverso impaccamento. Tuttavia, diverse forme cristalline possono avere un diverso grado di ordine e quindi dare un quadro di diffrazione di diversa qualità. In generale, più le molecole sono strettamente impaccate e quindi meno acqua contiene il cristallo, migliore è la diffrazione che si ottiene poichè le molecole nel cristallo sono più ordinate.
- Slides: 21