Chemie Chemie ist Wissenschaft von den GrundElementen ihren





















![10 er Potenzen H+ Konzentration [mol/L] 10 er Potenz Schreibweise p. H 0, 0000001 10 er Potenzen H+ Konzentration [mol/L] 10 er Potenz Schreibweise p. H 0, 0000001](https://slidetodoc.com/presentation_image/444bc71548d0152eebc8be64cb0cb493/image-38.jpg)






































- Slides: 113

Chemie

Chemie ist… Wissenschaft von den (Grund-)Elementen, ihren Eigenschaften und ihren Verbindungen

Heute am Programm: • Anorganische Chemie (2 h) – Atombau – Bindungsarten – Säuren und Basen • Organische Chemie (2 h) – Funktionelle Gruppen – Proteine – Kohlenhydrate • Experimente und Präsentationen (2 h)

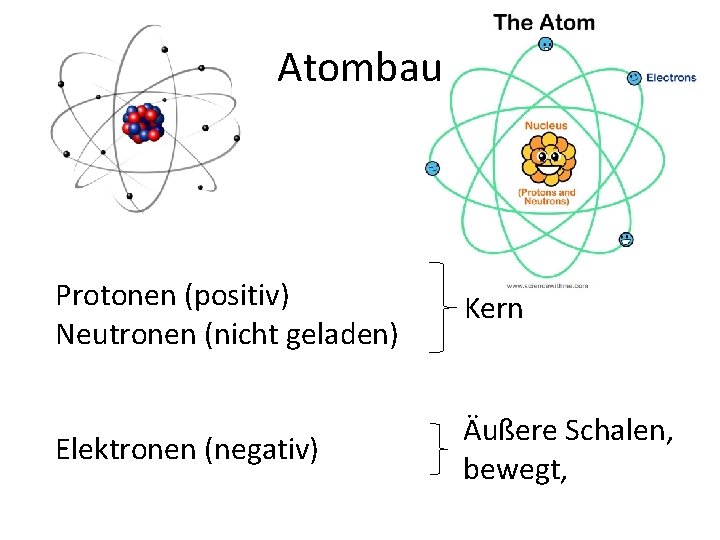
Was ist ein Atom? • Chemisch nicht teilbar (griechisch ἄτομος‚ unteilbar) • Kleinsten Teilchen der Elemente • Durchmesser ungefähr ein Zehnmillionstel Millimeter

Atombau Protonen (positiv) Neutronen (nicht geladen) Kern Elektronen (negativ) Äußere Schalen, bewegt,

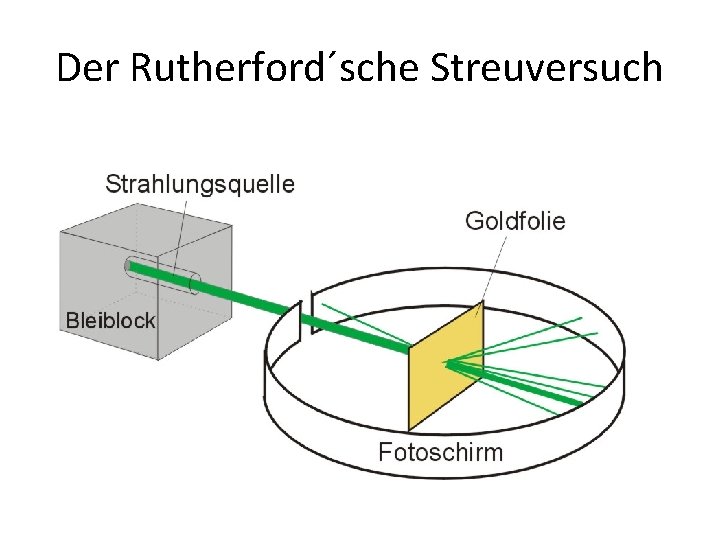
Der Rutherford´sche Streuversuch

Kernteilchen und ihre Eigenschaften Name Ort Ladung Bewegung Masse (ja/nein)

Kernteilchen und ihre Eigenschaften Name Ort Ladung Bewegung Masse (ja/nein) Protonen Kern Positiv Nein Ja Neutronen Kern Keine Nein Ja Elektronen Schalen/Or bitale Negativ Ja Nein

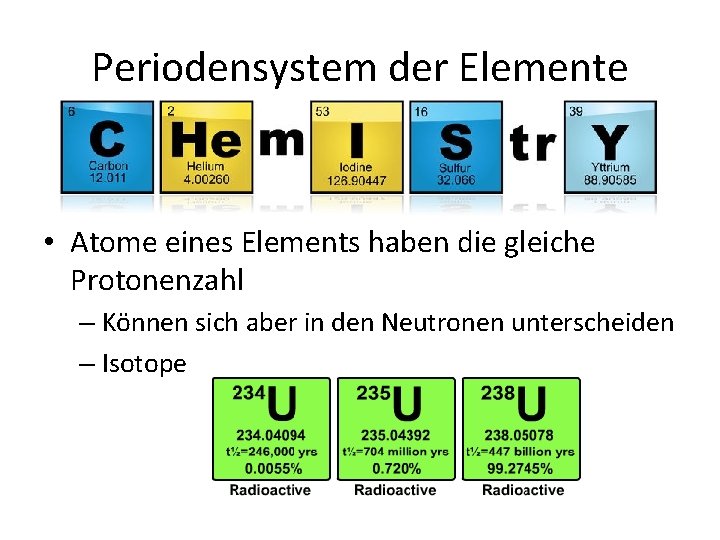
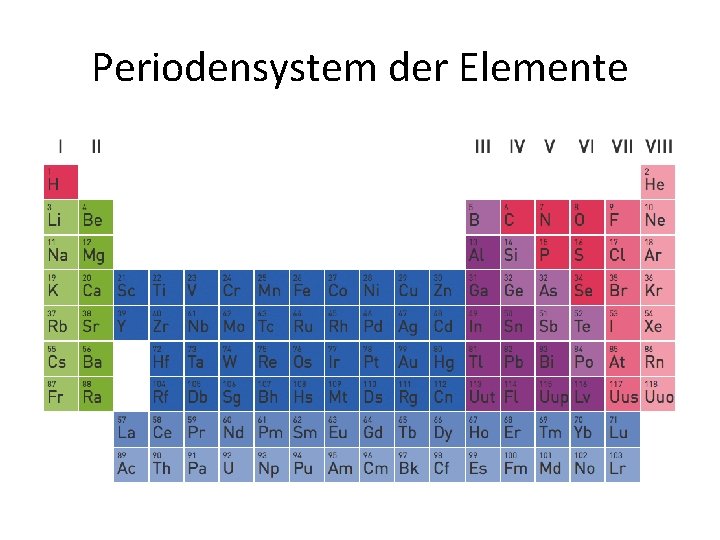
Periodensystem der Elemente • Atome eines Elements haben die gleiche Protonenzahl – Können sich aber in den Neutronen unterscheiden – Isotope

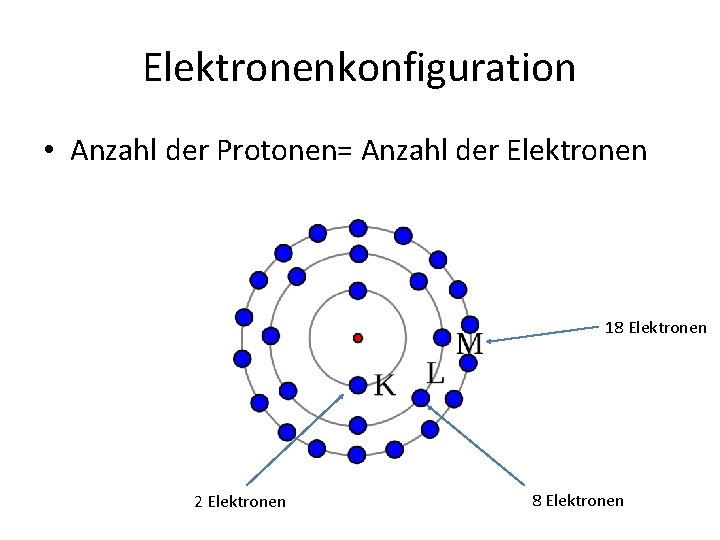
Elektronenkonfiguration • Anzahl der Protonen= Anzahl der Elektronen 18 Elektronen 2 Elektronen 8 Elektronen

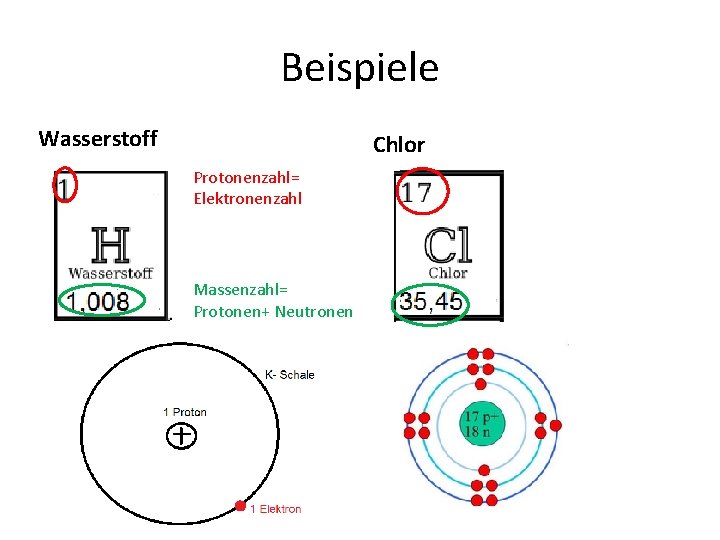
Beispiele Wasserstoff Chlor Protonenzahl= Elektronenzahl Massenzahl= Protonen+ Neutronen

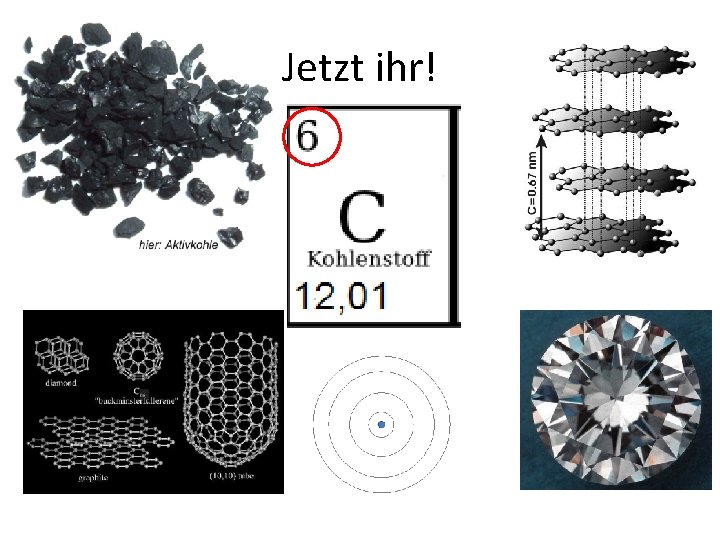
Jetzt ihr!

Periodensystem der Elemente

Flammenfärbung • Vaenzelektronen werden in höhere Schale gehoben und springen zurück • Dabei geben sie Energie (Licht) ab – Charakteristisch für ein Element


Welche 4 Aussagen sind richtig? Elektronen sind für die Masse eines Atoms verantwortlich Nur Protonen sind für die Masse eines Atoms verantwortlich Je mehr Neutronen, desto stabiler ist ein Atom Elektronen kreisen um den Atomkern Elektronen und Protonen sind ungefähr gleich groß Neutronen und Protonen haben eine Masse Der Kern macht volumsmäßig den Großteil eines Atoms aus Die Anzahl der Elektronen eines Atoms lässt sich aus dem Periodensystem ablesen Isotopen unterscheiden sich durch ihre Masse Es gibt immer gleich viele Neutronen wie Protonen Atome kann man nicht teilen Isotopen unterscheiden sich durch ihre Ordnungzahl Die Massenzahl eines chemischen Elements ist immer eine ganze Zahl Die Ladungen sind gleichmäßig über das ganze Atom verteilt

Diese 4 Aussagen sind richtig? Elektronen sind für die Masse eines Atoms verantwortlich Nur Protonen sind für die Masse eines Atoms verantwortlich Je mehr Neutronen, desto stabiler ist ein Atom Elektronen kreisen um den Atomkern Elektronen und Protonen sind ungefähr gleich groß Neutronen und Protonen haben eine Masse Der Kern macht volumsmäßig den Großteil eines Atoms aus Die Anzahl der Elektronen eines Atoms lässt sich aus dem Periodensystem ablesen Isotopen unterscheiden sich durch ihre Masse Es gibt immer gleich viele Neutronen wie Protonen Atome kann man nicht teilen Isotopen unterscheiden sich durch ihre Ordnungzahl Die Massenzahl eines chemischen Elements ist immer eine ganze Zahl Die Ladungen sind gleichmäßig über das ganze Atom verteilt

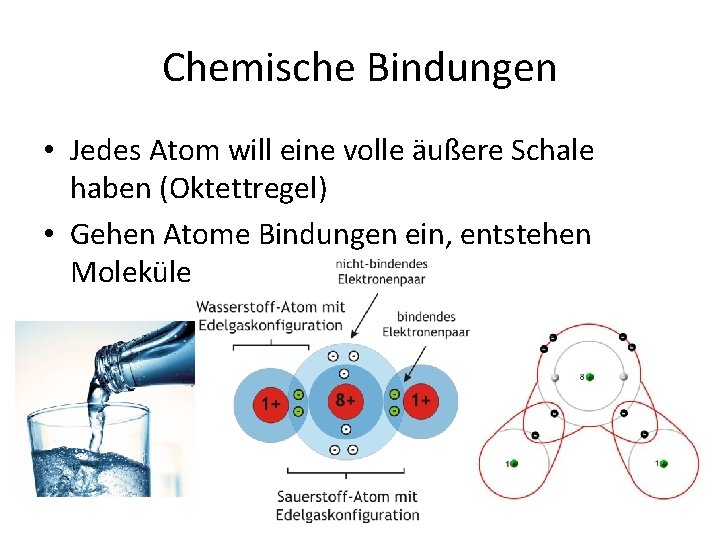
Chemische Bindungen • Jedes Atom will eine volle äußere Schale haben (Oktettregel) • Gehen Atome Bindungen ein, entstehen Moleküle

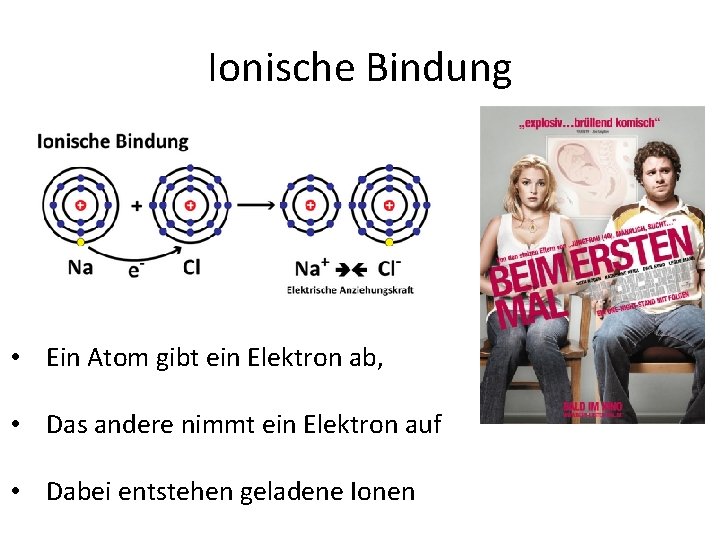
Ionische Bindung • Ein Atom gibt ein Elektron ab, • Das andere nimmt ein Elektron auf • Dabei entstehen geladene Ionen

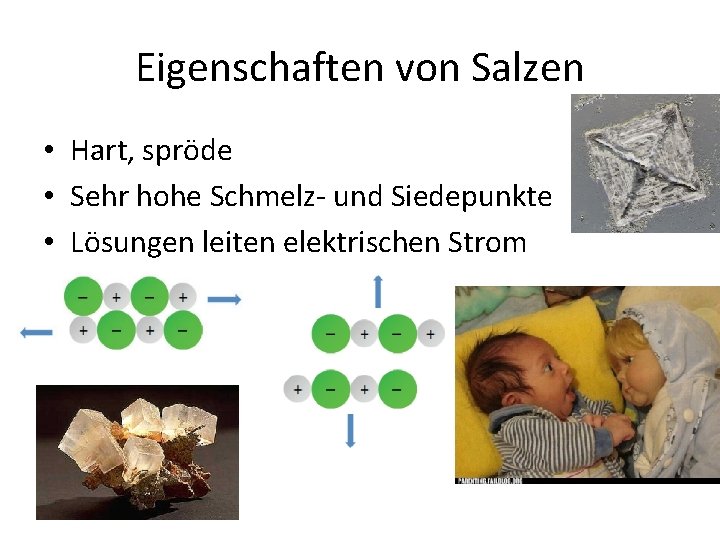
Eigenschaften von Salzen • Hart, spröde • Sehr hohe Schmelz und Siedepunkte • Lösungen leiten elektrischen Strom

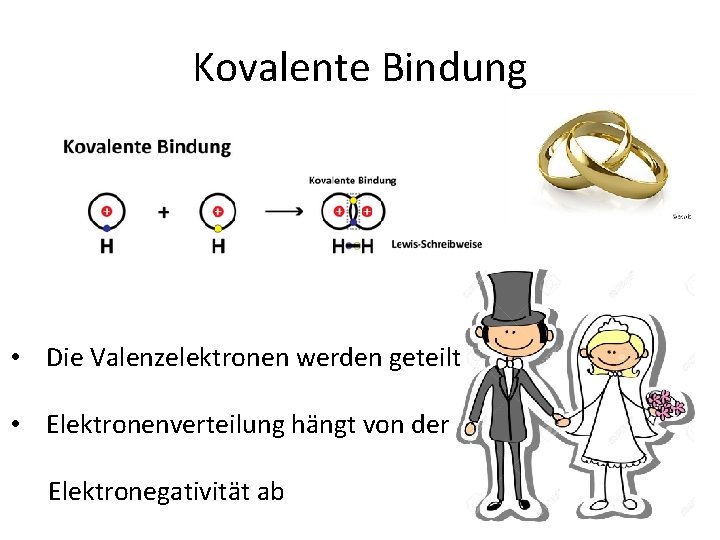
Kovalente Bindung • Die Valenzelektronen werden geteilt • Elektronenverteilung hängt von der Elektronegativität ab

Eigenschaften kovalenter Bindungen • Variieren stark • Starke Bindungen, können aber durch chemische Reaktionen aufgebrochen werden

Metallische Bindung • Positive Atomrümpfe • Delokalisierte Elektronenwolke

Eigenschaften von Metallen • Elektrisch leitfähig • Biegbar • Glänzend

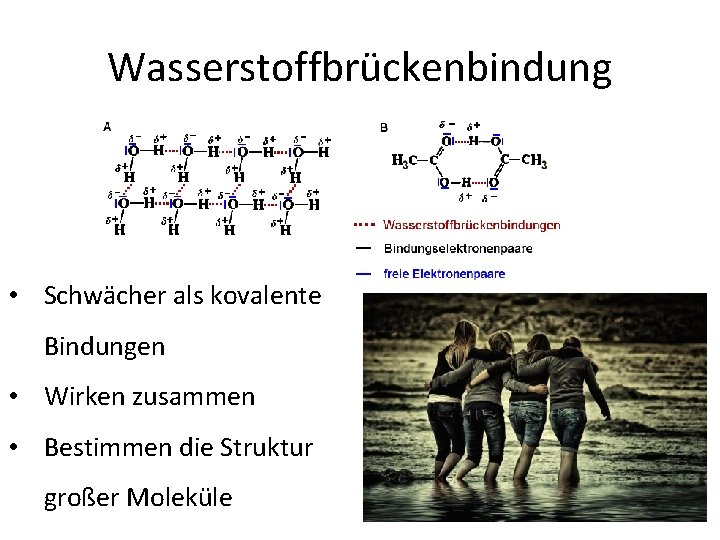
Wasserstoffbrückenbindung • Schwächer als kovalente Bindungen • Wirken zusammen • Bestimmen die Struktur großer Moleküle

Welche 8 Aussagen sind richtig? Zwischen Metallen bildet sich eine kovalente Bindung Bei der kovalenten Bindung wird ein Elektronenpaar geteilt Ein Salz ist als Kristall ein schlechter elektrischer Leiter, als Lösung oder Schmelze jedoch ein guter Bei der Ionenbindung bleiben die chemischen Eigenschaften eines Elements (z. B Reaktionsfreudigkeit) unverändert. Salze bestehen aus Ionen Bei der Ionenbindung entsteht aus Metall und Nichtmetall ein Salz Die elektrische Leitfähigkeit von Metallen steigt mit der Temperatur Ein Ion bildet sich durch Abgabe/Aufnahme eines Elektrons Eine Wasserstoffbrückenbindung ist eine sehr starke chemische Bindung Bei der Metallbindung liegen die Elektronen als freie Wolke (delokalisiert) vor und werden von allen Atomen geteilt Wasserstoffbrückenbindungen stabilisieren die Struktur großer Moleküle Alle Ionen sind Salze Kovalente Bindungen können nur mit extremem Energieaufwand aufgebrochen werden Bei der Ionenbindung wird ein Elektronenpaar geteilt Die meisten Reaktionen in der (Bio-)chemie basieren auf Veränderungen kovalenter

Diese 8 Aussagen sind richtig? Zwischen Metallen bildet sich eine kovalente Bindung Bei der kovalenten Bindung wird ein Elektronenpaar geteilt Ein Salz ist als Kristall ein schlechter elektrischer Leiter, als Lösung oder Schmelze jedoch ein guter Bei der Ionenbindung bleiben die chemischen Eigenschaften eines Elements (z. B Reaktionsfreudigkeit) unverändert. Salze bestehen aus Ionen Bei der Ionenbindung entsteht aus Metall und Nichtmetall ein Salz Die elektrische Leitfähigkeit von Metallen steigt mit der Temperatur Ein Ion bildet sich durch Abgabe/Aufnahme eines Elektrons Eine Wasserstoffbrückenbindung ist eine sehr starke chemische Bindung Bei der Metallbindung liegen die Elektronen als freie Wolke (delokalisiert) vor und werden von allen Atomen geteilt Wasserstoffbrückenbindungen stabilisieren die Struktur großer Moleküle Alle Ionen sind Salze Kovalente Bindungen können nur mit extremem Energieaufwand aufgebrochen werden Bei der Ionenbindung wird ein Elektronenpaar geteilt Die meisten Reaktionen in der (Bio-)chemie basieren auf Veränderungen kovalenter

Säuren und Basen

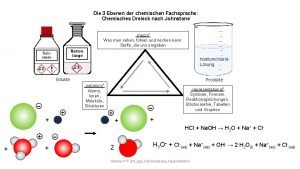
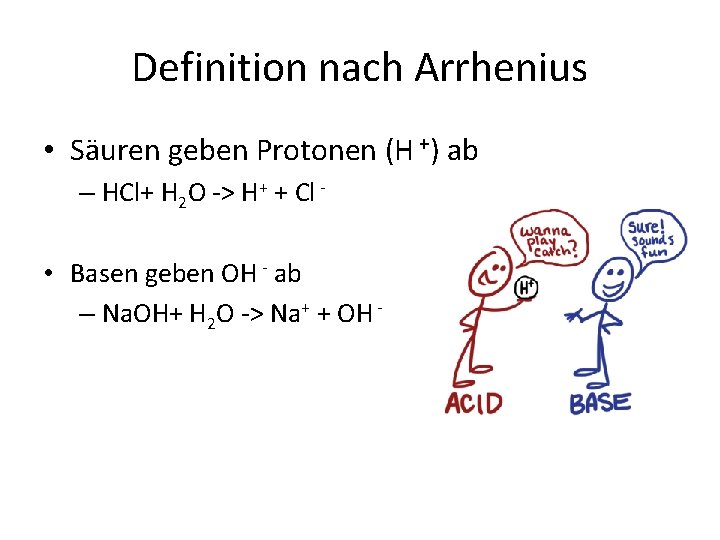
Definition nach Arrhenius • Säuren geben Protonen (H +) ab – HCl+ H 2 O > H+ + Cl • Basen geben OH ab – Na. OH+ H 2 O > Na+ + OH

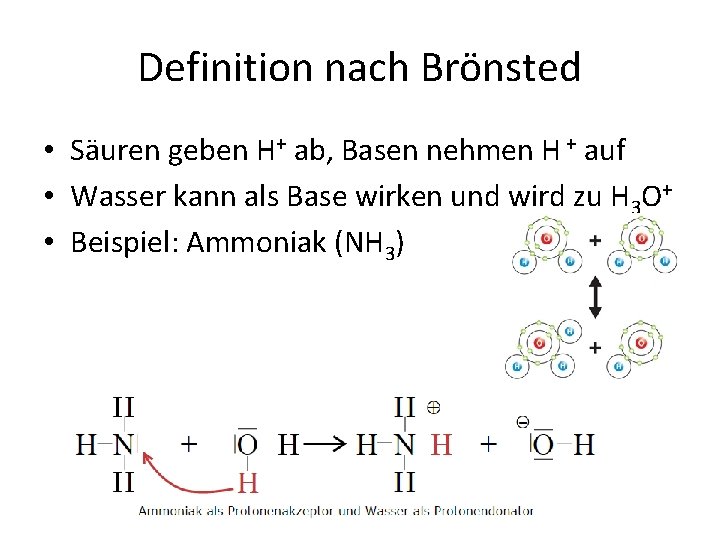
Definition nach Brönsted • Säuren geben H+ ab, Basen nehmen H + auf • Wasser kann als Base wirken und wird zu H 3 O+ • Beispiel: Ammoniak (NH 3)

Neutralisation von Säuren • X H + Y OH > Y+X und H 2 O • Salz und Wasser entstehen

Lückentext Säuren sind als Substanzen definiert, die in Wasser ………………. . abgeben. Der Molekülrest ist danach ……………. geladen. Für Basen gibt es zwei Definitionen sie können ………………. . …. abgeben oder …………. …… aufnehmen. Wenn eine Säure mit einer Base reagiert, entstehen …………. . …. und ……… Eine kovalente Bindung tritt dabei nur bei der Bildung von ……………. . auf.

Lückentext Säuren sind als Substanzen definiert, die in Wasser Protonen (H+) abgeben. Der Molekülrest ist danach negativ geladen. Für Basen gibt es zwei Definitionen sie können Hydroxylionen (OH ) abgeben oder Protonen (H+) aufnehmen. Wenn eine Säure mit einer Base reagiert, entstehen Salz und Wasser Eine kovalente Bindung tritt dabei nur bei der Bildung von Wasser auf.

Starke und schwache Säuren • Unterscheiden sich im Dissoziationsgrad – (= wie stark zerfallen) • Essigsäure in Wasser – 99% Essisäure und 1% H+ und Acetat • Salzsäure in Wasser – 1% Salzsäure und 99% H + und Chlorid


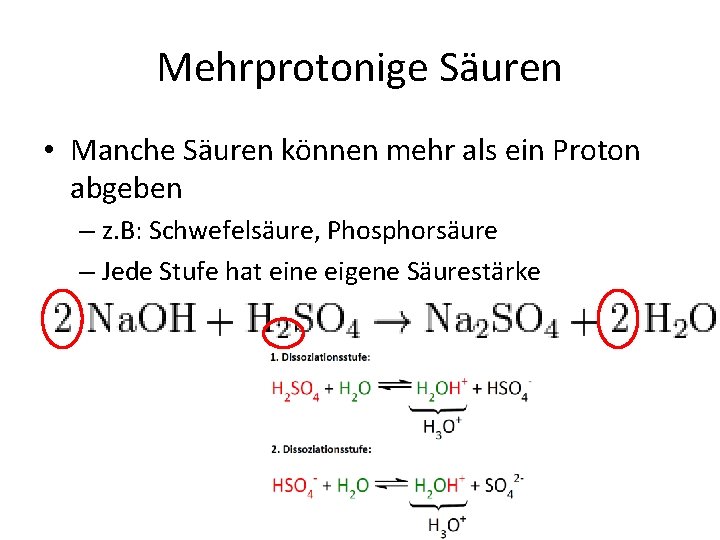
Mehrprotonige Säuren • Manche Säuren können mehr als ein Proton abgeben – z. B: Schwefelsäure, Phosphorsäure – Jede Stufe hat eine eigene Säurestärke

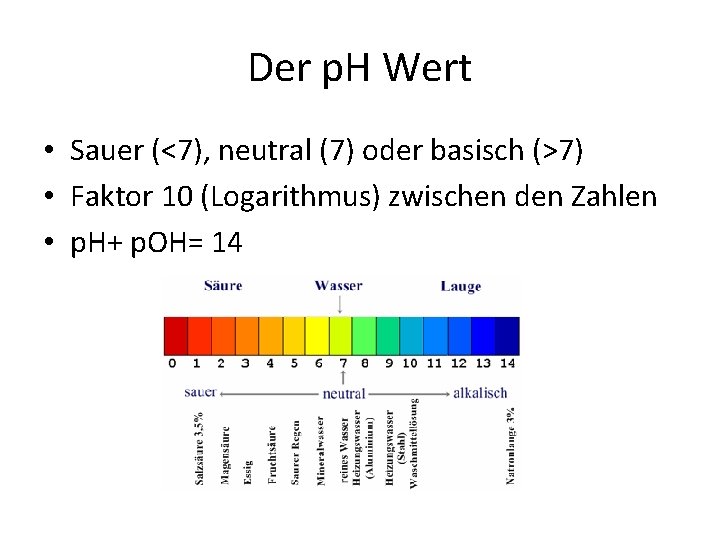
Der p. H Wert • Sauer (<7), neutral (7) oder basisch (>7) • Faktor 10 (Logarithmus) zwischen den Zahlen • p. H+ p. OH= 14
![10 er Potenzen H Konzentration molL 10 er Potenz Schreibweise p H 0 0000001 10 er Potenzen H+ Konzentration [mol/L] 10 er Potenz Schreibweise p. H 0, 0000001](https://slidetodoc.com/presentation_image/444bc71548d0152eebc8be64cb0cb493/image-38.jpg)
10 er Potenzen H+ Konzentration [mol/L] 10 er Potenz Schreibweise p. H 0, 0000001 10^ 7 7 0, 000001 10^ 6 6 0, 00001 10^ 5 5 0, 0001 10^ 4 4 0, 001 10^ 3 3 0, 01 10^ 2 2 0, 1 10^0 0


Welche 6 Antworten sind richtig? Je saurer eine Lösung ist, desto höher ist ihr p. H Ein p. H von 7 ist neutral Jede Säure ist für den menschlichen Körper gefährlich Essigsäure ist eine starke Säure Von einem p. H Wert auf den nächsten verzehnfacht sich die jeweilige H + bzw. OH- Konzentration Schwache Säuren dissoziieren (zerfallen) in Wasser vollständig Nur Stoffe, die eine OH Gruppe enthalten können eine Base sein Säuren können auch mehr als ein Proton abgeben Ein p. H über 7 ist basisch Mit einem Molekül Säure kann man immer ein Molekül Base neutralisieren Man bezeichnet die p. H Wert Skala als logarithmisch Von einem p. H Wert auf den nächsten verdoppelt sich die jeweilige H + bzw. OH- Konzentration Salzsäure ist eine starke Säure

Welche 6 Antworten sind richtig? Je saurer eine Lösung ist, desto höher ist ihr p. H Ein p. H von 7 ist neutral Jede Säure ist für den menschlichen Körper gefährlich Essigsäure ist eine starke Säure Von einem p. H Wert auf den nächsten verzehnfacht sich die jeweilige H + bzw. OH- Konzentration Schwache Säuren dissoziieren (zerfallen) in Wasser vollständig Nur Stoffe, die eine OH Gruppe enthalten können eine Base sein Säuren können auch mehr als ein Proton abgeben Ein p. H über 7 ist basisch Mit einem Molekül Säure kann man immer ein Molekül Base neutralisieren Man bezeichnet die p. H Wert Skala als logarithmisch Von einem p. H Wert auf den nächsten verdoppelt sich die jeweilige H + bzw. OH- Konzentration Salzsäure ist eine starke Säure

Oxidation und Reduktion • Rosten von Eisenteilen • Batterien • Biologische Stoffwechselprozesse

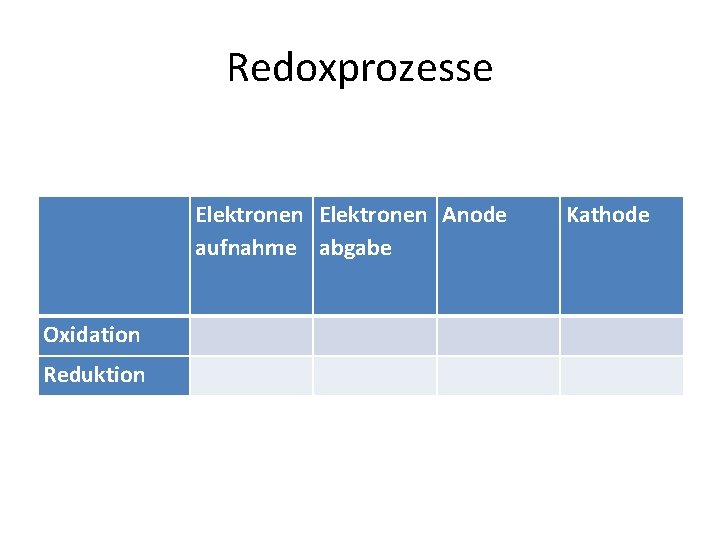
Redoxreaktionen • Oxidation = Elektronenabgabe • Reduktion = Elektronenaufnahme • Eine Redoxreaktion ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. • Hierbei finden also eine Elektronenabgabe durch einen Stoff sowie eine Elektronenaufnahme statt

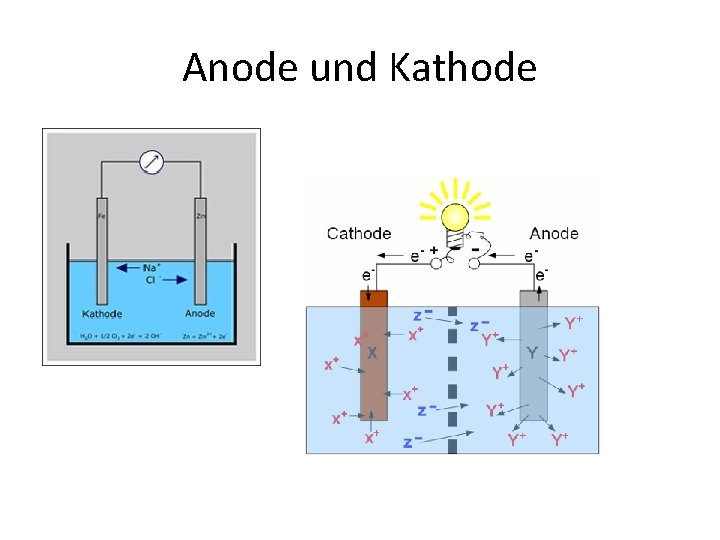
Anode und Kathode

Redoxprozesse Elektronen Anode aufnahme abgabe Kathode Oxidation Reduktion

Redoxprozesse Elektronen Anode aufnahme abgabe Kathode Oxidation x x Reduktion x Merksatz: In Oxford sind die Elektronen fort

Organische Chemie

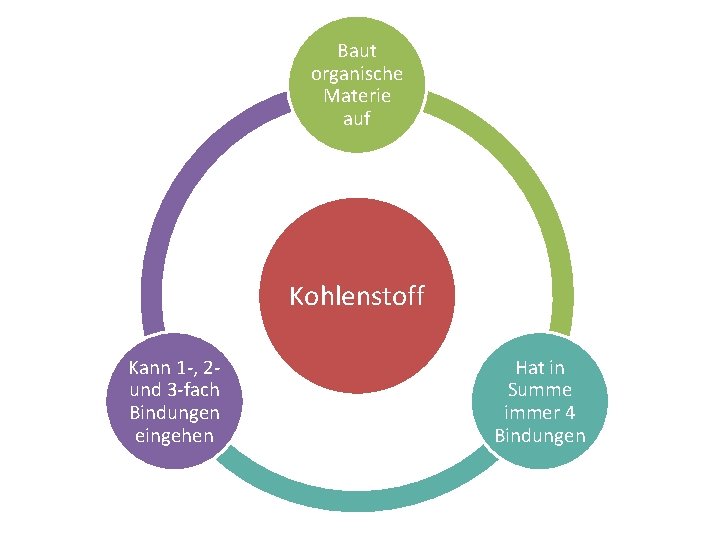
Baut organische Materie auf Kohlenstoff Kann 1 , 2 und 3 fach Bindungen eingehen Hat in Summe immer 4 Bindungen

Kohlenstoff

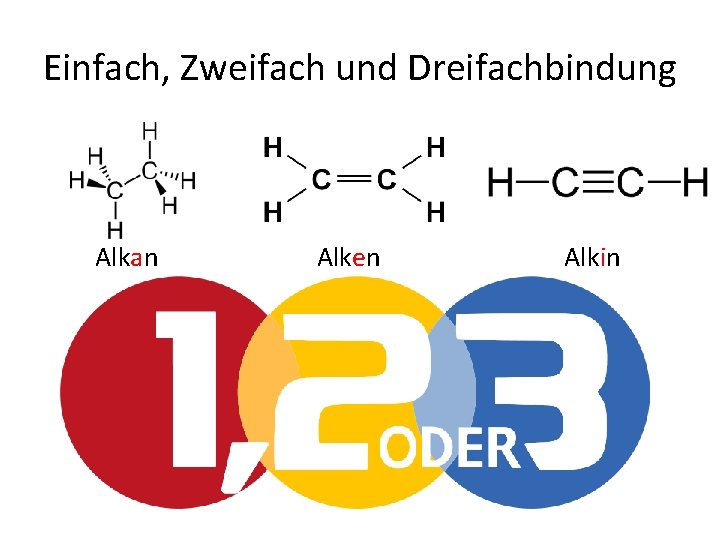
Einfach, Zweifach und Dreifachbindung Alkan Alken Alkin


Was wir heute besprechen

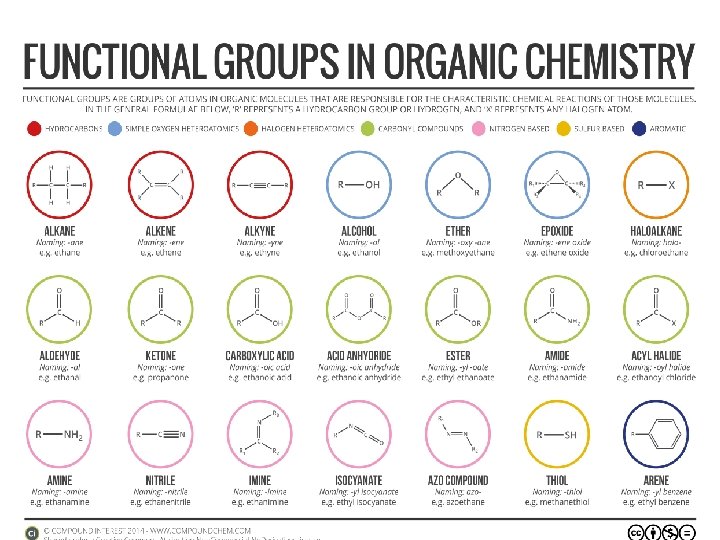
Priorität der funktionellen Gruppen

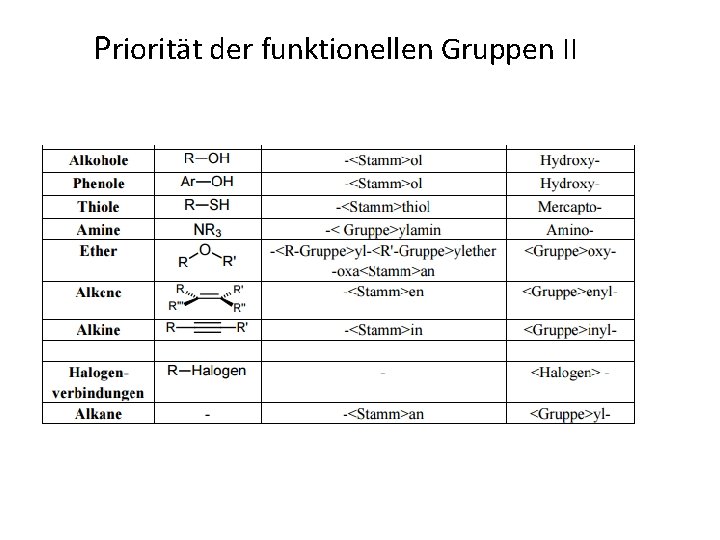
Priorität der funktionellen Gruppen II

IUPAC Regeln • Längste Kohlenwasserstoffkette mit der funktionellen Gruppe der höchsten Priorität bestimmen • Die Anzahl der Kohlenstoffatome (Alkan, Alken, Alkin oder En in) ergibt den Stammnamen • Funktionelle Gruppe wird als Endsilbe angehängt – Z. B Hex 3 en – Oktan

Seitenketten • Funktionelle Gruppe der höchsten Priorität = niedrigste Positionsziffer • Gibt es keine (oder sie ist in der Mitte), wird so nummeriert dass die Summe der Positionsziffern aller anderen Substituenten möglichst klein ist

Trivialnamen • Abkürzungen oder wurden auf der Grundlage von Eigenschaften der Stoffe, deren Vorkommen, als Erinnerung an deren Entdecker gebildet oder sie wurden aus ursprünglichen Warenzeichen übernommen • Viele systematische Namen sind sehr lang und kompliziert – Beispiel: Aminosäuren


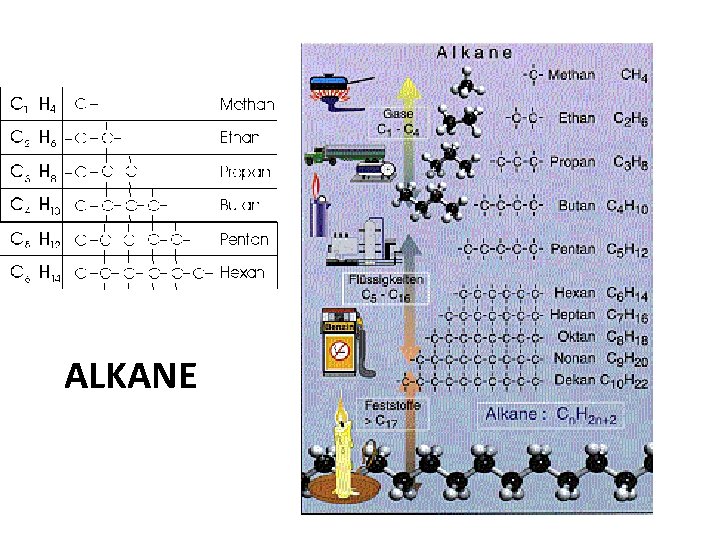
ALKANE

Eigenschaften • Unpolar, nicht wasserlöslich • Anziehungskräfte zwischen den Molekülen eines Alkans sehr schwach • Niedrige Schmelz und Siedepunkte • Geringe Viskosität und Dichte • Sehr reaktionsträge

Nomenklatur • • Seitenkette: yl Alkan: an Alken: en Alkin: in

ALKENE • Enthalten eine C=C Doppelbindung • Ungesättigte Kohlenwasserstoffe

Alkene • Eine oder mehrere Doppelbindungen zwischen zwei Kohlenstoffatomen. – können sich dabei an beliebiger Position befinden – ungesättigte Verbindungen • Kommen in kleinen Mengen im Erdöl vor, in der Natur werden sie als Signalstoffe verwendet • Alkene bilden eine homologe Reihe mit der allgemeinen Summenformel Cn. H 2 n beginnend mit dem Ethen

Eigenschaften • Die Alkene sind von Ethen (C 2 H 4) bis Buten (C 4 H 8) gasförmig und damit leichtflüchtig • Von C 5 bis C 15 sind die Alkene flüssig • > C 15 sind Alkene fest • In Wasser sind Alkene unlöslich, sie verbrennen mit rußender Flamme

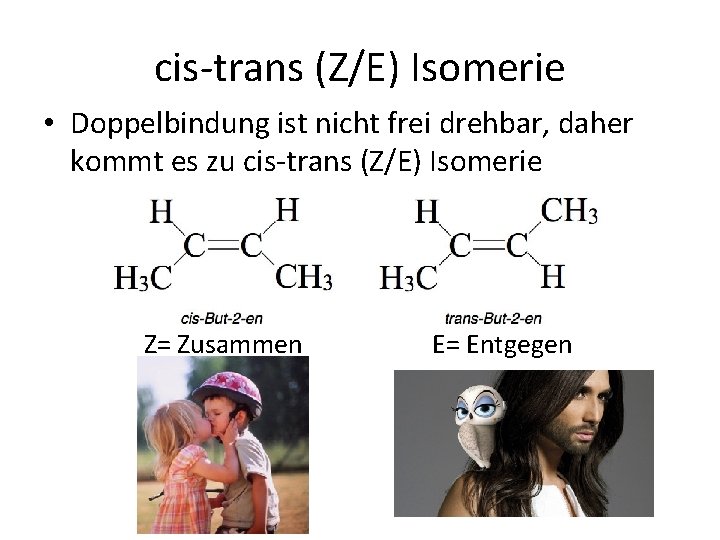
cis trans (Z/E) Isomerie • Doppelbindung ist nicht frei drehbar, daher kommt es zu cis trans (Z/E) Isomerie Z= Zusammen E= Entgegen

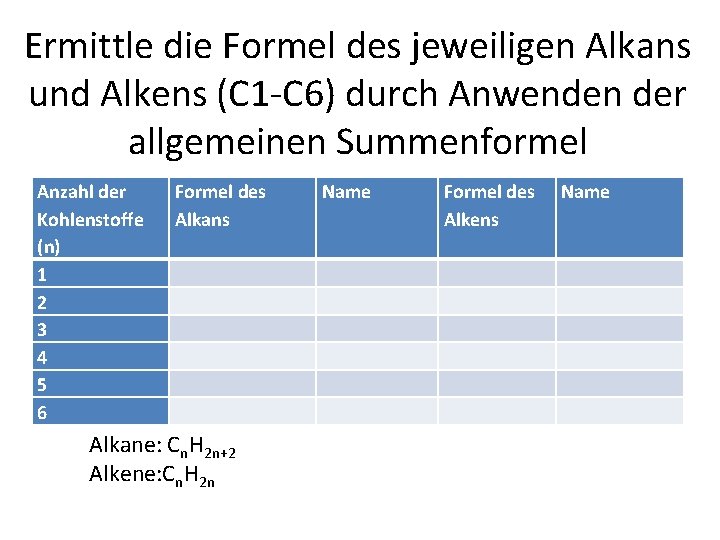
Ermittle die Formel des jeweiligen Alkans und Alkens (C 1 C 6) durch Anwenden der allgemeinen Summenformel Anzahl der Kohlenstoffe (n) 1 2 3 4 5 6 Formel des Alkans Name Formel des Alkens Name Alkane: Cn. H 2 n+2 Alkene: Cn. H 2 n

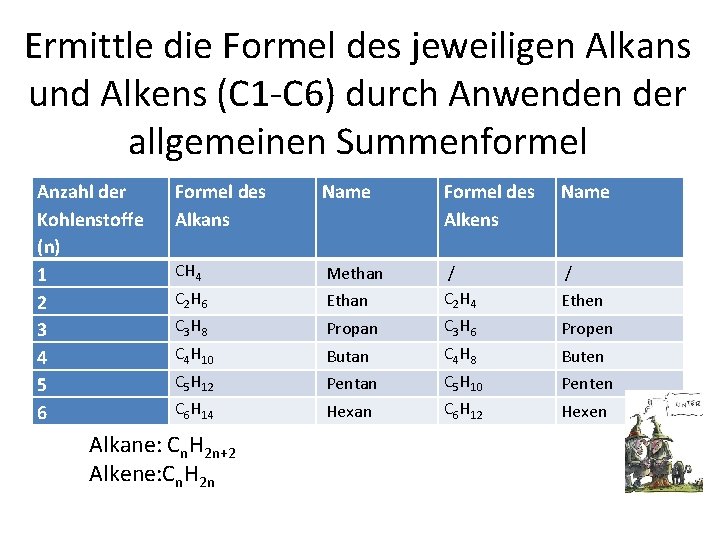
Ermittle die Formel des jeweiligen Alkans und Alkens (C 1 C 6) durch Anwenden der allgemeinen Summenformel Anzahl der Kohlenstoffe (n) 1 2 3 4 5 6 Formel des Alkans Name Formel des Alkens Name CH 4 Methan / C 2 H 6 Ethan / C 2 H 4 C 3 H 8 Propan C 3 H 6 Propen C 4 H 10 Butan C 4 H 8 Buten C 5 H 12 Pentan C 5 H 10 Penten C 6 H 14 Hexan C 6 H 12 Hexen Alkane: Cn. H 2 n+2 Alkene: Cn. H 2 n Ethen

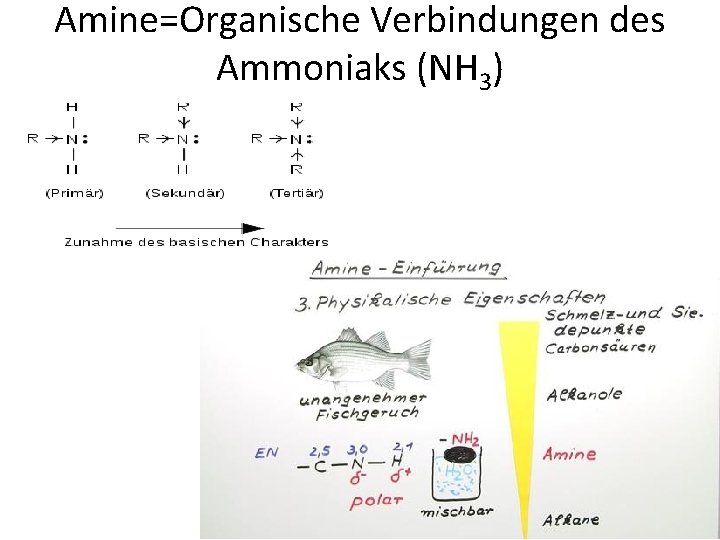
Amine=Organische Verbindungen des Ammoniaks (NH 3)

ALKOHOLE

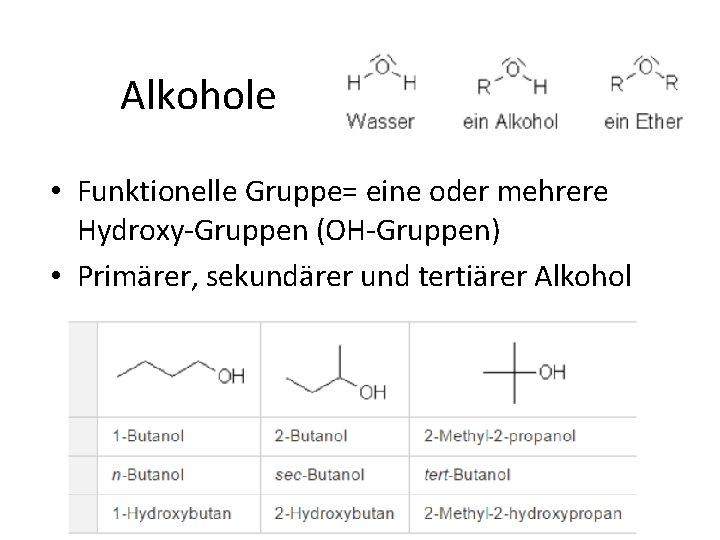
Alkohole • Funktionelle Gruppe= eine oder mehrere Hydroxy Gruppen (OH Gruppen) • Primärer, sekundärer und tertiärer Alkohol

Physikalische Eigenschaften • Werden wesentlich von der OH Gruppe bestimmt • Schwach sauer und bildet mit elementarem Natrium Salze • Die hohe Elektronegativität des Sauerstoffs führt zu einer Polarisierung der C O und der O H Bindung und damit zu einem hohen Dipolmoment • Kurzkettige Alkohole sind (teils unendlich) in Wasser löslich

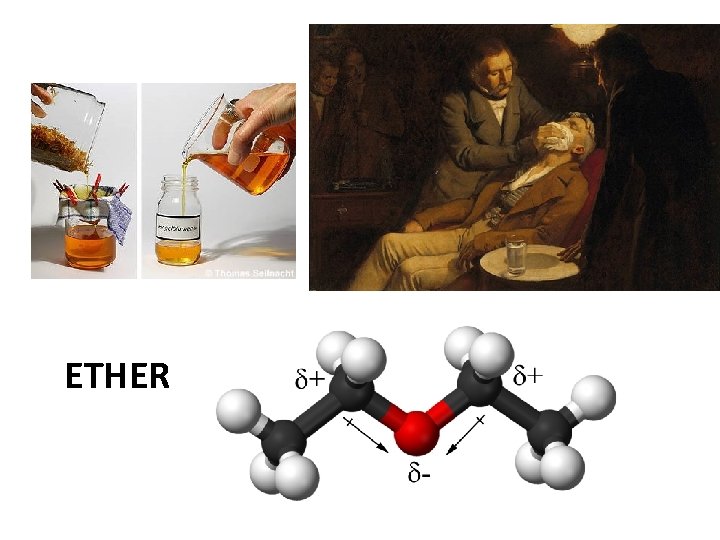
ETHER

Allgemeines • Veraltet Äther • Funktionelle Gruppe: Sauerstoffatom mit zwei organischen Resten (R 1–O–R 2) • In der Umgangssprache bezeichnet Ether oft auch den Diethylether (H 5 C 2 O–C 2 H 5), einen der wichtigsten und einfachsten Ether. • Ether kommen in der Natur vor allem in etherischen Ölen vor

Eigenschaften • Großer Unterschied zu den Eigenschaften der entsprechenden Alkohole mit ähnlichem Molekulargewicht. – besitzen keine O H Protonen – bilden keine stabilen Wasserstoff Brücken aus. • Die Schmelz und Siedepunkte der Ether sind daher erheblich niedriger als die der vergleichbaren Alkohole. • Die hohe Elektronegativität des Sauerstoffs bestimmt jedoch ähnlich wie bei den Alkoholen wesentlich die Eigenschaften der Ether.

CARBONYLVERBINDUNGEN

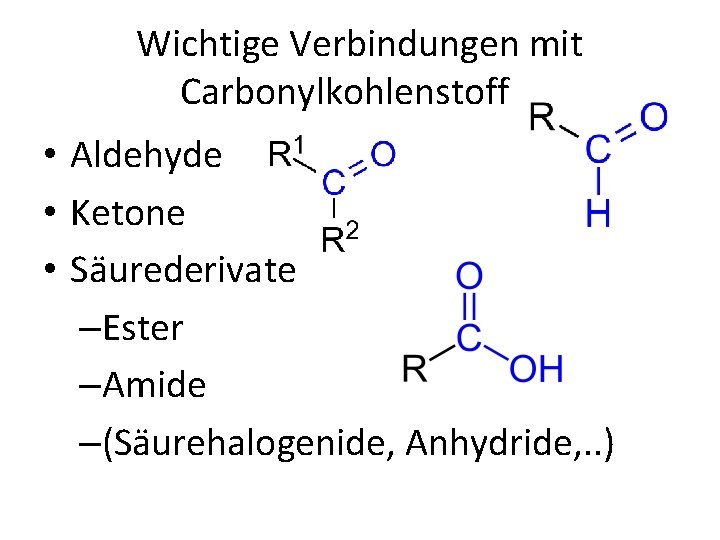
Wichtige Verbindungen mit Carbonylkohlenstoff • Aldehyde • Ketone • Säurederivate –Ester –Amide –(Säurehalogenide, Anhydride, . . )

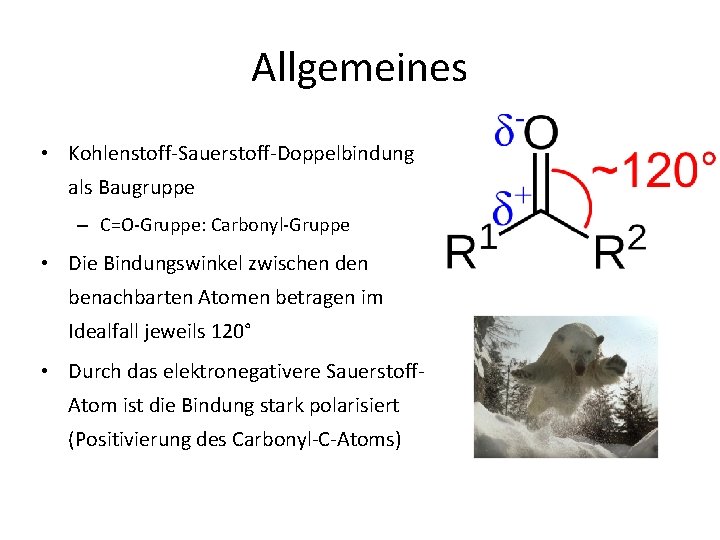
Allgemeines • Kohlenstoff Sauerstoff Doppelbindung als Baugruppe – C=O Gruppe: Carbonyl Gruppe • Die Bindungswinkel zwischen den benachbarten Atomen betragen im Idealfall jeweils 120° • Durch das elektronegativere Sauerstoff Atom ist die Bindung stark polarisiert (Positivierung des Carbonyl C Atoms)

Ordne die Verbindungen den Gruppen zu OH C=O COOH NH 2 C O C Aldehyd/Keton Alkohol Amin Ether Carbonsäure

Ordne die Verbindungen den Gruppen zu OH C=O COOH NH 2 C O C Aldehyd/Keton Alkohol Amin Ether Carbonsäure

AROMATISCHE VERBINDUNGEN

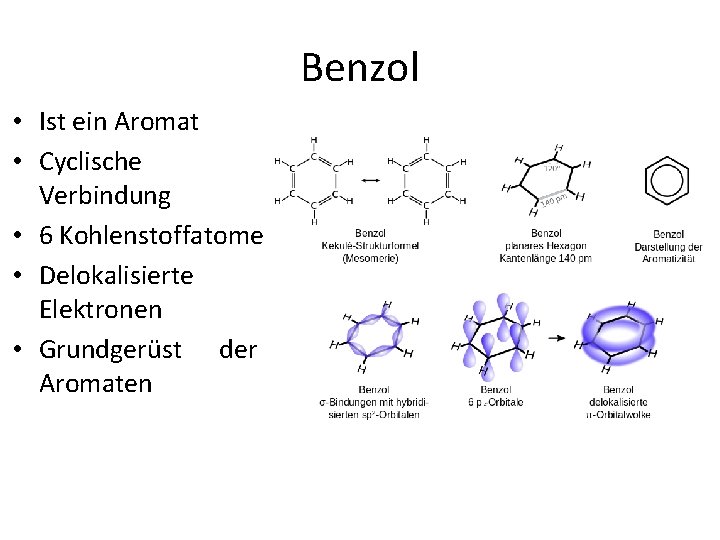
Benzol • Ist ein Aromat • Cyclische Verbindung • 6 Kohlenstoffatome • Delokalisierte Elektronen • Grundgerüst der Aromaten

Welche 12 Antworten sind richtig? Ether sind reaktiver als Alkohole Organische Säuren können Protonen abgeben Alkene bilden durch die starre Doppelbindung cis und tran (Z/E) Isomere Ein primäres Amin hat nur eine organische Kette an den Stickstoff gebunden Die Elektronen werden in Aldehyden vom Sauerstoff stärker zu sich gezogen Es gibt quarternäre Alkohole und Amine Alkohole sind durch ihre Hydroxygruppe besser in Wasser löslich als Alkane Benzol ist eine aromatische Verbindung Die Säurestärke organischer Säuren nimmt mit der Kettenlänge zu Bei Ketonen ist die Carbonylgruppe in der Mitte der Kette Bei verzweigten Alkanen trägt die Seitenkette die Endung -yl Der basische Charakter eines tertiären Amins ist stärker als der eines primären Amins Alkohole können durch Abspaltung der OH Gruppe als Base wirken Carbonsäuren können gesättigt oder ungesättigt vorkommen Amine sind organische Verbindungen des Ammoniaks Ether bilden Wasserstoffbrücken aus Die Elektronen liegen beim Benzolring delokalisiert vor

Welche 12 Antworten sind richtig? Ether sind reaktiver als Alkohole Organische Säuren können Protonen abgeben Alkene bilden durch die starre Doppelbindung cis und tran (Z/E) Isomere Ein primäres Amin hat nur eine organische Kette an den Stickstoff gebunden Die Elektronen werden in Aldehyden vom Sauerstoff stärker zu sich gezogen Es gibt quarternäre Alkohole und Amine Alkohole sind durch ihre Hydroxygruppe besser in Wasser löslich als Alkane Benzol ist eine aromatische Verbindung Die Säurestärke organischer Säuren nimmt mit der Kettenlänge zu Bei Ketonen ist die Carbonylgruppe in der Mitte der Kette Bei verzweigten Alkanen trägt die Seitenkette die Endung -yl Der basische Charakter eines tertiären Amins ist stärker als der eines primären Amins Alkohole können durch Abspaltung der OH Gruppe als Base wirken Carbonsäuren können gesättigt oder ungesättigt vorkommen Amine sind organische Verbindungen des Ammoniaks Ether bilden Wasserstoffbrücken aus Die Elektronen liegen beim Benzolring delokalisiert vor

Biochemie

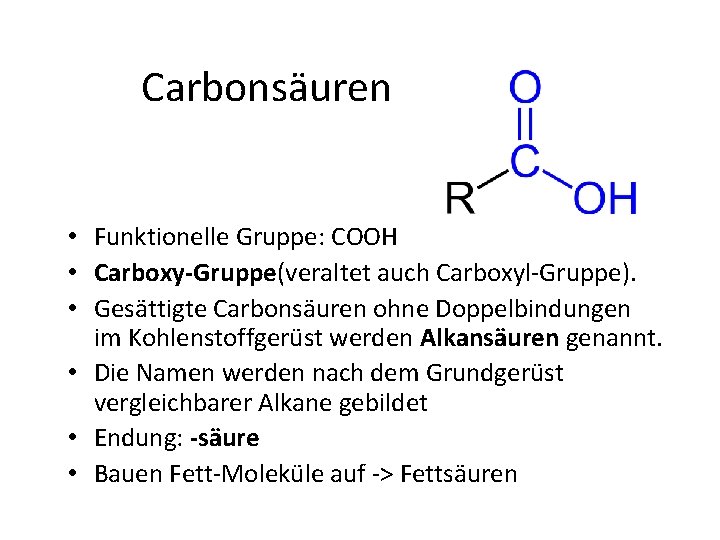
Carbonsäuren • Funktionelle Gruppe: COOH • Carboxy-Gruppe(veraltet auch Carboxyl Gruppe). • Gesättigte Carbonsäuren ohne Doppelbindungen im Kohlenstoffgerüst werden Alkansäuren genannt. • Die Namen werden nach dem Grundgerüst vergleichbarer Alkane gebildet • Endung: -säure • Bauen Fett Moleküle auf > Fettsäuren

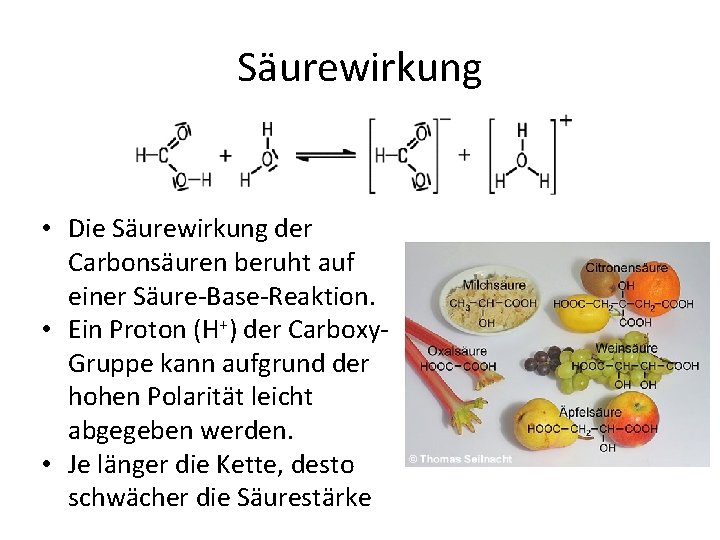
Säurewirkung • Die Säurewirkung der Carbonsäuren beruht auf einer Säure Base Reaktion. • Ein Proton (H+) der Carboxy Gruppe kann aufgrund der hohen Polarität leicht abgegeben werden. • Je länger die Kette, desto schwächer die Säurestärke

Fettsäuren • Langkettige Carbonsäuren • Sehr schwach sauer • Besitzen die Carbonsäuren in ihrer Kohlenstoff Kette mindestens eine Doppelbindung, handelt es sich um ungesättigte Fettsäuren. • Beispielsweise bei der Ölsäure oder Linolsäure.

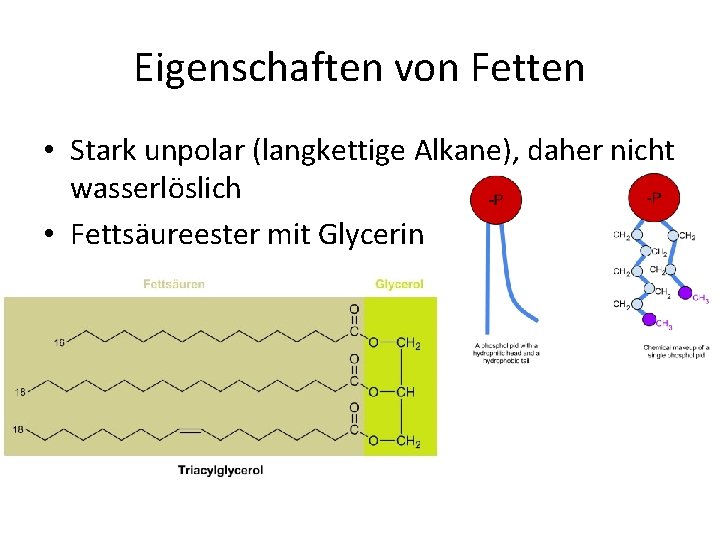
Eigenschaften von Fetten • Stark unpolar (langkettige Alkane), daher nicht wasserlöslich • Fettsäureester mit Glycerin


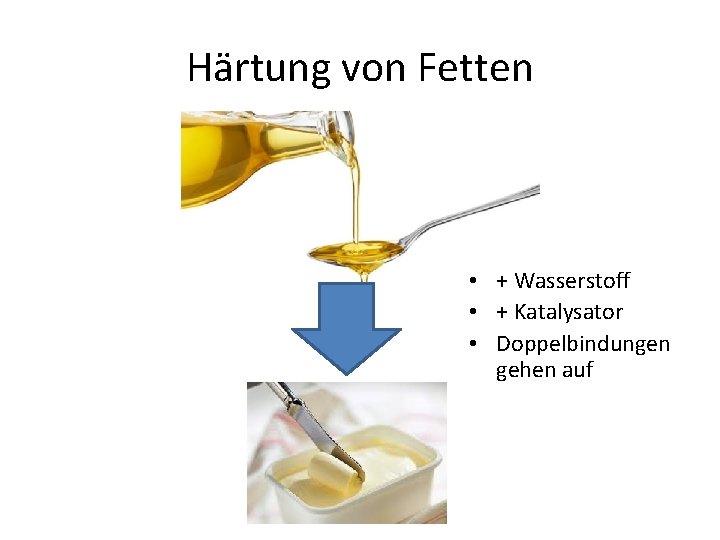
Schmelzpunkt von Fetten • Ungesättigte Fettsäuren haben einen niedrigeren Schmelzpunkt, da die Doppelbindungen zu einem Knick in der Molekülkette führen und die Moleküle nicht mehr so dicht gepackt werden können. • Dadurch sind die Van der Waals Kräfte zwischen den Ketten schwächer. • Bei der Fetthärtung werden ungesättigte Fettsäuren in gesättigte umgewandelt, die Schmelzpunkte steigen dadurch.

Härtung von Fetten • + Wasserstoff • + Katalysator • Doppelbindungen gehen auf

Polymere • Aufbau aus großen Kettenmolekülen aus kleineren Einheiten • Materialeigenschaften stark verschieden

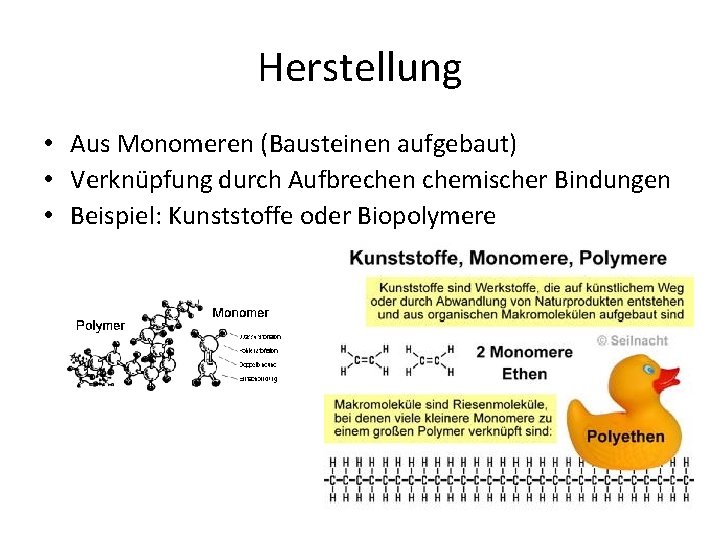
Herstellung • Aus Monomeren (Bausteinen aufgebaut) • Verknüpfung durch Aufbrechen chemischer Bindungen • Beispiel: Kunststoffe oder Biopolymere

Fragen zu Fetten • Woraus sind Fette aufgebaut? Was passiert beim Härten von Fetten (Herstellung von Magarine)? • Welche Bindungen reagieren dabei mit Wasserstoff • Welchen Einfluss hat das auf die Wechselwirkugen zwischen den Ketten und dadurch auf den Schmelzpunkt?

Was sind Proteine?

Biologische Funktionen • • Transportproteine Hormone Antikörper (Immunglobuline) Strukturproteine Membranproteine Speicherproteine Enzyme Toxine

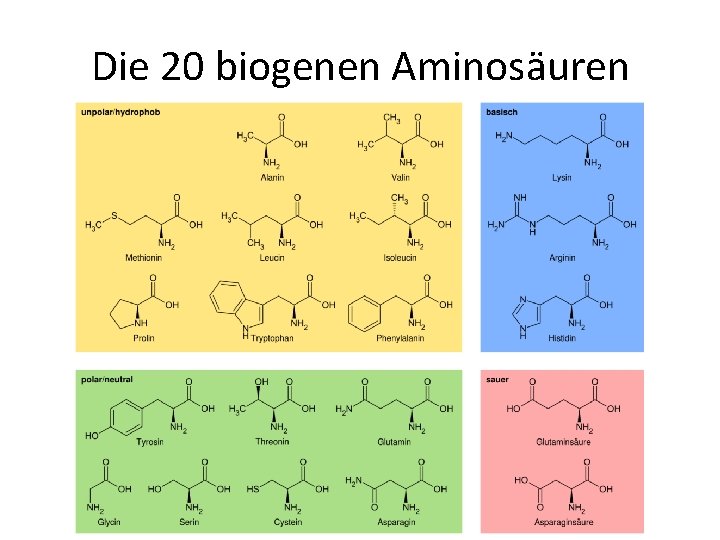
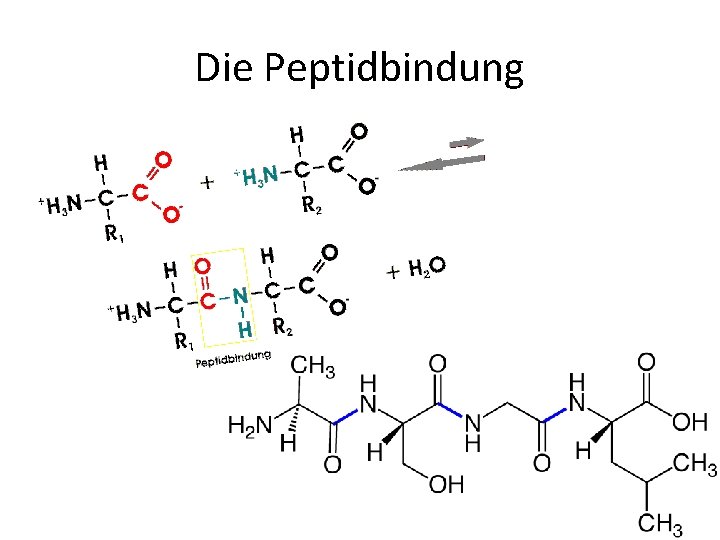
Aufbau • Aus Aminosäuren – 20 biogene Aminosäuren • Sind über eine Peptidbindung miteinander verknüpft – Amidbindung • Bilden eine dreidimensionale Struktur aus – Wichtig für die biologischen Funktionen

Die 20 biogenen Aminosäuren

Die Peptidbindung

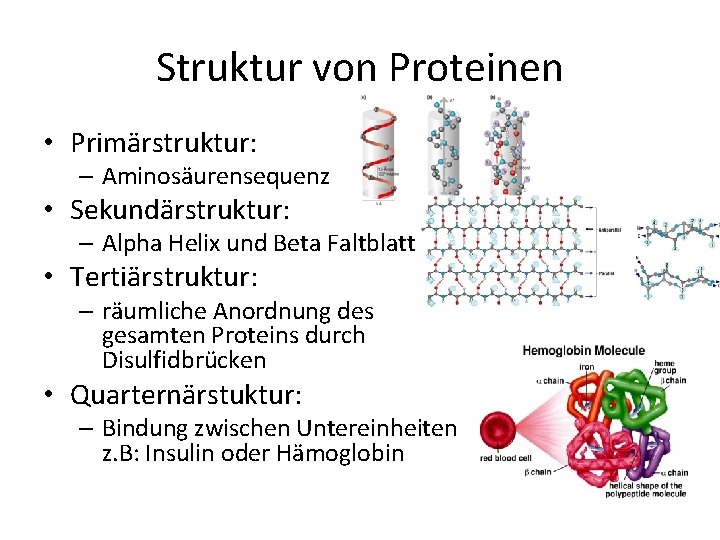
Struktur von Proteinen • Primärstruktur: – Aminosäurensequenz • Sekundärstruktur: – Alpha Helix und Beta Faltblatt • Tertiärstruktur: – räumliche Anordnung des gesamten Proteins durch Disulfidbrücken • Quarternärstuktur: – Bindung zwischen Untereinheiten z. B: Insulin oder Hämoglobin

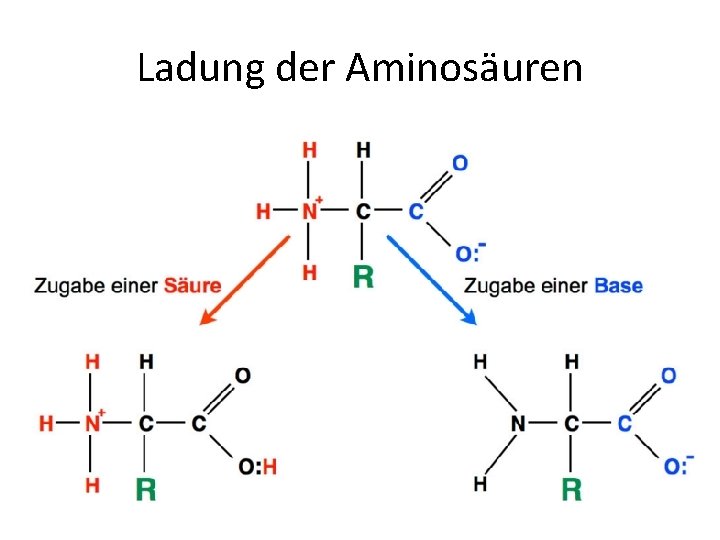
Ladung der Aminosäuren

Ladungszustand von Aminosäuren

Elektrophorese • Je nachdem, welcher p. H Wert herrscht, liegen die Anteile der verschieden geladenen Molekülformen einer Aminosäure in einer wässrigen Lösung vor. • Verschiedene Proteine können aufgrund ihrer Gesamtladung und Größe im elektrischen Feld aufgetrennt werden

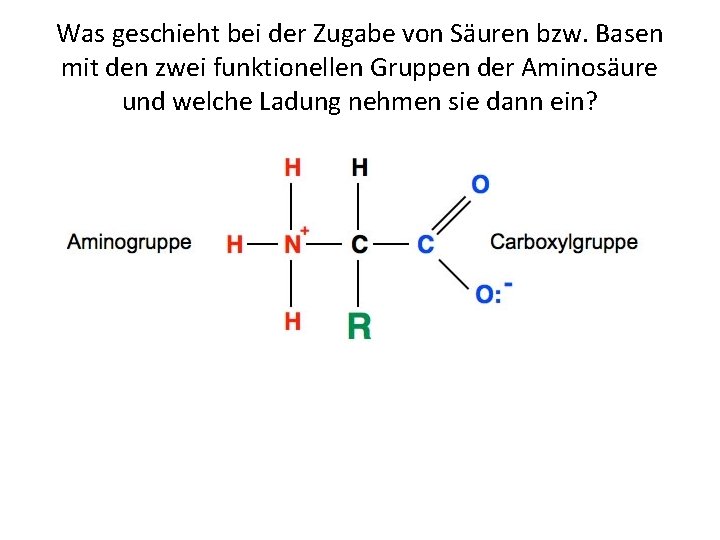
Was geschieht bei der Zugabe von Säuren bzw. Basen mit den zwei funktionellen Gruppen der Aminosäure und welche Ladung nehmen sie dann ein?

Welche 11 Antworten sind richtig? Proteine werden aus den selben Basen aufgebaut wie DNA Bei Zugabe einer Säure wird eine Aminosäurepositiv geladen Proteine werden aus 20 biogenen Aminosäuren aufgebaut Die korrekte 3 -dimensionale Faltung ist für die Funktion eines Proteins wichtig Bei Zugabe einer Base wird eine Aminosäure negativ geladen Die Aminosäuren sind durch eine Peptidbindung miteinander verknüpft Die nicht-kovalente Wechselwirkung von Untereinheiten nennt man Quarternärstruktur Bei Zugabe einer Säure wird eine Aminosäure negativ geladen Eine wichtige Funktion von Proteinen ist der Energiespeicher in der Leber (Glykogen) Die ß-Helix ist eine wichtige Sekundärstruktur in Proteinen Aminosäuren haben zwei (oder mehr) funktionelle Gruppen Bei Zugabe einer Base wird eine Aminosäure positiv geladen Auch in der Proteinsequenz weit entfernte Aminosäuren können miteinander Bindungen eingehen Man nennt Aminosäuren auch zwitterionisch Protein= Eiweiß Die Sekundärstruktur entspricht der Aminosäurensequenz Die α-Helix ist eine wichtige Sekundärstruktur in Proteinen

KOHLENHYDRATE

Funktionen der Kohlenhydrate • Kohlenhydrate (Saccharide) machen gemeinsam mit Fetten (Lipiden) und Eiweißen (Proteinen) den quantitativ größten verwertbaren Anteil der Nahrung aus • Zentrale Rolle als Energieträger im Organismus • Produkt der Photosynthese

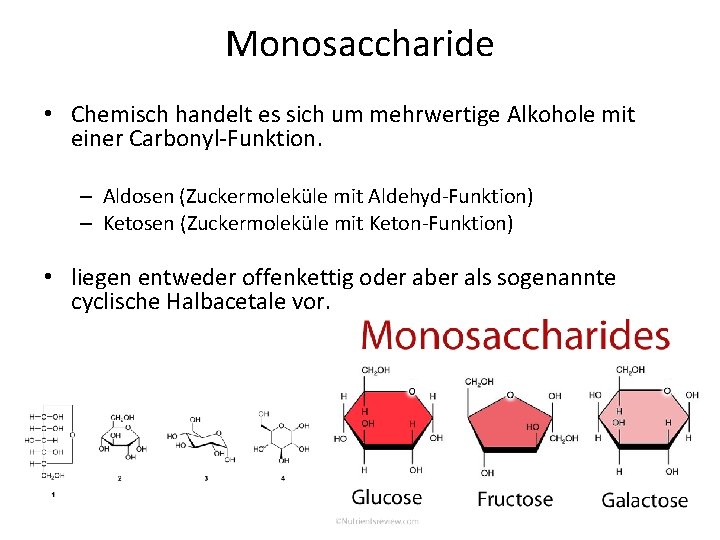
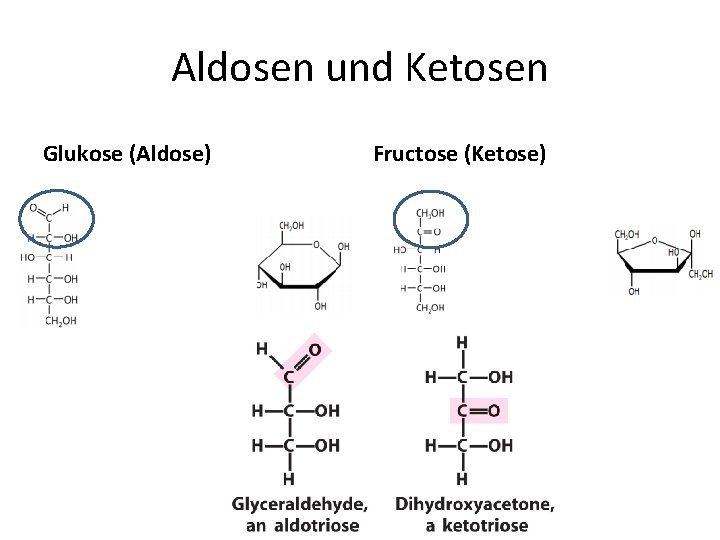
Monosaccharide • Chemisch handelt es sich um mehrwertige Alkohole mit einer Carbonyl Funktion. – Aldosen (Zuckermoleküle mit Aldehyd Funktion) – Ketosen (Zuckermoleküle mit Keton Funktion) • liegen entweder offenkettig oder aber als sogenannte cyclische Halbacetale vor.

Aldosen und Ketosen Glukose (Aldose) Fructose (Ketose)

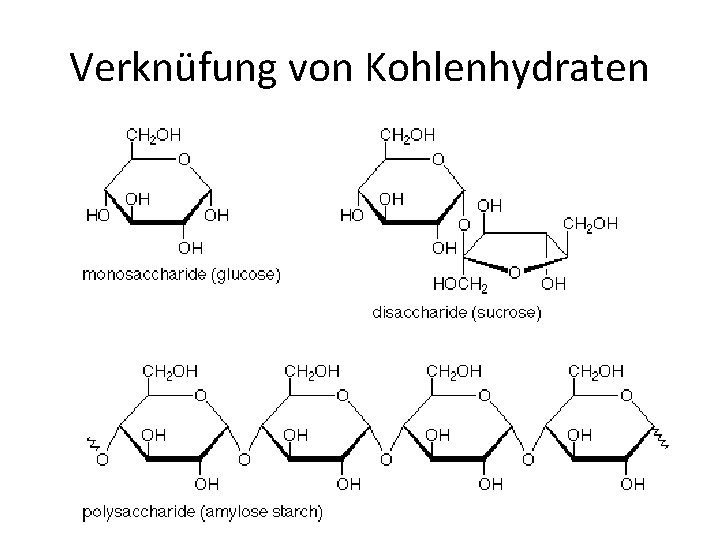
Verknüfung von Kohlenhydraten

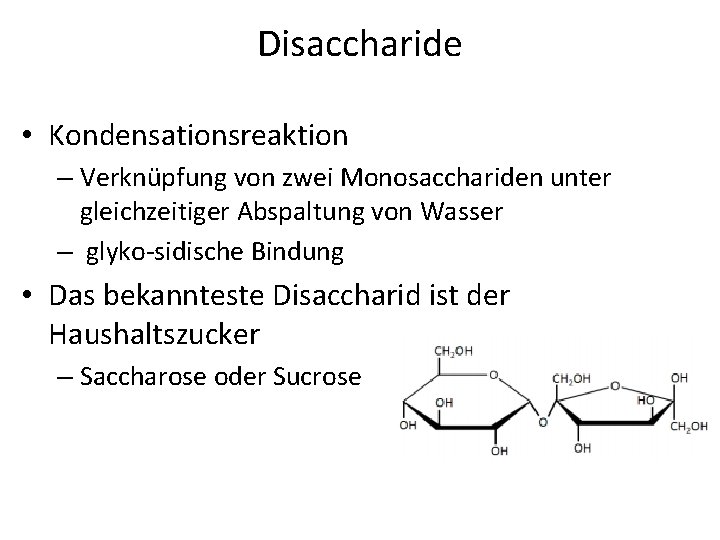
Disaccharide • Kondensationsreaktion – Verknüpfung von zwei Monosacchariden unter gleichzeitiger Abspaltung von Wasser – glyko sidische Bindung • Das bekannteste Disaccharid ist der Haushaltszucker – Saccharose oder Sucrose

Polysaccharide • In gleicher Art und Weise können mehrere Monosaccharide über eine glykosidische Bindung miteinander verknüpft werden. • Werden mehr als 10 Monosaccharide zu einem Polymer verknüpft, spricht man von einem Polysaccharid (auch Mehrfachzucker oder Vielfachzucker) – Glycogen, Stärke, Pektine, Chitin und Cellulose – Schleimstoffe, Reservestoffe und Nährstoffe. • Stärkemoleküle bauen sich aus D Glucose Einheiten auf, welche über glykosidische Bindungen miteinander verknüpft sind.

In der Zahnmedizin • Für Karies sind in der Mundhöhle vorkommende Bakterien verantwortlich, welche sich auf den Zahnhartgeweben Zahnschmelz und Dentin als Beläge (Plaques) festsetzen • Dextrane sind (klebrige) Polysaccharide – Bauen sich aus Glukosebausteinen auf – Erhöhen das Haftvermögen der Plaque Bakterien (Streptokokken) am Zahn – Wandeln Zucker zu Säuren um, welche für die Entkalkung der harten Zahnsubstanz verantwortlich sind. • Vermeidung der Belagsbildung und Mineralisierung der Zähne!!
 Den gode den onde og den grusomme
Den gode den onde og den grusomme Den gode, den onde og den grusomme
Den gode, den onde og den grusomme Musik
Musik Nacht der wissenschaft freiberg
Nacht der wissenschaft freiberg Wordpress
Wordpress Wissenschaft 3000
Wissenschaft 3000 Forum offene wissenschaft
Forum offene wissenschaft Ny karakterskala
Ny karakterskala Man kann menschen nur vor den kopf gucken
Man kann menschen nur vor den kopf gucken Otvor mi oči duch svätý
Otvor mi oči duch svätý Es ist vollbracht er hat den sieg
Es ist vollbracht er hat den sieg Geschwindigkeit aus beschleunigung
Geschwindigkeit aus beschleunigung Die vier kerzen autor
Die vier kerzen autor Trägheitsmoment massepunkt
Trägheitsmoment massepunkt Es war eine mutter
Es war eine mutter Winter kommt winter kommt flocken fallen nieder lied
Winter kommt winter kommt flocken fallen nieder lied Ich habe heute klassendienst
Ich habe heute klassendienst Es ist herbst es ist herbst bunter blätter fliegen
Es ist herbst es ist herbst bunter blätter fliegen Zu glauben ist schwer. nichts zu glauben ist unmöglich
Zu glauben ist schwer. nichts zu glauben ist unmöglich Die einigung italiens
Die einigung italiens Gegenteil quadrieren
Gegenteil quadrieren Vorstellungen berlin
Vorstellungen berlin Teilgebiete der physik
Teilgebiete der physik Linz ist die hauptstadt von
Linz ist die hauptstadt von Von welchen zahlen ist 24 ein vielfaches
Von welchen zahlen ist 24 ein vielfaches Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Kurshalter
Kurshalter Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Donau chemie pischelsdorf
Donau chemie pischelsdorf Tenside definition
Tenside definition Soli chemie 9. ročník
Soli chemie 9. ročník Impuls chemie 4
Impuls chemie 4 Chemie porn
Chemie porn Magnesiumhydrogencarbonat formel
Magnesiumhydrogencarbonat formel Van der waals gleichung
Van der waals gleichung Gefahrensymbole physik
Gefahrensymbole physik Metallgitter chemie
Metallgitter chemie Methan oxidationszahl
Methan oxidationszahl Substrat chemie
Substrat chemie Nico rutten
Nico rutten Planaire structuur chemie
Planaire structuur chemie Hochofen stahlherstellung
Hochofen stahlherstellung Schilling chemie
Schilling chemie Impuls chemie
Impuls chemie Danke für eure aufmerksamkeit chemie
Danke für eure aufmerksamkeit chemie Methan ethan
Methan ethan Klinische chemie
Klinische chemie Chemie
Chemie Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Entwicklungsfarbstoffe
Entwicklungsfarbstoffe Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Krasové jevy chemie
Krasové jevy chemie Chemie
Chemie Chemie
Chemie Naturfasern chemie
Naturfasern chemie Areny chemie
Areny chemie Oxidační koncovky
Oxidační koncovky Impuls chemie 4
Impuls chemie 4 Dreieck chemie
Dreieck chemie Chemie
Chemie Sucha chemie
Sucha chemie Fehlvorstellungen chemie
Fehlvorstellungen chemie Voda prezentace chemie
Voda prezentace chemie Groene chemie scheikunde
Groene chemie scheikunde Impuls chemie 4
Impuls chemie 4 Ppp chemie
Ppp chemie Placemat methode
Placemat methode Salicylsäuremethylester verseifung
Salicylsäuremethylester verseifung Substrat chemie
Substrat chemie Autohaus bonnemann
Autohaus bonnemann Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Sbr6 chemie
Sbr6 chemie Deriváty uhlovodíků
Deriváty uhlovodíků Hhu ilias
Hhu ilias Chemie
Chemie Spiegelbeeldisomerie cyclisch
Spiegelbeeldisomerie cyclisch Burgerlijk ingenieur chemie
Burgerlijk ingenieur chemie Chemie
Chemie Skelettschreibweise chemie
Skelettschreibweise chemie Druckerhöhung chemisches gleichgewicht
Druckerhöhung chemisches gleichgewicht Chemické názvosloví
Chemické názvosloví Organická chemie
Organická chemie Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Chemie verhältnisformel
Chemie verhältnisformel Vis vitalis chemie
Vis vitalis chemie Chemie teilgebiete
Chemie teilgebiete Impuls chemie
Impuls chemie Reaktion 1. ordnung
Reaktion 1. ordnung Chmia
Chmia Chemie
Chemie Názvoslovie solí
Názvoslovie solí Impuls chemie
Impuls chemie 12 principes groene chemie
12 principes groene chemie Le chatelier chemie
Le chatelier chemie Chemie
Chemie Pulsar chemie
Pulsar chemie Chemie
Chemie Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Podobory chemie
Podobory chemie Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Bahenný plyn
Bahenný plyn Concept cartoon chemie
Concept cartoon chemie Ddt chemie
Ddt chemie Chemie
Chemie Chemie
Chemie Chemie
Chemie Jacinta den besten
Jacinta den besten Den sociala ansvarsmodellen
Den sociala ansvarsmodellen Den fjerde statsmagt
Den fjerde statsmagt Gutenberg erfand den mit beweglichen lettern
Gutenberg erfand den mit beweglichen lettern Den moderna världens ursprung
Den moderna världens ursprung Maarten den ottolander
Maarten den ottolander Hvad er lst
Hvad er lst Mutlak değeri 0 dan küçük olan tam sayılar
Mutlak değeri 0 dan küçük olan tam sayılar