Chemick termodynamika Zmny energie pi chemickch reakcch Reakn
















- Slides: 19

Chemická termodynamika Změny energie při chemických reakcích Reakční teplo Termochemické zákony 1

Základní pojmy chemické termodynamiky Ø Chemická termodynamika – studuje změny energií při chemických reakcích; zabývá se též jejich termodynamickou uskutečnitelností a rovnováhami, které se v soustavách ustavují. Náročná problematika ustavování chemických rovnováh se probírá v chemii 1. ročníku jako samostatná kapitola. Ø Termodynamická soustava – je část prostoru (např. s chemickými látkami), který je vymezen skutečným nebo myšleným ohraničením. Ø Termodynamické soustavy podle ohraničení: § Izolované § Uzavřené § Otevřené Ø Stav termodynamické soustavy je určen tzv. základními stavovými veličinami, které lze rozlišit na: § Veličiny přímo měřitelné (lze u nich měřit jejich absolutní hodnotu). Např. teplota (T), tlak (p), objem (V), látkové množství (n). § Veličiny („stavové funkce“), u kterých nelze měřit absolutní hodnotu, ale lze zjišťovat pouze jejich změnu. Např. vnitřní energie (U), entalpie (H), Gibbsova energie (G), entropie (S). V chemii 1. ročníku se probírat nebudou. S některými se setkáte v učivu fyziky, event. v učivu chemie 4. ročníku. 2

Změny energie při chemických reakcích (1) Ø Při chemických reakcích dochází ke štěpení vazeb ve výchozích látkách a ke vzniku nových vazeb v produktech. Ø Na rozštěpení chemických vazeb se energie spotřebovává (tzv. energie disociační ED ) a při vzniku chemických vazeb se energie uvolňuje (tzv. energie vazebná EV). Ø Energetická bilance (EB) dané chemické reakce se vyčíslí porovnáním energie dodané k rozštěpení vazeb u výchozích látek s energií, která se uvolní při vzniku nových vazeb. Ø A/ Výpočet energetické bilance použitím znaménkové konvence. Provádí se součet disociačních energií všech zaniklých vazeb a součet vazebných energií všech vzniklých vazeb. Energie disociační (dodaná) se uvádí v k. J/mol s kladným znaménkem. Energie vazebná (uvolněná) se uvádí v k. J/mol se záporným znaménkem. Energetická bilance = Σ(ED) + Σ(EV); (Σ = součet). Ø B/ Výpočet energetické bilance bez znaménkové konvence. Od součtu energií všech zaniklých chemických vazeb se odečítá součet energií všech vzniklých chemických vazeb. Jednotkou energie vazby je k. J/mol (jako kladná hodnota). 3

Změny energie při chemických reakcích (2) Ø Je-li součet energií všech zaniklých chemických vazeb větší, než je součet energií všech vazeb vzniklých [Σ(ED) > Σ(EV)], pak je energetická bilance dané chemické reakce kladná. Při této reakci energie soustavy roste. Reakce je endergonická. Ø Je-li součet energií všech vznikých chemických vazeb větší, než je součet energií všech vazeb zaniklých [Σ(EV ) > Σ(ED)], pak je energetická bilance dané chemické reakce záporná. Při této reakci energie soustavy klesá. Reakce je exergonická. Ø Reakce, při kterých reagující soustava uvolňuje energii do svého okolí, se nazývají reakce exergonické. Reakce, při kterých reagující soustava spotřebovává energii ze svého okolí, se nazývají reakce endergonické. V přírodě samovolně probíhají nejčastěji reakce exergonické. Ø Výpočet energetické bilance reakce: H 2 + Cl 2 → 2 HCl ; — vazba zanikající; — vazba vznikající; H—H + Cl—Cl → H—Cl + H—Cl ; Energie vazeb: ED(H–H) = 436 k. J/mol; ED(Cl–Cl) = 243 k. J/mol; EV(H–Cl) = - 432 k. J/mol; EB = Σ(ED) + Σ(EV) = 436 k. J/mol + 243 k. J/mol + 2. (- 432 k. J/mol); EB = 185 k. J/mol; Energetická bilance dané reakce je - 185 k. J/mol; její hodnota napovídá, že jde o reakci exergonickou. 4

Základy termochemie a reakční teplo (1) Ø Termochemie je oddíl termodynamiky, který se zabývá tepelnými jevy při chemických reakcích. Ø Teplo uvolněné nebo pohlcené při chemické reakci závisí na množství reagujících látek, na jejich skupenství, modifikaci i na různých podmínkách (teplota, tlak apod. ). Ø Závislost množství vyměňovaného tepla na látkovém množství reagujících látek – příklad: a) rozklad 1 molu peroxidu vodíku: H 2 O 2 → H 2 O + ½ O 2 ; Uvolní se teplo (Qma) 97, 9 k. J/mol; b) rozklad 2 molů peroxidu vodíku: 2 H 2 O 2 → 2 H 2 O + O 2 ; Uvolní se teplo (Qmb) 195, 8 k. J/mol; Závěr: Při rozkladu dvojnásobného látkového množství peroxidu vodíku se uvolní dvojnásobné množství tepla. Proto je nutno při uvádění vyměňovaného tepla uvádět i rovnici děje, u které jsou zřejmá látková množství látek (event. jejich poměry). Ø Reakce probíhající v tzv. jednotkovém rozsahu – při ní zreagují taková látková množství reaktantů, jaká uvádějí stechiometrické koeficienty v platné chemické rovnici daného děje. Ø Reakční teplo Qm je teplo, které soustava příjme nebo uvolní za konstantního tlaku a konstantní teploty při jednotkovém látkovém rozsahu reakce. Jednotkou je k. J/mol. 5

Základy termochemie a reakční teplo (2) 1. Poznámky k definici reakčního tepla: Uvedená definice reakčního tepla vychází z termodynamické funkce – entalpie. Představuje změnu entalpie: Qm = ΔH. Entalpie je termodynamická veličina (funkce), která v sobě zahrnuje vnitřní energii soustavy a její schopnost konat objemovou práci za konstantního tlaku. Podrobnější výklad je součástí učiva obecné chemie ve 4. ročníku. Tato část učiva není pro 1. ročník chemie povinná. V uvedené definici konstantní teplota představuje podmínku, že teplota výchozích látek i produktů během reakce zůstává stejná. 1. Standardní reakční teplo ΔH º nebo Qm º - je reakční teplo za tzv. standardních podmínek (tj. teplota 25 ºC, tlak 101, 325 k. Pa; nejstálejší modifikace). 2. Termochemická rovnice je způsob zápisu chemického děje v termochemii. Tato rovnice obsahuje, oproti běžné rovnici, ještě údaj o reakčním teple. 3. Hodnota reakčního tepla rovněž závisí na skupenství, modifikaci a struktuře látek v reakční soustavě. Proto se v termochemické rovnici uvádějí u reaktantů a produktů i symboly pro skupenství, modifikaci, roztok apod. 4. Termochemické rovnice - příklady: Zn(s) + 2 HCl(aq) → H 2(g) + Zn. Cl(aq) ; ΔH = Qm = - 154, 0 k. J/mol; 2 H 2 O 2(l) → 2 H 2 O(l) + O 2(g); Qm = - 195, 8 k. J/mol; C(graf) + O 2(g) → CO 2(g); ΔH = - 383, 7 k. J/mol; s – pevné skupenství; l – kapalina; g – plynné skupenství; aq – vodný roztok; graf – modifikace grafit; ΔH, Qm – reakční teplo. 6

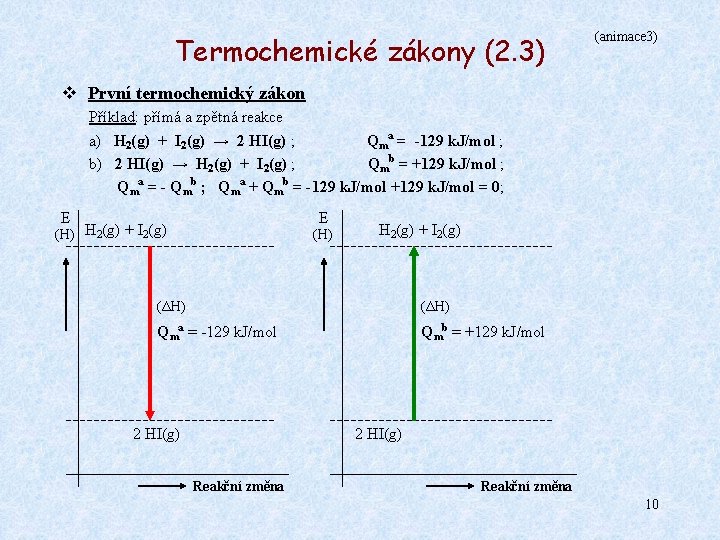
Termochemické zákony (1) Ø Reakce exotermické - při nich soustava teplo uvolňuje a předává ho do okolí, Qm < 0 ; Ø Reakce endotermické - při nich soustava teplo pohlcuje, Qm > 0 ; v První termochemický zákon Formulovali jej v r. 1780 A. L. Lavoisier a P. S. Laplace. Jeho formulace v moderní podobě: Reakční teplo určité reakce a reakční teplo téže reakce probíhající za stejných podmínek opačným směrem je až na znaménko stejné. Obecně pro reakci A ← → B platí: Qm(A → B) = - Qm (B → A) Příklad: přímá a zpětná reakce a) H 2(g) + I 2(g) → 2 HI(g) ; b) 2 HI(g) → H 2(g) + I 2(g) ; Qma = -129 k. J/mol ; Qmb = +129 k. J/mol ; Platí zde: Qma = - Qmb 7

Termochemické zákony (2. 1) (animace 1) v První termochemický zákon Příklad: přímá reakce a) H 2(g) + I 2(g) → 2 HI(g) ; Qma = -129 k. J/mol ; E (H) H 2(g) + I 2(g) (ΔH) Reakce je exotermická. Qma = -129 k. J/mol Uvolní se 129 k. J/mol tepla. 2 HI(g) Reakční změna 8

Termochemické zákony (2. 2) (animace 2) v První termochemický zákon Příklad: zpětná reakce Qmb = +129 k. J/mol ; b) 2 HI(g) → H 2(g) + I 2(g) ; E (H) H 2(g) + I 2(g) (ΔH) Reakce je endotermická. Qmb = +129 k. J/mol Spotřebuje se 129 k. J/mol tepla. 2 HI(g) Reakční změna 9

Termochemické zákony (2. 3) (animace 3) v První termochemický zákon Příklad: přímá a zpětná reakce a) H 2(g) + I 2(g) → 2 HI(g) ; Qma = -129 k. J/mol ; b) 2 HI(g) → H 2(g) + I 2(g) ; Qmb = +129 k. J/mol ; Qma = - Qmb ; Qma + Qmb = -129 k. J/mol +129 k. J/mol = 0; E E (H) H 2(g) + I 2(g) (ΔH) Qma = -129 k. J/mol Qmb = +129 k. J/mol 2 HI(g) Reakční změna 10

Termochemické zákony (2. 4) (animace 4) v První termochemický zákon Příklad: přímá a zpětná reakce a) reaktanty → produkty ; b) produkty → reaktanty ; E (H) reaktanty produkty Qma = - Qmb produkty (ΔH) Qma Qmb Reakční teplo určité reakce a reakční teplo téže reakce probíhající za stejných podmínek opačným směrem je až na znaménko stejné. reaktanty Reakční změna 11

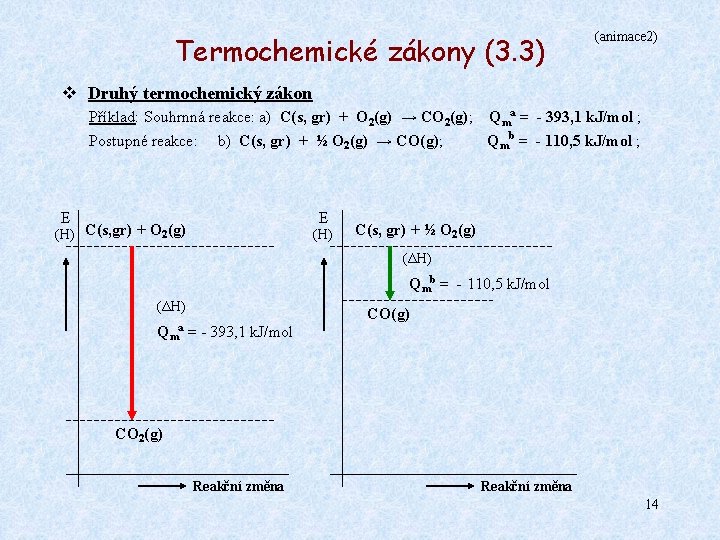
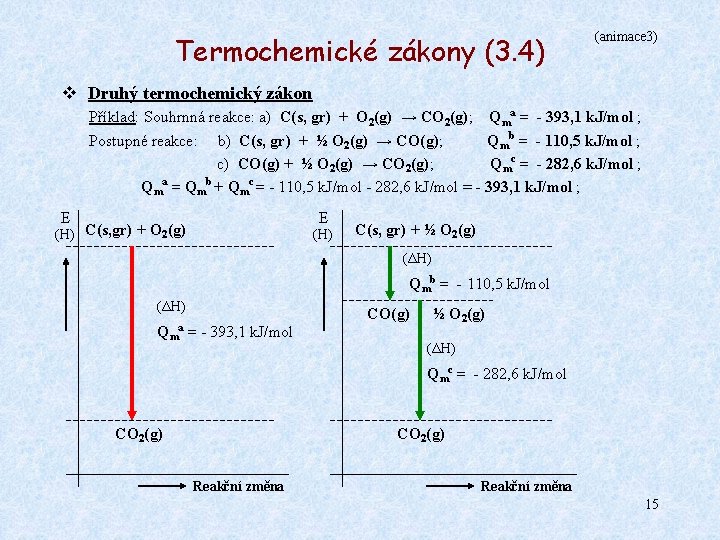
Termochemické zákony (3. 1) v Druhý termochemický zákon (Hessův) Objevil jej v 19. století G. H. Hess. Jeho formulace v moderní podobě: Reakční teplo určité reakce je stejné jako součet reakčních tepel postupně prováděných reakcí, vycházejících ze stejných výchozích látek a končících stejnými produky. Jiná – obecnější formulace: Reakční teplo kterékoliv chemické reakce nezávisí na způsobu přeměny výchozích látek v produkty, ale pouze na počátečním a konečném stavu soustavy. Obecné schéma: A C Qm(A → C) = Qm(A → B) + Qm(B → C) B Příklad: Souhrnná reakce: a) C(grafit) + O 2(g) → CO 2(g) ; Dílčí reakce: b) C(grafit) + ½ O 2(g) → CO(g) ; c) CO(g) + ½ O 2(g) → CO 2(g) ; Protože reakce a) se rovná součtu reakcí b) a c), Qma = -393, 1 k. J/mol ; Qmb = -110, 5 k. J/mol ; Qmc = -282, 6 k. J/mol ; platí rovněž: Qma = Qmb + Qmc 12

Termochemické zákony (3. 2) (animace 1) v Druhý termochemický zákon Příklad: Souhrnná reakce: a) C(s, gr) + O 2(g) → CO 2(g); Qma = - 393, 1 k. J/mol ; E (H) C(s, gr) + O 2(g) (ΔH) Qma = - 393, 1 k. J/mol CO 2(g) Reakční změna 13

Termochemické zákony (3. 3) (animace 2) v Druhý termochemický zákon Příklad: Souhrnná reakce: a) C(s, gr) + O 2(g) → CO 2(g); Qma = - 393, 1 k. J/mol ; Postupné reakce: b) C(s, gr) + ½ O 2(g) → CO(g); Qmb = - 110, 5 k. J/mol ; E E (H) C(s, gr) + O 2(g) (H) C(s, gr) + ½ O 2(g) (ΔH) Qmb = - 110, 5 k. J/mol (ΔH) Qma CO(g) = - 393, 1 k. J/mol CO 2(g) Reakční změna 14

Termochemické zákony (3. 4) (animace 3) v Druhý termochemický zákon Příklad: Souhrnná reakce: a) C(s, gr) + O 2(g) → CO 2(g); Qma = - 393, 1 k. J/mol ; Postupné reakce: b) C(s, gr) + ½ O 2(g) → CO(g); Qmb = - 110, 5 k. J/mol ; c) CO(g) + ½ O 2(g) → CO 2(g); Qmc = - 282, 6 k. J/mol ; Qma = Qmb + Qmc = - 110, 5 k. J/mol - 282, 6 k. J/mol = - 393, 1 k. J/mol ; E E (H) C(s, gr) + O 2(g) (H) C(s, gr) + ½ O 2(g) (ΔH) Qmb = - 110, 5 k. J/mol (ΔH) Qma CO(g) = - 393, 1 k. J/mol ½ O 2(g) (ΔH) Qmc = - 282, 6 k. J/mol CO 2(g) Reakční změna 15

Termochemické zákony (3. 5) (animace 4) 1. Druhý termochemický zákon Příklad: Souhrnná reakce: a) reaktanty 1 → produkt; Postupné reakce: b) reaktant 2 → meziprodukt; c) meziprodukt → produkt; (reaktanty 1 + reaktant 2 = reaktanty) Qma Qmb Qmc Qma = Qmb + Qmc E (H) reaktanty 1, 2 (ΔH) Qmb (ΔH) Qma produkt meziprodukt (ΔH) Qmc produkt Reakční teplo určité reakce je stejné jako součet reakčních tepel postupně prováděných reakcí, vycházejících ze stejných výchozích látek a končících stejnými produky. Jiná – obecnější formulace: Reakční teplo kterékoliv chemické reakce nezávisí na způsobu přeměny výchozích látek v produkty, ale pouze na počátečním a konečném stavu soustavy. Reakční změna 16

Termochemické zákony (3. 6) v Druhý termochemický zákon - příklad: Souhrnná reakce: a) 2 Na. OH(aq) +CO 2(g) → Na 2 CO 3(aq) + H 2 O(l); Qma = - 109 k. J/mol; Postupné reakce: b) Na. OH(aq) +CO 2(g) → Na. HCO 3(aq); Qmb = 37 k. J/mol; c) Na. HCO 3(aq) + Na. OH(aq) → Na 2 CO 3(aq) + H 2 O(l); Qmc = - 146 k. J/mol; Qma = Qmb + Qmc = 37 k. J/mol - 146 k. J/mol = - 109 k. J/mol; E E (H) Na. HCO 3(aq) + Na. OH(aq) (ΔH) Qmb = 37 k. J/mol 2 Na. OH(aq) +CO 2(g) (ΔH) Qma = - 109 k. J/mol Na 2 CO 3(aq) + H 2 O(l) Reakční změna Qmc = - 282, 6 k. J/mol Na 2 CO 3(aq) + H 2 O(l) Reakční změna 17

Termochemické zákony (4) Ø Využití termochemických zákonů – při výpočtu reakčního tepla reakcí, kde tato tepla nelze měřit přímo. ü Příklad: Vypočítejte reakční teplo reakce: 2 H 2(g) + O 2(g) → 2 H 2 O (l); Qma = ? Známe termochemickou rovnici: 2 H 2 O (l) → 2 H 2(g) + O 2(g) ; Qmb = 457, 2 k. J/mol. Řešení: Zadaná termochemická rovnice představuje zpětnou reakci k reakci, pro kterou hledáme reakční teplo. Podle 1. termochemického zákona proto platí, že Qma = Qmb. Reakční teplo zadané reakce je - 457, 2 k. J/mol. ü Příklad: Vypočítejte reakční teplo děje: C(grafit) + 2 H 2(g) → CH 4(g); Qm = ? pomocí následujících termochemických rovnic: a) C(grafit) + O 2(g) → CO 2(g) ; Qma = - 393 k. J/mol ; b) H 2(g) + ½ O 2(g) → H 2 O (l) ; Qmb = - 286 k. J/mol ; c) CH 4(g) + 2 O 2(g) → CO 2(g) + 2 H 2 O (l) ; Qmc = - 889 k. J/mol ; Řešení: Zadanou rovnici získáme sečtením rovnice a) s dvojnásobkem rovnice b) a odečtením rovnice c). Proto podle 2. termochemického zákona platí pro reakční tepla: Qm = Qma + 2 Qmb – Qmc = [-393 + 2. (-286) – (-889)] k. J/mol = -76 k. J/mol. Reakční teplo pro uvedenou chemickou reakci činí – 76 k. J/mol. 18

Autor: © RNDr. Miroslav TURJAP 2013 19
 Kinetische energie in elektrische energie
Kinetische energie in elektrische energie Hydroxidy vzorce
Hydroxidy vzorce Adriana chemick
Adriana chemick Vzorce halogenidov
Vzorce halogenidov Adriana chemick
Adriana chemick Kyselina manganistá vzorec
Kyselina manganistá vzorec Adriana chemick
Adriana chemick Termodynamika powtórzenie
Termodynamika powtórzenie Termodynamika statystyczna
Termodynamika statystyczna Ciśnienie hydrostatyczne
Ciśnienie hydrostatyczne Entalpia swobodna
Entalpia swobodna Ii zasada termodynamiki
Ii zasada termodynamiki Site:slidetodoc.com
Site:slidetodoc.com Termodynamika
Termodynamika Kappa termodynamika
Kappa termodynamika Termodynamika
Termodynamika Mechanizmy reakcji organicznych
Mechanizmy reakcji organicznych Reakn
Reakn Reakn
Reakn Reakn
Reakn