CHEMIA ORGANICZNA WYKAD 7 Etery Synteza eterw Synteza






- Slides: 40

CHEMIA ORGANICZNA WYKŁAD 7

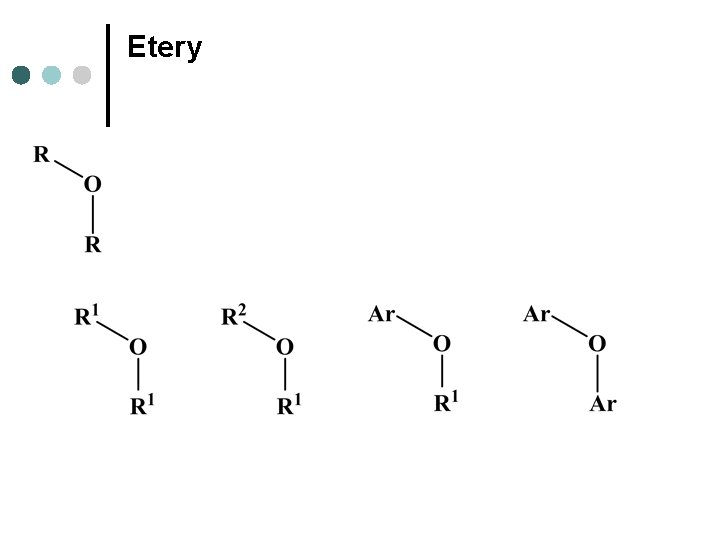
Etery

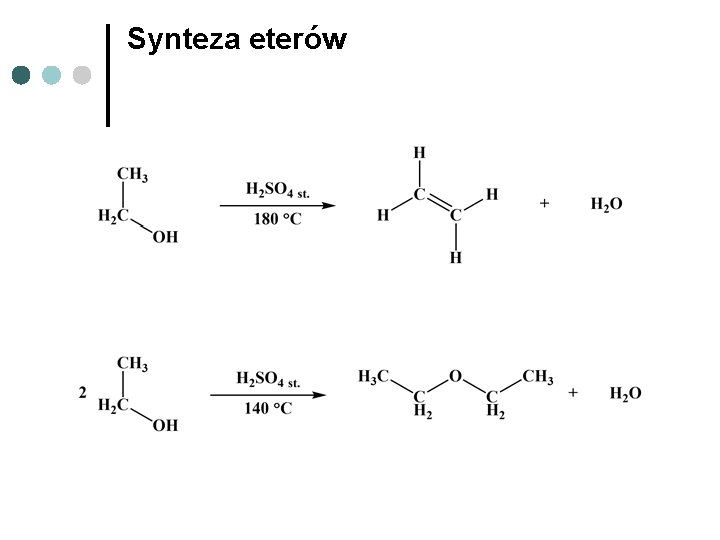
Synteza eterów

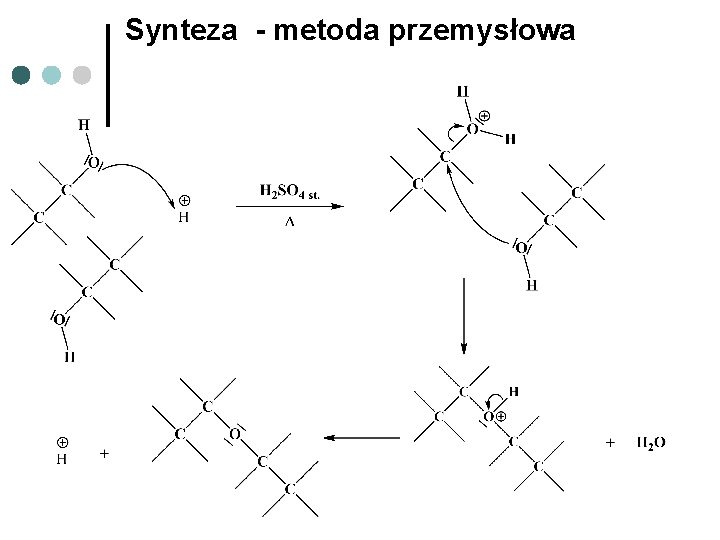
Synteza - metoda przemysłowa

ZADANIE DOMOWE Jakie produkty otrzymamy, gdy będziemy ogrzewać mieszaninę alkoholu etylowego i n-propylowego z katalityczną ilością kwasu siarkowego?

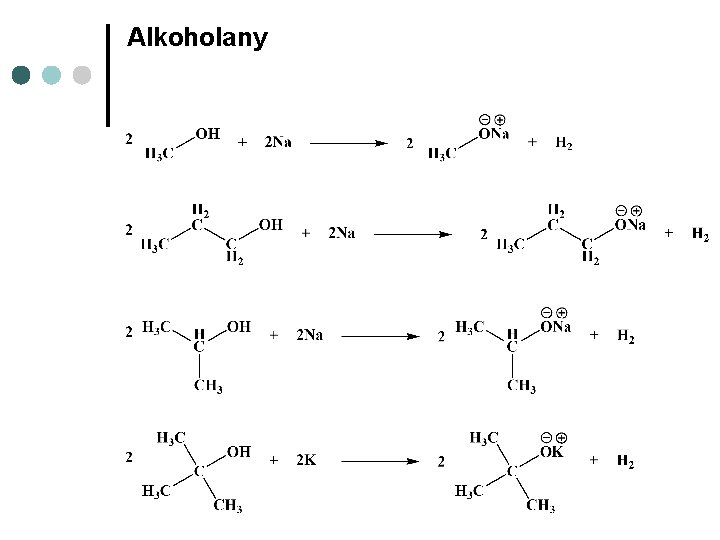
Alkoholany

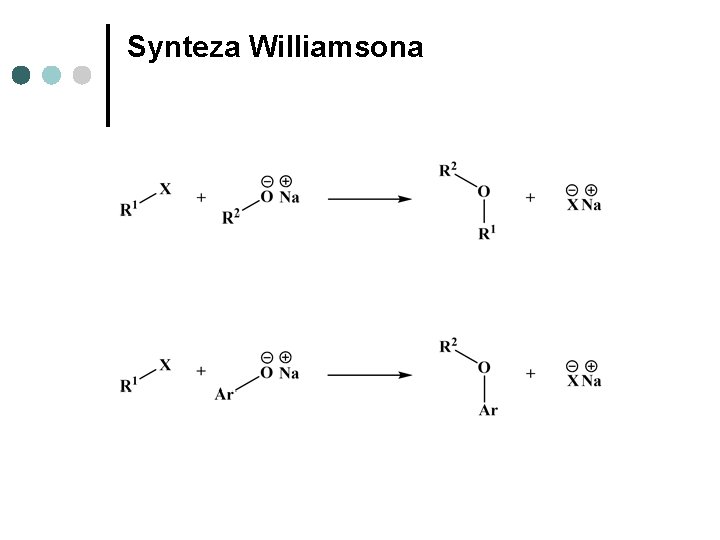
Synteza Williamsona

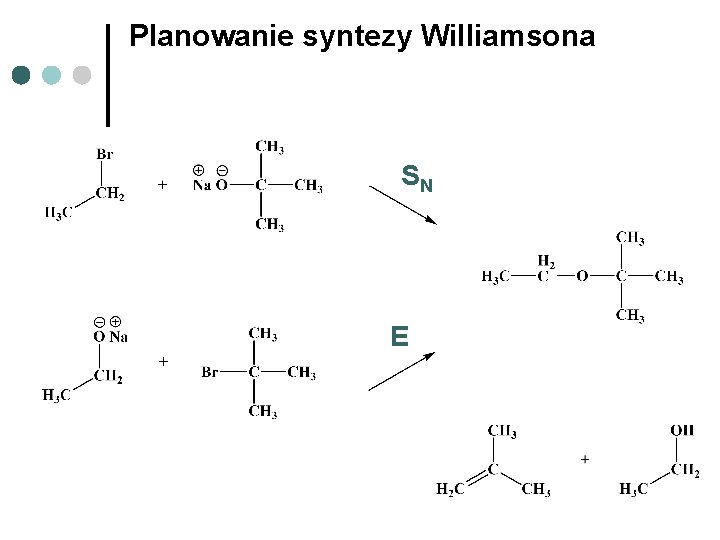
Planowanie syntezy Williamsona SN E

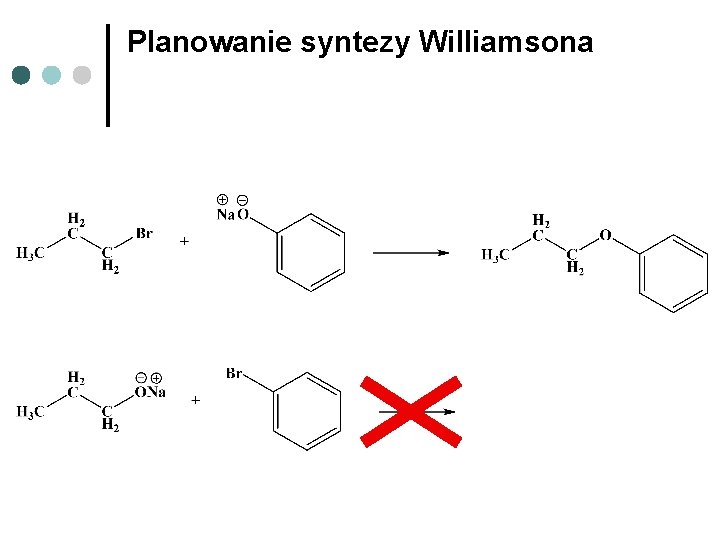
Planowanie syntezy Williamsona

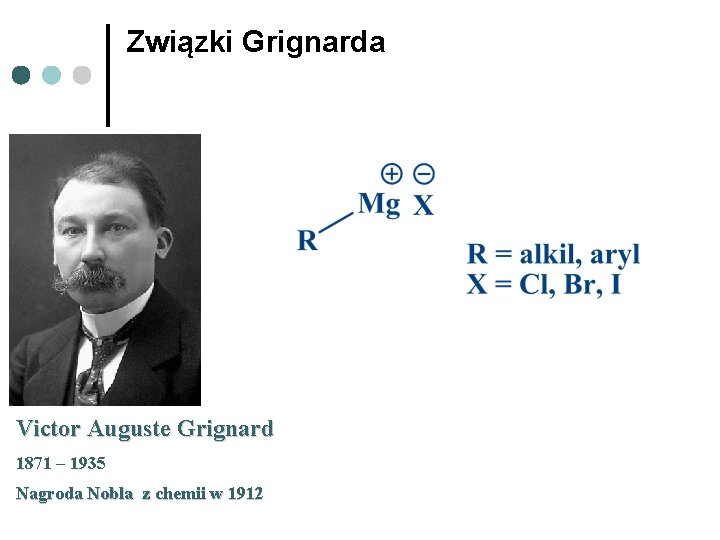
Związki Grignarda Victor Auguste Grignard 1871 – 1935 Nagroda Nobla z chemii w 1912

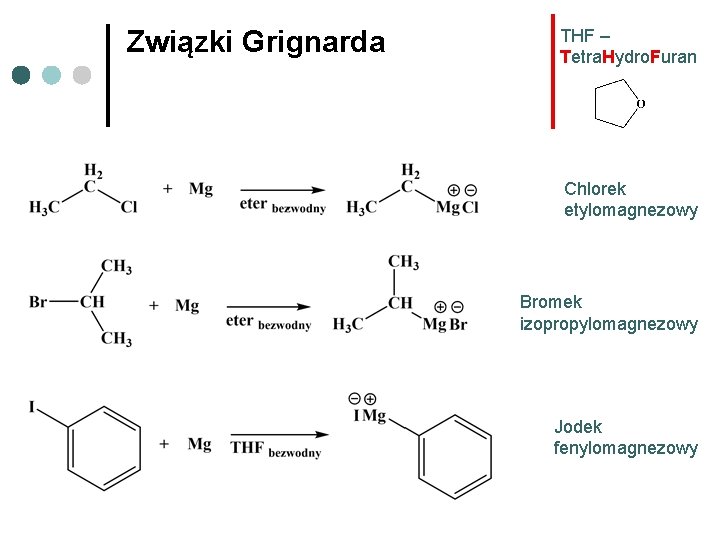
Związki Grignarda THF – Tetra. Hydro. Furan Chlorek etylomagnezowy Bromek izopropylomagnezowy Jodek fenylomagnezowy

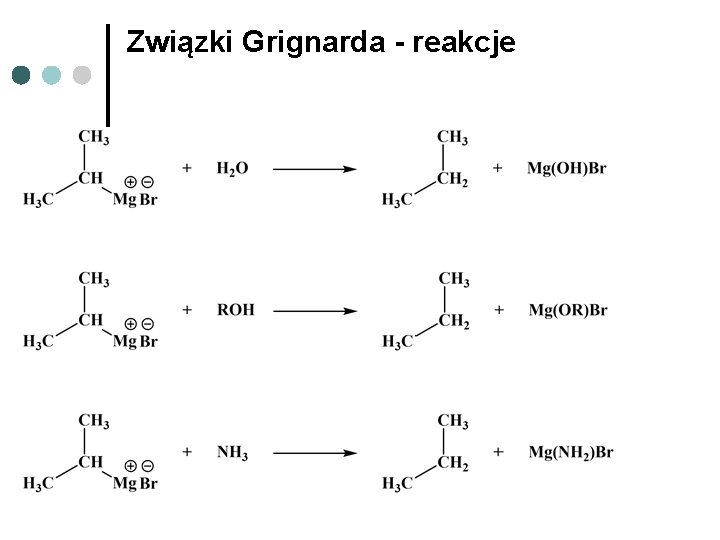
Związki Grignarda - reakcje

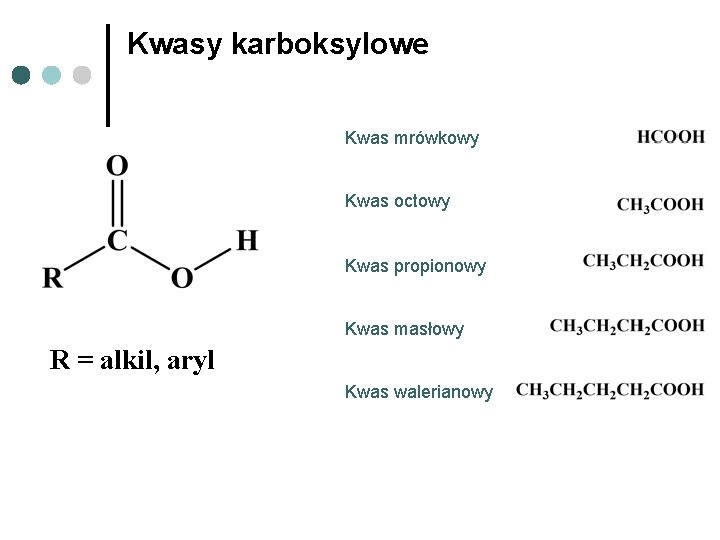
Kwasy karboksylowe Kwas mrówkowy Kwas octowy Kwas propionowy Kwas masłowy R = alkil, aryl Kwas walerianowy

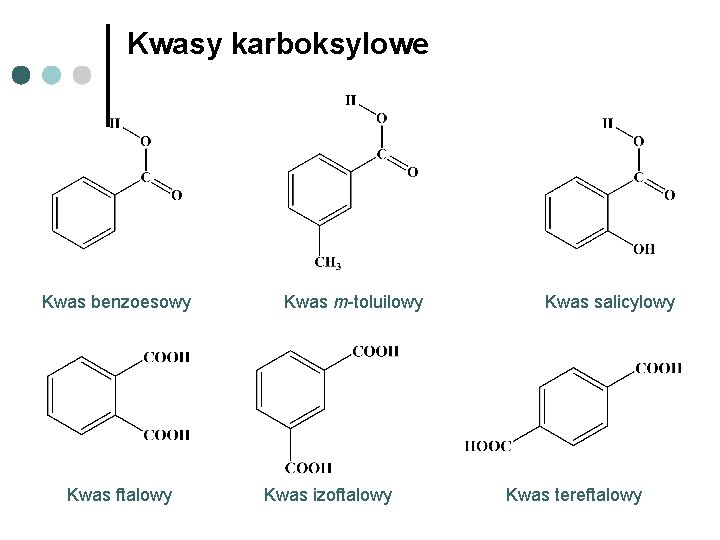
Kwasy karboksylowe Kwas benzoesowy Kwas ftalowy Kwas m-toluilowy Kwas izoftalowy Kwas salicylowy Kwas tereftalowy

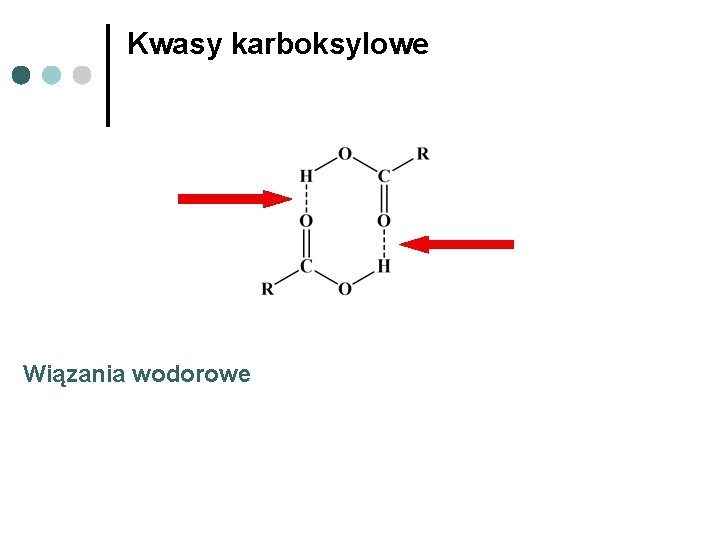
Kwasy karboksylowe Wiązania wodorowe

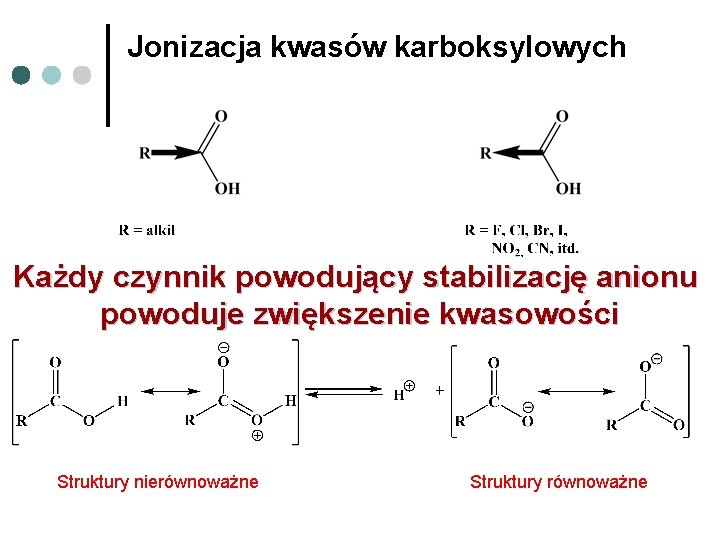
Jonizacja kwasów karboksylowych Tabela. Stałe dysocjacji wybranych kwasów (T = 25 °C) Lp. Wzór Ka p. Ka 1. HClaq. 10 000 -7, 00 2. H 2 SO 4 1 000 -3, 00 3. HCOOH 17, 78 10 -5 3, 75 4. CH 3 COOH 1, 74 10 -5 4, 76 5. CH 3 CH 2 COOH 1, 38 10 -5 4, 86 6. Cl 3 CCOOH 19 952, 62 10 -5 0, 70 Dla kwasu mrówkowego T = 20 °C; dla kwasu siarkowego podana wartość dla pierwszego stopnia dysocjacji

Jonizacja kwasów karboksylowych Każdy czynnik powodujący stabilizację anionu powoduje zwiększenie kwasowości Struktury nierównoważne Struktury równoważne

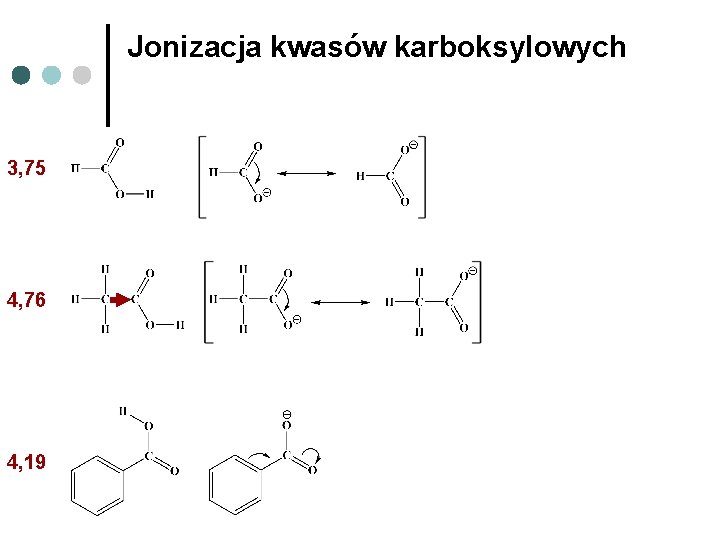
Jonizacja kwasów karboksylowych 3, 75 4, 76 4, 19

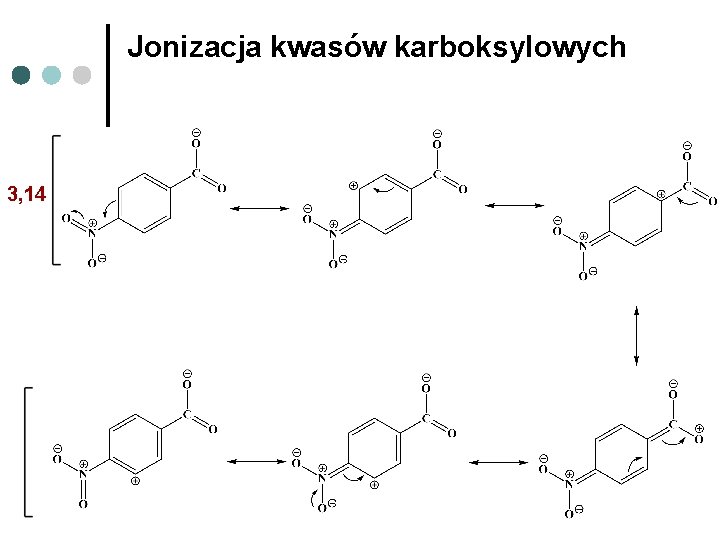
Jonizacja kwasów karboksylowych 3, 14

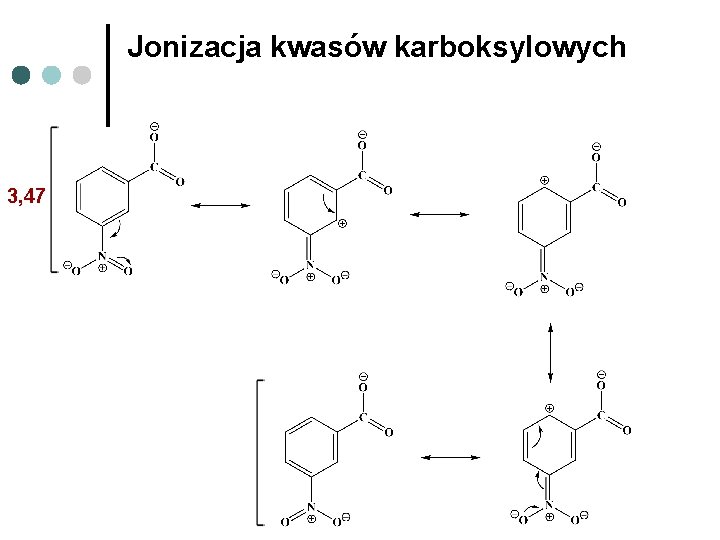
Jonizacja kwasów karboksylowych 3, 47

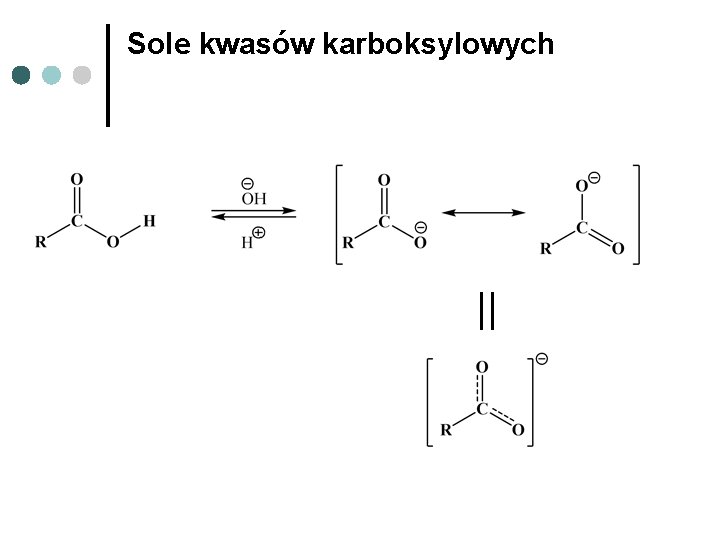
Sole kwasów karboksylowych

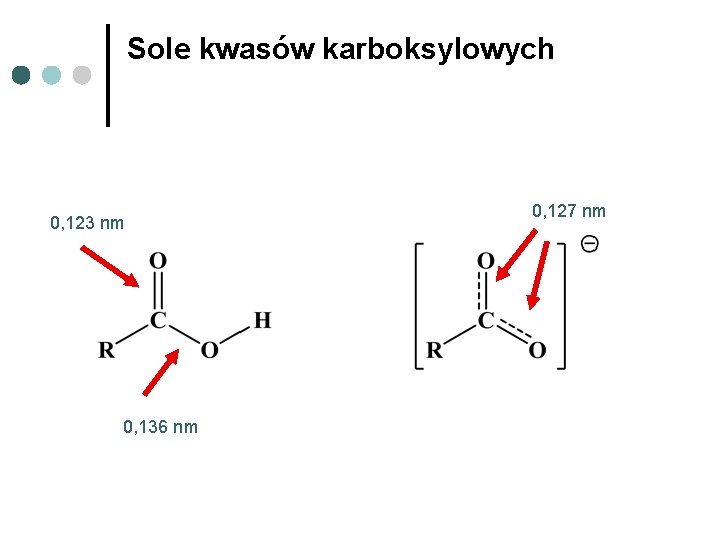
Sole kwasów karboksylowych 0, 123 nm 0, 136 nm 0, 127 nm

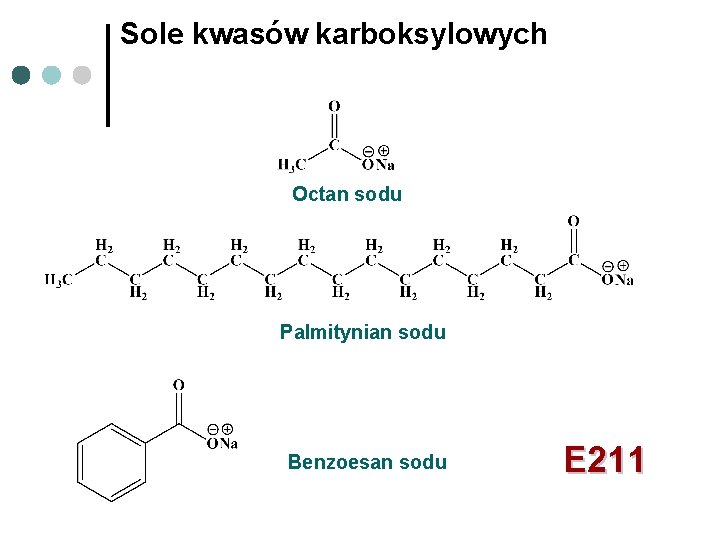
Sole kwasów karboksylowych Octan sodu Palmitynian sodu Benzoesan sodu E 211

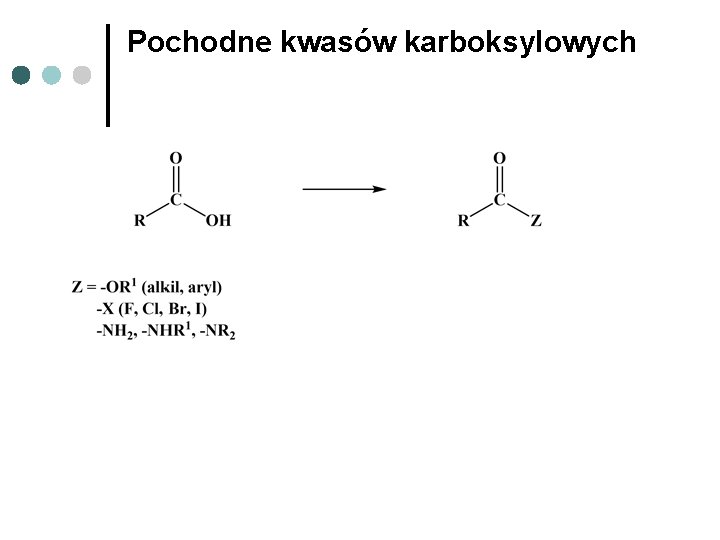
Pochodne kwasów karboksylowych

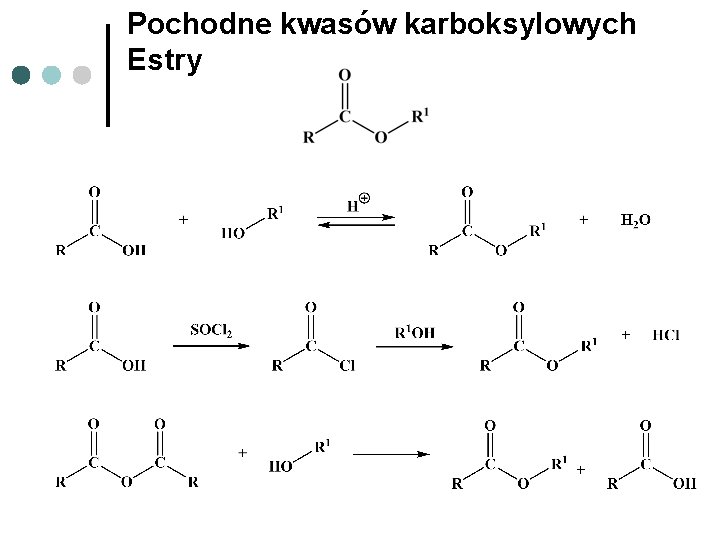
Pochodne kwasów karboksylowych Estry

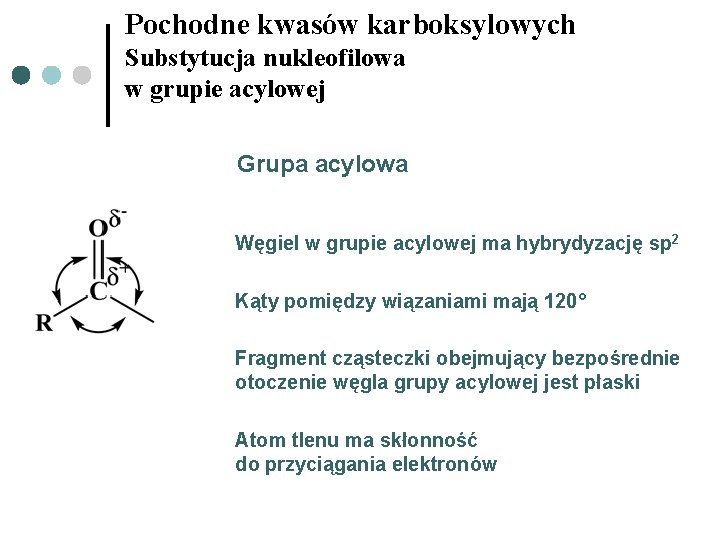
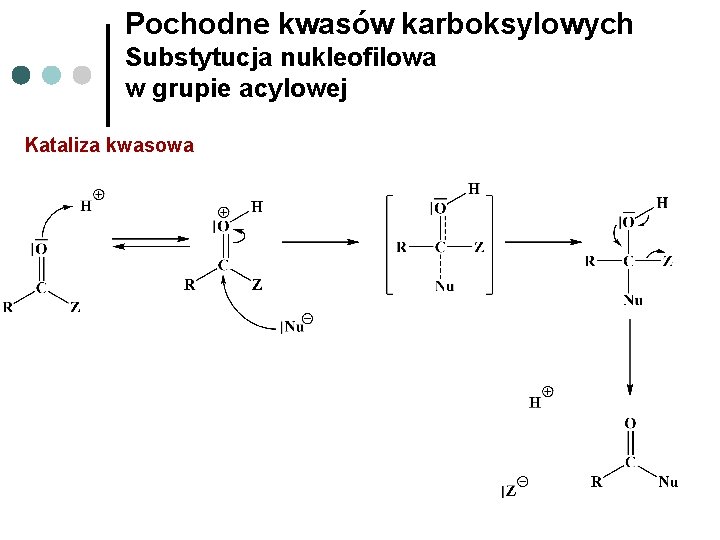
Pochodne kwasów karboksylowych Substytucja nukleofilowa w grupie acylowej Grupa acylowa Węgiel w grupie acylowej ma hybrydyzację sp 2 Kąty pomiędzy wiązaniami mają 120° Fragment cząsteczki obejmujący bezpośrednie otoczenie węgla grupy acylowej jest płaski Atom tlenu ma skłonność do przyciągania elektronów

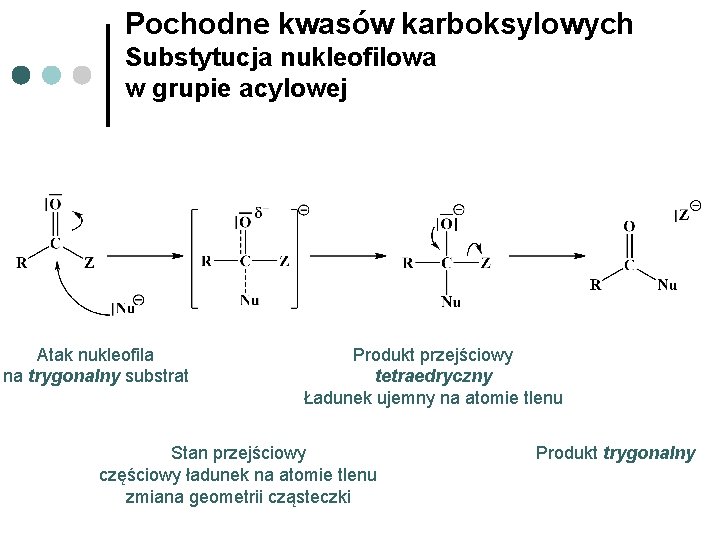
Pochodne kwasów karboksylowych Substytucja nukleofilowa w grupie acylowej Atak nukleofila na trygonalny substrat Produkt przejściowy tetraedryczny Ładunek ujemny na atomie tlenu Stan przejściowy częściowy ładunek na atomie tlenu zmiana geometrii cząsteczki Produkt trygonalny

Pochodne kwasów karboksylowych Substytucja nukleofilowa w grupie acylowej Kataliza kwasowa

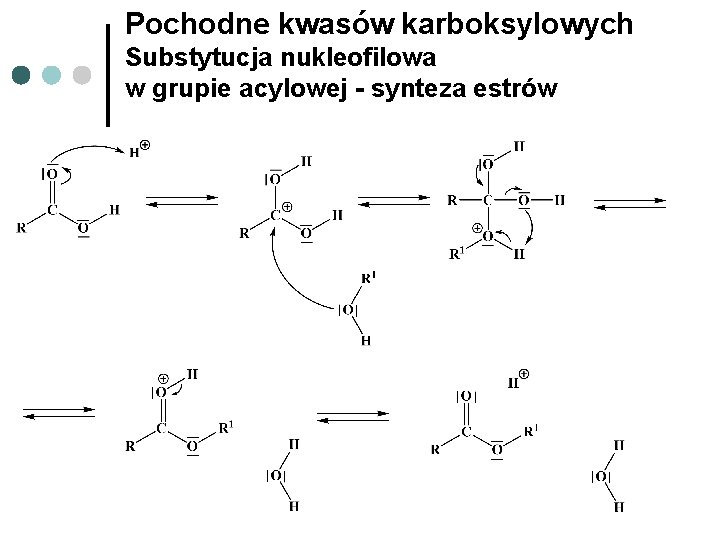
Pochodne kwasów karboksylowych Substytucja nukleofilowa w grupie acylowej - synteza estrów

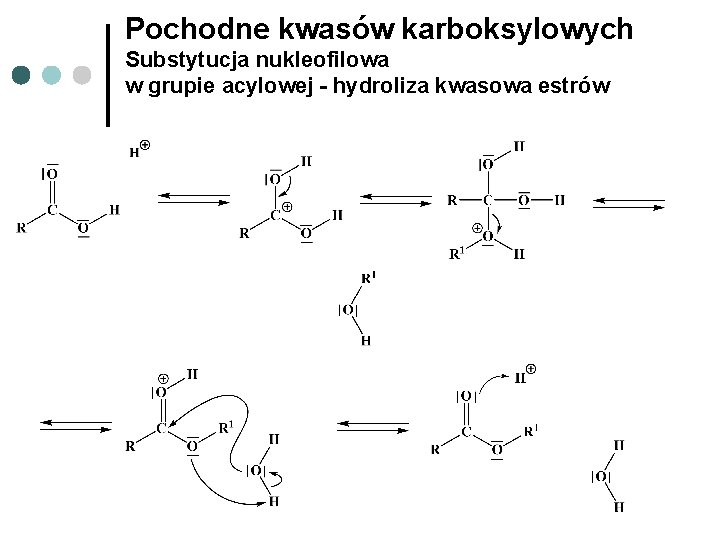
Pochodne kwasów karboksylowych Substytucja nukleofilowa w grupie acylowej - hydroliza kwasowa estrów

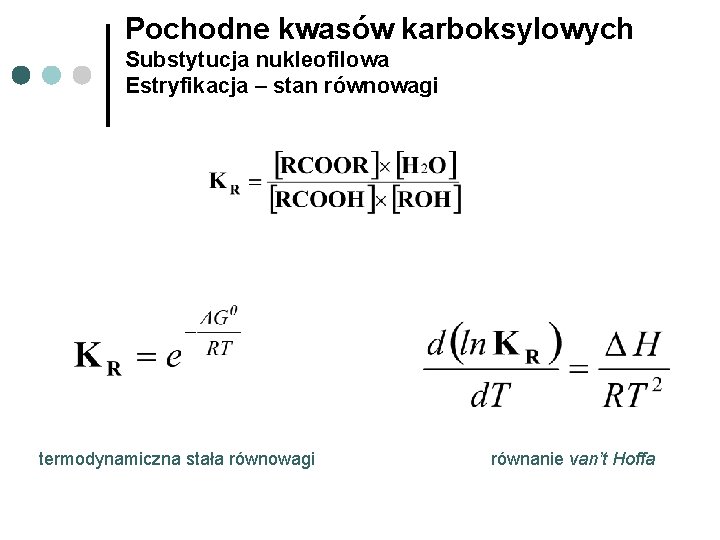
Pochodne kwasów karboksylowych Substytucja nukleofilowa Estryfikacja – stan równowagi termodynamiczna stała równowagi równanie van’t Hoffa

Pochodne kwasów karboksylowych Substytucja nukleofilowa Estryfikacja – stan równowagi Sposoby przesuwania stałej równowagi w kierunku produktów Zastosowanie nadmiaru jednego z substratów Odbieranie ze środowiska reakcji tworzącego się estru Odbieranie ze środowiska reakcji tworzącej się wody

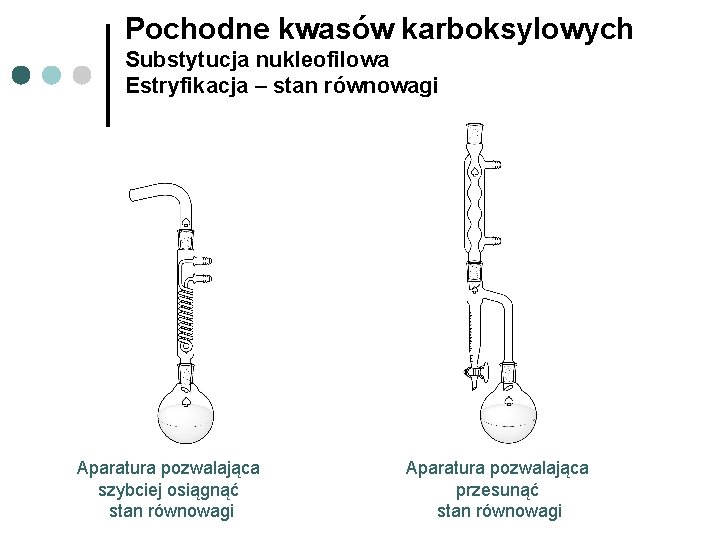
Pochodne kwasów karboksylowych Substytucja nukleofilowa Estryfikacja – stan równowagi Aparatura pozwalająca szybciej osiągnąć stan równowagi Aparatura pozwalająca przesunąć stan równowagi

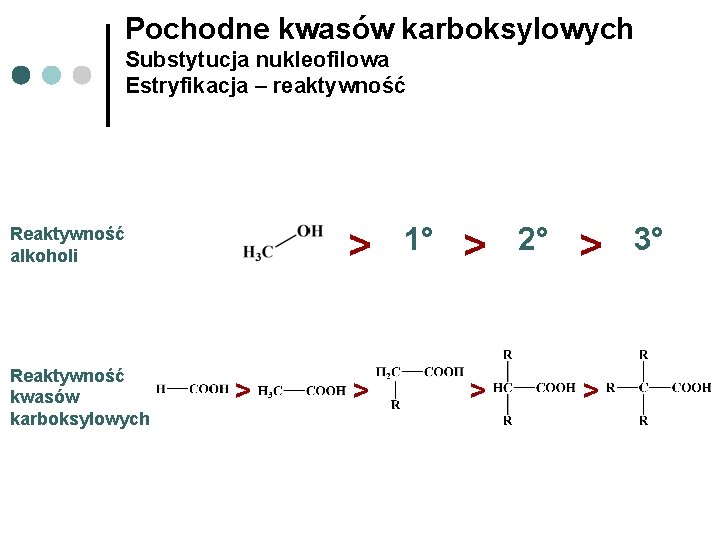
Pochodne kwasów karboksylowych Substytucja nukleofilowa Estryfikacja – reaktywność > Reaktywność alkoholi Reaktywność kwasów karboksylowych > > 1° > > 2° > > 3°

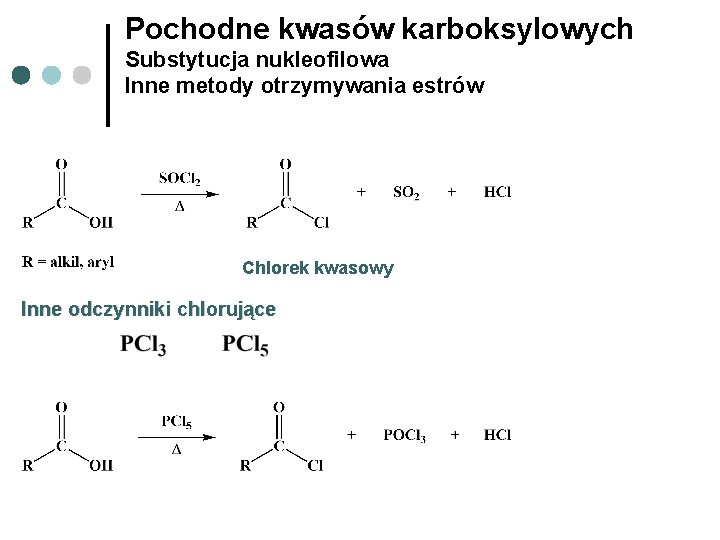
Pochodne kwasów karboksylowych Substytucja nukleofilowa Inne metody otrzymywania estrów Chlorek kwasowy Inne odczynniki chlorujące

ZADANIE DOMOWE Jakie produkty powstaną w reakcji kwasu benzoesowego z trójchlorkiem fosforu?

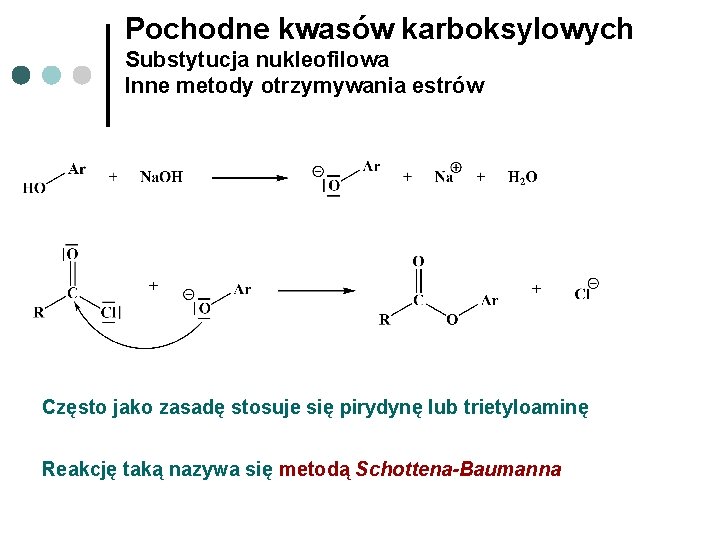
Pochodne kwasów karboksylowych Substytucja nukleofilowa Inne metody otrzymywania estrów Często jako zasadę stosuje się pirydynę lub trietyloaminę Reakcję taką nazywa się metodą Schottena-Baumanna

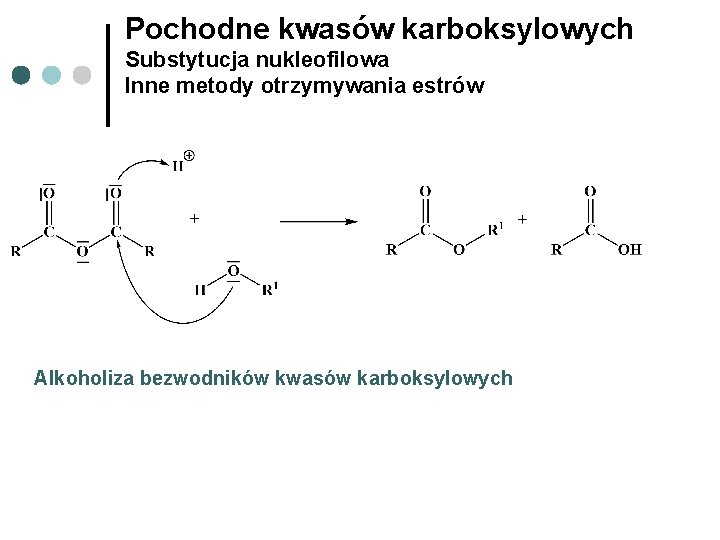
Pochodne kwasów karboksylowych Substytucja nukleofilowa Inne metody otrzymywania estrów Alkoholiza bezwodników kwasów karboksylowych

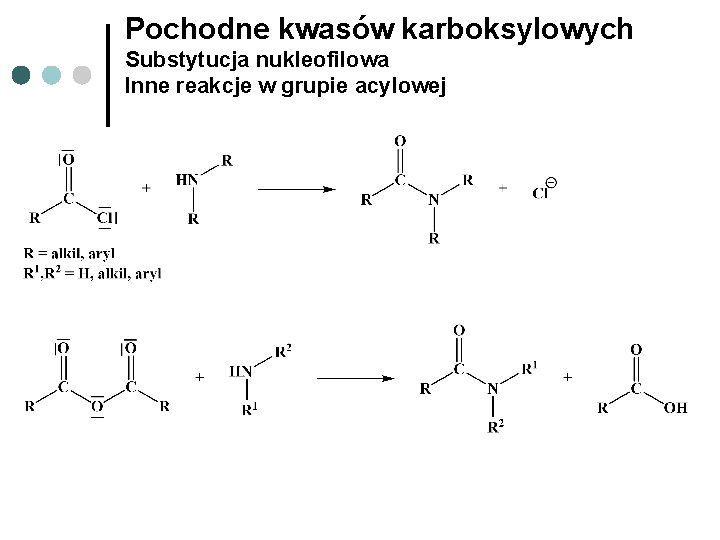
Pochodne kwasów karboksylowych Substytucja nukleofilowa Inne reakcje w grupie acylowej

KON I EC