CHAPITRE III CONDUCTION ELECTRIQUE DES SOLUTIONS AQUEUSES I

















- Slides: 23

CHAPITRE III – CONDUCTION ELECTRIQUE DES SOLUTIONS AQUEUSES

I - Le courant électrique dans les solutions. 1) Les solutions ioniques sont conductrices. • Voir TP chimie N° 2 • L’eau pure, l’eau sucrée ou l’huile contiennent des molécules : ce ne sont pas des solutions conductrices. • Les solutions qui contiennent des ions (solutions ioniques ) sont des solutions conductrices. Ex: eau salée, solution de sulfate de cuivre, …

Conclusion : Les solutions aqueuses doivent contenir des ions (particules chargées) pour être conductrices. Les solutions qui ne contiennent que des molécules ne sont pas conductrices.

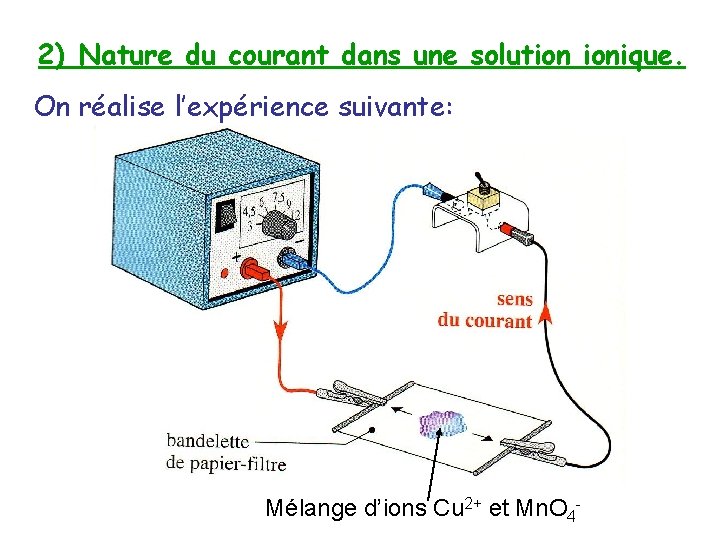
2) Nature du courant dans une solution ionique. On réalise l’expérience suivante: Mélange d’ions Cu 2+ et Mn. O 4 -

Voir la vidéo sur la migration des ions

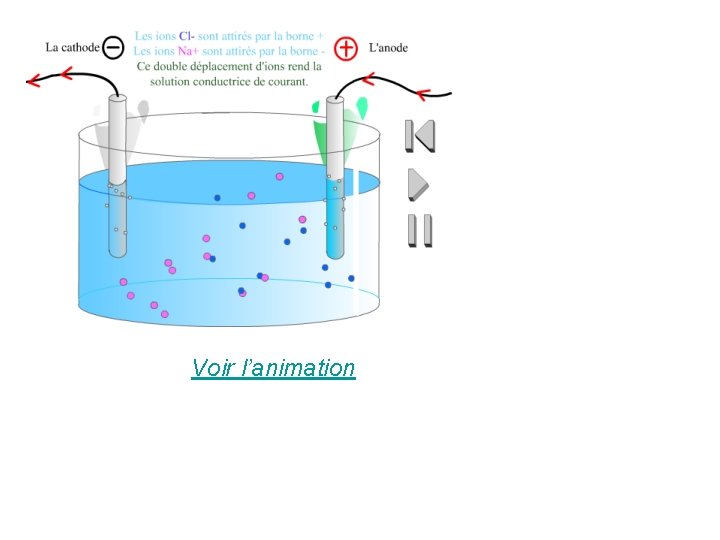
Les ions cuivre Cu 2+, de couleur bleue, se sont déplacés dans le sens du courant, vers la borne – du générateur. • • Les ions permanganate Mn. O 4 -, de couleur violette, se sont déplacés dans le sens opposé à celui du courant, vers la borne +.

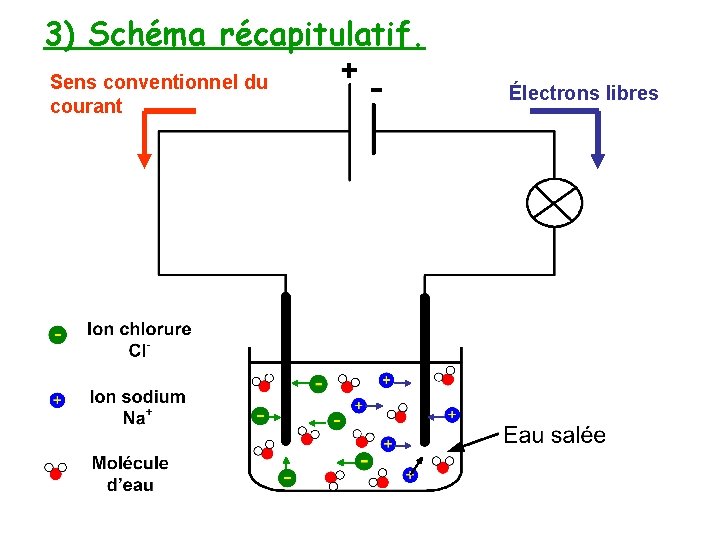
Conclusion : Dans les solutions aqueuses, le courant électrique est dû à un déplacement d’ions. Les ions positifs se déplacent dans le sens du courant (vers la borne -) et les ions négatifs dans le sens contraire (vers la borne +).

3) Schéma récapitulatif. Sens conventionnel du courant Électrons libres

Voir l’animation

Voir l’animation

II – Les ions 1) Définition • Un ion est un atome ou groupe d’atomes qui a perdu ou gagné un ou plusieurs électrons. • L’atome ou groupe d’atomes qui perd un ou des électrons devient un ion positif appelé cation. • L’atome ou groupe d’atomes qui gagne un ou des électrons devient un ion négatif appelé anion.

2) Les ions monoatomiques a. Exemple du sodium : 11 + l’atome a perdu 11 + 1électron 10 - 11 - atome de sodium (Z=11) Bilan : Écriture : (11+) + (11 -) = 0 Na ion sodium (11+) + (10 -) = 1+ Na+ L’ion sodium est un atome de sodium qui a perdu un électron : on le note Na+.

b. Exemple du chlore : 17 + l’atome a gagné 17 - 1électron atome de chlore (Z=17) Bilan : Écriture : (17+) + (17 -) = 0 Cl 17 + 18 ion chlorure (17+) + (18 -) = 1 - Cl - L’ion chlorure est un atome de chlore qui a gagné un électron : on le note Cl-.

c. Exemple du calcium : 20 + l’atome a perdu 20 + 2 électrons 18 - 20 - atome de calcium (Z=20) Bilan : Écriture : (20+) + (20 -) = 0 Ca ion calcium (20+) + (18 -) = 2+ Ca 2+ L’ion calcium est un atome de calcium qui a perdu deux électrons : on le note Ca 2+.

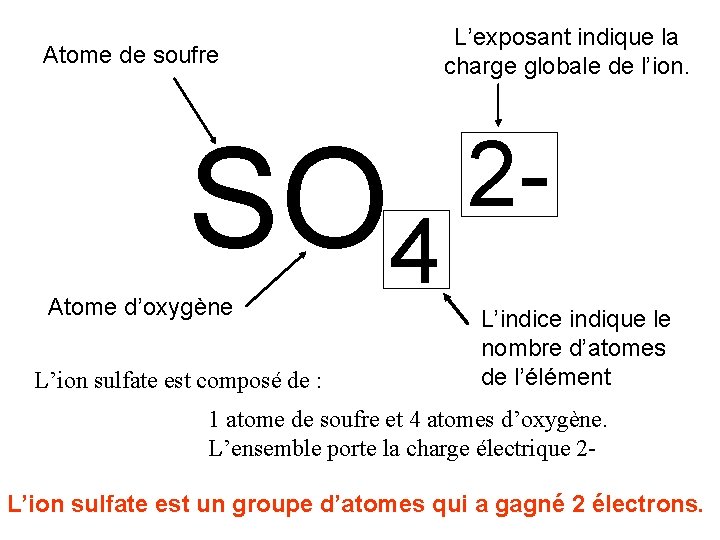
3) Les ions polyatomiques. Ils sont formés par un groupement de plusieurs atomes. La charge positive ou négative s’applique à l’ensemble des atomes du groupe. Exemple d’ion polyatomique : ion sulfate SO 4 2 -

Atome de soufre SO 4 Atome d’oxygène L’ion sulfate est composé de : L’exposant indique la charge globale de l’ion. 2 L’indice indique le nombre d’atomes de l’élément 1 atome de soufre et 4 atomes d’oxygène. L’ensemble porte la charge électrique 2 L’ion sulfate est un groupe d’atomes qui a gagné 2 électrons.

III – Les solides ioniques et la conduction électrique 1) Les solides ioniques De nombreux cristaux sont constitués d’ions ( sel, sulfate de cuivre…). Ces cristaux étant électriquement neutres, ils sont nécessairement constitués de cations et d’anions : le sel est un cristal de chlorure de sodium (ions chlorure Cl- et sodium Na+).


2) Conduction électrique des solides ioniques. On réalise l’expérience suivante : Bloc de sel (chlorure de sodium)

Observation : Les cristaux de chlorure de sodium ne conduisent pas le courant électrique Interprétation: Dans le chlorure de sodium solide, les ions Na+ et Clne peuvent pas se déplacer car ils sont rigidement liés.

Conclusion: Dans un cristal ionique, les ions ne peuvent pas se déplacer. Un cristal ionique n’est donc pas un conducteur électrique.

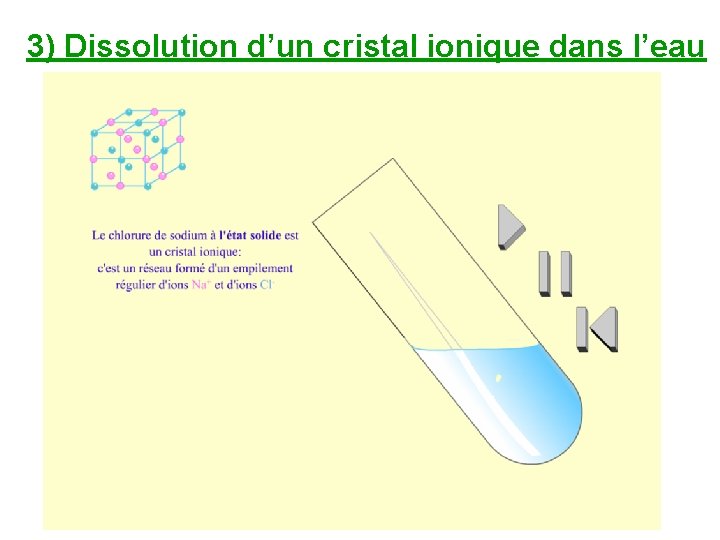
3) Dissolution d’un cristal ionique dans l’eau

Lorsque les cristaux ioniques sont au contact de l’eau, ils peuvent se dissoudre : les ions deviennent alors indépendants, libres de se déplacer et un courant électrique peut circuler.