Chapitre I Cancer de la prostate mtastatique hormonosensible

Chapitre I Cancer de la prostate métastatique hormonosensible Pr Karim Fizazi (Villejuif) Pr Christophe Hennequin (Paris) Dr François Rozet (Paris) Correspondances en Onco-Urologie La Lettre du Cancérologue

Déclaration publique de liens d’intérêts • Pr Karim Fizazi déclare avoir des liens d’intérêts avec Amgen, Astra. Zeneca Bayer, Janssen, Takeda, Sanofi, Essa, Genentech, Clovis • Pr Christophe Hennequin déclare avoir des liens d’intérêts avec Astellas, Bouchara-Recordati, Ipsen, Janssen, Pfizer, Roche, Sanofi • Dr François Rozet déclare avoir des liens d’intérêts avec Amgen, Astellas, Bouchara-Recordati, Ferring, Ipsen, Janssen, Sanofi Correspondances en Onco-Urologie La Lettre du Cancérologue 1

Cas clinique 1 - CPHSm Cas clinique (1) • M. Paul H…, âgé de 65 ans, en bon état général • Toujours en activité, employé de bureau, non fumeur • Comorbidités : embonpoint (95 kg pour 1, 82 m), hypothyroïdie traitée • Aucune activité physique • En décembre 2016, PSA systématique à 10 ng/ml • Examen clinique : nodule prostatique droit • Biopsies prostatiques : adénocarcinome prostatique, score de Gleason 8 (4+4), 8/15 carottes positives Correspondances en Onco-Urologie La Lettre du Cancérologue 2
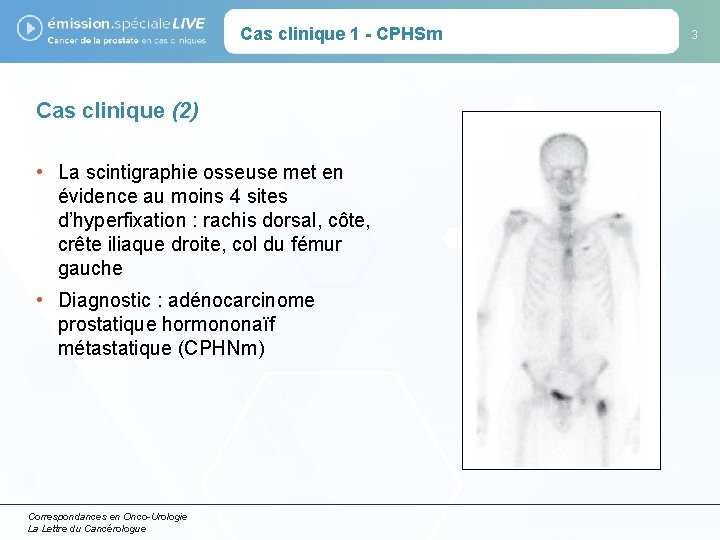
Cas clinique 1 - CPHSm Cas clinique (2) • La scintigraphie osseuse met en évidence au moins 4 sites d’hyperfixation : rachis dorsal, côte, crête iliaque droite, col du fémur gauche • Diagnostic : adénocarcinome prostatique hormononaïf métastatique (CPHNm) Correspondances en Onco-Urologie La Lettre du Cancérologue 3

Cas clinique 1 - CPHSm CPHNm : castration (SA) + chimiothérapie • Trois essais cliniques : – SSP : résultats en faveur de l’association SA + docétaxel/prednisone versus SA seule – SG • GETUG-AFU 15 : 385 patients (Gravis et al. , Eur Urol 2016) – SG : 62, 1 mois (SA + CT) versus 48, 6 mois ; HR = 0, 88 ; IC 95 : 0, 68 -1, 14 ; p = 0, 3 • CHAARTED : 790 patients (Kyriakopoulos et al. , JCO 2018) – SG : 57, 6 mois versus 47, 2 mois ; HR = 0, 72 ; IC 95 : 0, 59 -0, 89 ; p = 0, 0018 • STAMPEDE : 2 962 patients (James et al. , Lancet 2016) – SG : 81 mois (SA + CT) versus 71 mois (SA) ; p = 0, 006 ; HR = 0, 78 ; M 1 : HR = 0, 76 (0, 62 -0, 93) » Effet favorable similaire M 0 versus M 1 (mais moins d’événements, de décès M 0) Correspondances en Onco-Urologie La Lettre du Cancérologue 4

Cas clinique 1 - CPHSm 5 Méta-analyse de Vale et al. : confirmation du bénéfice de l’association SA + chimiothérapie Survie globale CHAARTED GETUG-15 STAMPEDE (SOC ± Doc) STAMPEDE (SOC + ZA ± Doc) Tous Contrôles 136/393 NA/193 350/724 170/366 HR (IC 95) 0, 61 (0, 47 -0, 80) 0, 90 (0, 69 -1, 81) 0, 76 (0, 62 -0, 93) 0, 85 (0, 65 -1, 10) 0, 77 (0, 68 -0, 87) Traitement 101/397 NA/192 144/362 158/365 Hétérogénéité : χ2 = 4, 80 ; df = 3 ; p = 0, 187 ; I 2 = 37, 5 % 0, 5 1 2 Survie sans échec au traitement CHAARTED GETUG-15 STAMPEDE (SOC ± Doc) STAMPEDE (SOC + ZA ± Doc) Tous Contrôles NA/393 158/193 585/724 286/366 Traitement NA/397 143/192 252/362 255/365 HR (IC 95) 0, 61 (0, 51 -0, 73) 0, 70 (0, 57 -0, 86) 0, 61 (0, 53 -0, 71) 0, 67 (0, 55 -0, 82) 0, 64 (0, 58 -0, 70) Hétérogénéité : χ2 = 1, 66 ; df = 3 ; p = 0, 646 ; I 2 = 0 % 0, 5 SOC : standard of care. Correspondances en Onco-Urologie La Lettre du Cancérologue En faveur de SOC + docétaxel 1 2 En faveur de SOC Vale CL et al. , Lancet Oncol 2016
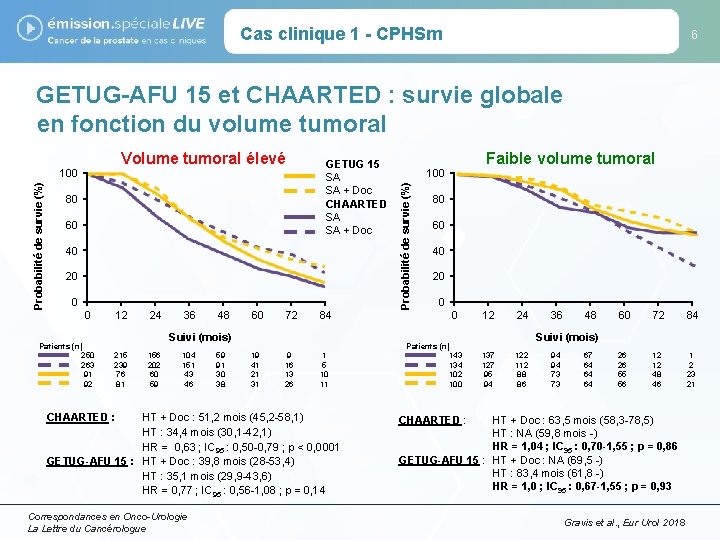
Cas clinique 1 - CPHSm 6 GETUG-AFU 15 et CHAARTED : survie globale en fonction du volume tumoral Probabilité de survie (%) 80 60 GETUG 15 SA SA + Doc CHAARTED SA SA + Doc 40 20 0 0 Patients (n) 250 263 91 92 12 24 36 48 60 72 84 Suivi (mois) 215 239 76 81 156 202 60 59 104 151 43 46 CHAARTED : 59 91 30 38 19 41 21 31 9 16 13 26 1 5 10 11 HT + Doc : 51, 2 mois (45, 2 -58, 1) HT : 34, 4 mois (30, 1 -42, 1) HR = 0, 63 ; IC 95 : 0, 50 -0, 79 ; p < 0, 0001 GETUG-AFU 15 : HT + Doc : 39, 8 mois (28 -53, 4) HT : 35, 1 mois (29, 9 -43, 6) HR = 0, 77 ; IC 95 : 0, 56 -1, 08 ; p = 0, 14 Correspondances en Onco-Urologie La Lettre du Cancérologue Faible volume tumoral 100 Probabilité de survie (%) Volume tumoral élevé 100 80 60 40 20 0 0 Patients (n) 143 134 102 100 12 24 36 48 60 72 84 26 26 55 56 12 12 48 46 1 2 23 21 Suivi (mois) 137 127 95 94 122 112 88 86 94 94 73 73 67 64 64 64 CHAARTED : HT + Doc : 63, 5 mois (58, 3 -78, 5) HT : NA (59, 8 mois -) HR = 1, 04 ; IC 95 : 0, 70 -1, 55 ; p = 0, 86 GETUG-AFU 15 : HT + Doc : NA (69, 5 -) HT : 83, 4 mois (61, 8 -) HR = 1, 0 ; IC 95 : 0, 67 -1, 55 ; p = 0, 93 Gravis et al. , Eur Urol 2018
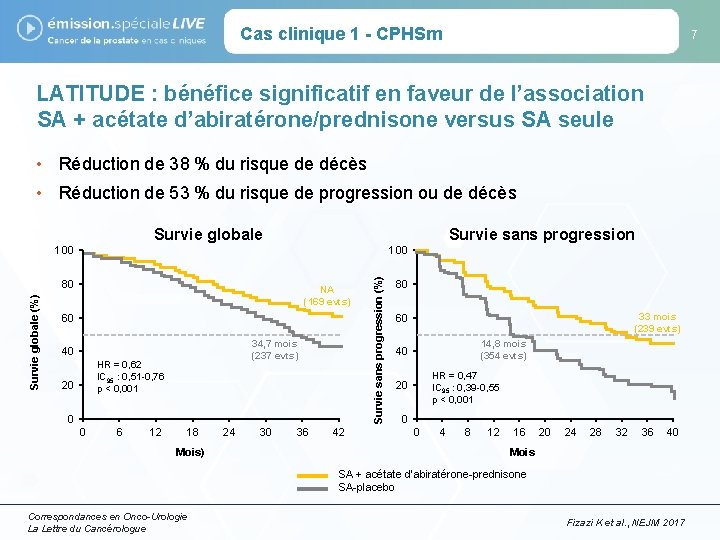
Cas clinique 1 - CPHSm 7 LATITUDE : bénéfice significatif en faveur de l’association SA + acétate d’abiratérone/prednisone versus SA seule • Réduction de 38 % du risque de décès • Réduction de 53 % du risque de progression ou de décès Survie globale Survie sans progression 100 Survie globale (%) 80 NA (169 evts) 60 34, 7 mois (237 evts) 40 HR = 0, 62 IC 95 : 0, 51 -0, 76 p < 0, 001 20 0 0 6 12 18 Mois) 24 30 36 42 Survie sans progression (%) 100 80 33 mois (239 evts) 60 14, 8 mois (354 evts) 40 HR = 0, 47 IC 95 : 0, 39 -0, 55 p < 0, 001 20 0 0 4 8 12 16 20 24 28 32 36 40 Mois SA + acétate d’abiratérone-prednisone SA-placebo Correspondances en Onco-Urologie La Lettre du Cancérologue Fizazi K et al. , NEJM 2017
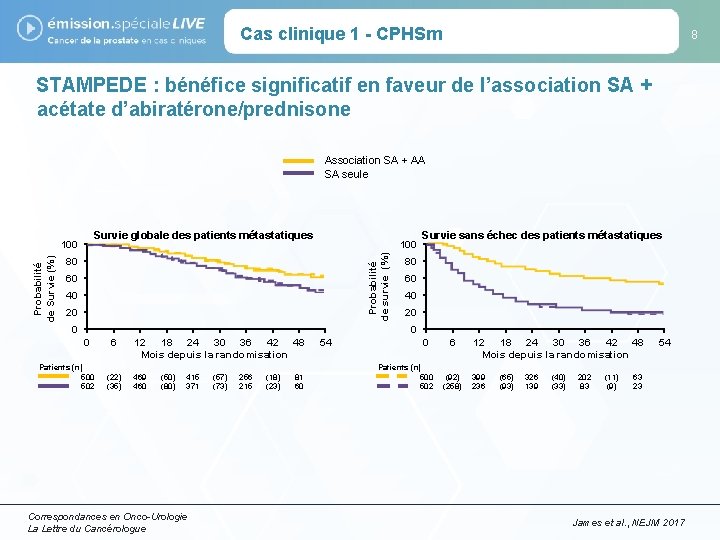
Cas clinique 1 - CPHSm 8 STAMPEDE : bénéfice significatif en faveur de l’association SA + acétate d’abiratérone/prednisone Association SA + AA SA seule Survie globale des patients métastatiques 100 Probabilité de survie (%) Probabilité de Survie (%) 100 80 60 40 20 0 0 Patients (n) 500 502 6 (22) (35) 12 18 24 30 36 42 48 Mois depuis la randomisation 469 460 (50) (80) 415 371 Correspondances en Onco-Urologie La Lettre du Cancérologue (57) (73) 256 215 (18) (23) 81 60 54 Survie sans échec des patients métastatiques 80 60 40 20 0 0 Patients (n) 500 502 6 (92) (258) 12 18 24 30 36 42 48 Mois depuis la randomisation 399 236 (65) (93) 326 139 (40) (33) 202 83 (11) (9) 54 63 23 James et al. , NEJM 2017
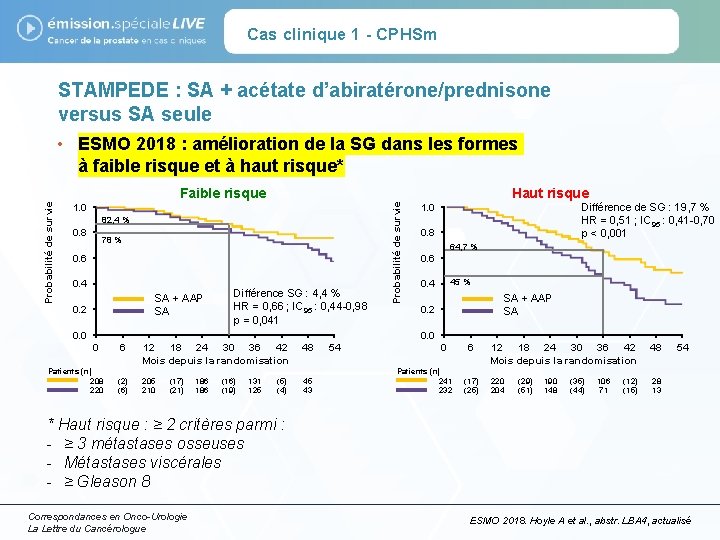
Cas clinique 1 - CPHSm STAMPEDE : SA + acétate d’abiratérone/prednisone versus SA seule Faible risque 1. 0 82, 4 % 0. 8 78 % 0. 6 0. 4 SA + AAP SA 0. 2 Différence SG : 4, 4 % HR = 0, 66 ; IC 95 : 0, 44 -0, 98 p = 0, 041 0. 0 Probabilité de survie • ESMO 2018 : amélioration de la SG dans les formes à faible risque et à haut risque* Haut risque Différence de SG : 19, 7 % HR = 0, 51 ; IC 95 : 0, 41 -0, 70 p < 0, 001 1. 0 0. 8 64, 7 % 0. 6 45 % 0. 4 SA + AAP SA 0. 2 0. 0 0 Patients (n) 208 220 6 12 18 24 30 36 42 Mois depuis la randomisation 48 (2) (6) 205 210 45 43 (17) (21) 186 (16) (19) 131 125 (5) (4) 54 0 Patients (n) 241 232 6 (17) (25) 12 18 24 30 36 42 Mois depuis la randomisation 48 220 204 28 13 (29) (51) 190 148 (35) (44) 106 71 (12) (15) 54 * Haut risque : ≥ 2 critères parmi : - ≥ 3 métastases osseuses - Métastases viscérales - ≥ Gleason 8 Correspondances en Onco-Urologie La Lettre du Cancérologue ESMO 2018. Hoyle A et al. , abstr. LBA 4, actualisé
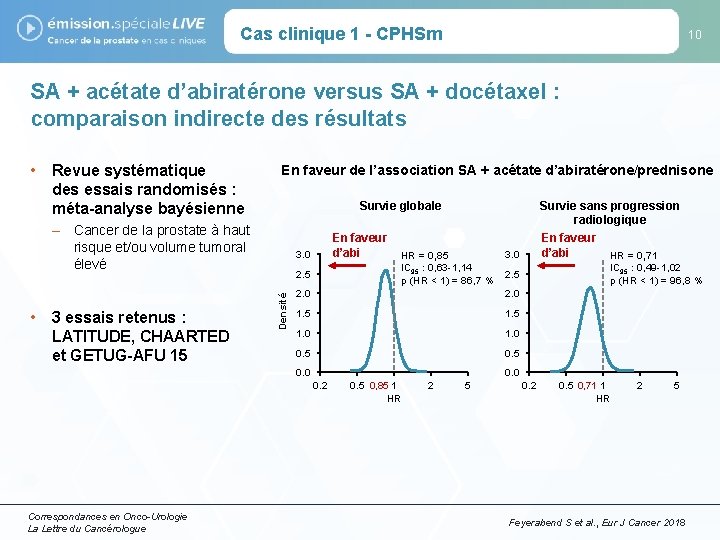
Cas clinique 1 - CPHSm 10 SA + acétate d’abiratérone versus SA + docétaxel : comparaison indirecte des résultats • Revue systématique des essais randomisés : méta-analyse bayésienne En faveur de l’association SA + acétate d’abiratérone/prednisone Survie globale – Cancer de la prostate à haut risque et/ou volume tumoral élevé 3. 0 IC 95 : 0, 63 -1, 14 p (HR < 1) = 86, 7 % 2. 5 Densité • 3 essais retenus : LATITUDE, CHAARTED et GETUG-AFU 15 En faveur d’abi HR = 0, 85 IC 95 : 0, 49 -1, 02 p (HR < 1) = 96, 8 % 2. 5 2. 0 1. 5 1. 0 0. 5 0. 0 0. 2 Correspondances en Onco-Urologie La Lettre du Cancérologue Survie sans progression radiologique En faveur d’abi HR = 0, 71 0. 5 0, 85 1 HR 2 5 0. 2 0. 5 0, 71 1 HR 2 5 Feyerabend S et al. , Eur J Cancer 2018
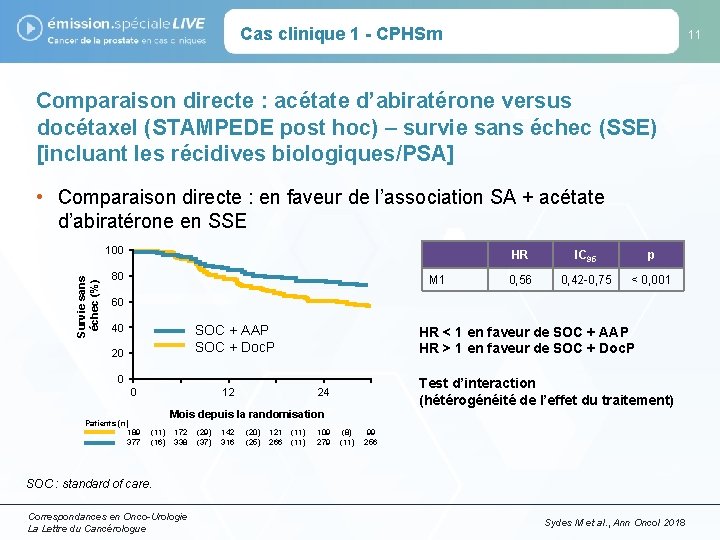
Cas clinique 1 - CPHSm 11 Comparaison directe : acétate d’abiratérone versus docétaxel (STAMPEDE post hoc) – survie sans échec (SSE) [incluant les récidives biologiques/PSA] • Comparaison directe : en faveur de l’association SA + acétate d’abiratérone en SSE Survie sans échec (%) 100 80 M 1 HR IC 95 p 0, 56 0, 42 -0, 75 < 0, 001 60 40 SOC + AAP SOC + Doc. P 20 HR < 1 en faveur de SOC + AAP HR > 1 en faveur de SOC + Doc. P 0 0 Patients (n) 189 377 12 Test d’interaction (hétérogénéité de l’effet du traitement) 24 Mois depuis la randomisation (11) (16) 172 338 (29) (37) 142 316 (20) (25) 121 266 (11) 109 279 (8) (11) 99 256 SOC : standard of care. Correspondances en Onco-Urologie La Lettre du Cancérologue Sydes M et al. , Ann Oncol 2018
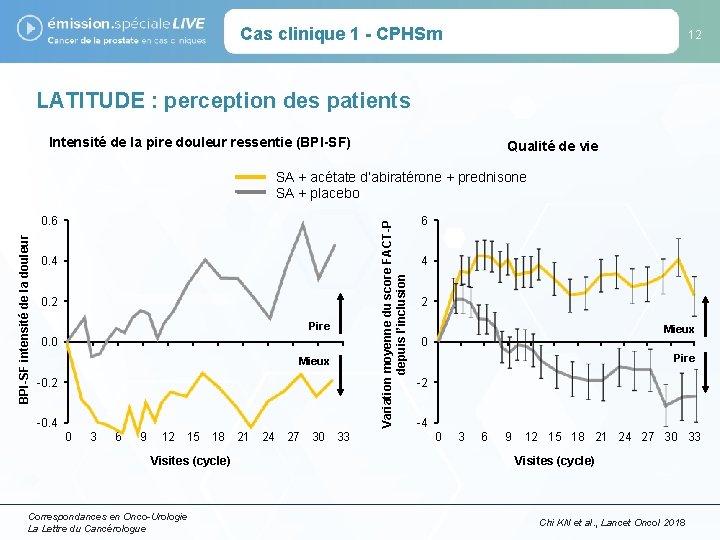
Cas clinique 1 - CPHSm 12 LATITUDE : perception des patients Intensité de la pire douleur ressentie (BPI-SF) Qualité de vie BPI-SF intensité de la douleur 0. 6 0. 4 0. 2 Pire 0. 0 Mieux -0. 2 -0. 4 0 3 6 9 12 15 18 21 24 27 30 33 Visites (cycle) Correspondances en Onco-Urologie La Lettre du Cancérologue Variation moyenne du score FACT-P depuis l’inclusion SA + acétate d’abiratérone + prednisone SA + placebo 6 4 2 Mieux 0 Pire -2 -4 0 3 6 9 12 15 18 21 24 27 30 33 Visites (cycle) Chi KN et al. , Lancet Oncol 2018

Cas clinique 1 - CPHSm ESMO 2018 : résultats en faveur d’un traitement local de la tumeur primitive • Jusque-là, arguments indirects en faveur d’un traitement local de la tumeur primitive, mais pas d’études randomisées • Essai HORRAD (AUA 2018) : résultats négatifs • Nouveau ! ESMO 2018 : STAMPEDE Correspondances en Onco-Urologie La Lettre du Cancérologue Widmark, 2009 ; Warde, 2011 ; Rusthaven, JCO 2016 ; Cho, PLo. S One 2016 ; Boevé LMS, Eur Urol 2018 13

Cas clinique 1 - CPHSm STAMPEDE : Ca. P métastatique récemment diagnostiqué Intérêt d’une radiothérapie de la tumeur primitive (1) Cancer de la prostate métastatique nouvellement diagnostiqué SA ± docétaxel (SOC) Critère principal survie globale Population : 2 061 patients inclus 1: 1 SA ± docétaxel (SOC) + radiothérapie de la prostate 36 Gy/6 fr/6 sem. ou 55 Gy/20 fr/4 sem. Schéma déterminé avant la randomisation Facteurs de stratification ge (< 70 versus > 70 ans), envahissement ganglionnaire (N 0 versus N 1 versus Nx), site de randomisation, WHO performance status (0 versus 1 ou 2), type de SA, utilisation d’aspirine ou d’AINS, traitement par docétaxel Correspondances en Onco-Urologie La Lettre du Cancérologue ESMO 2018. Parker CC et al. , abstr. LBA 5, actualisé
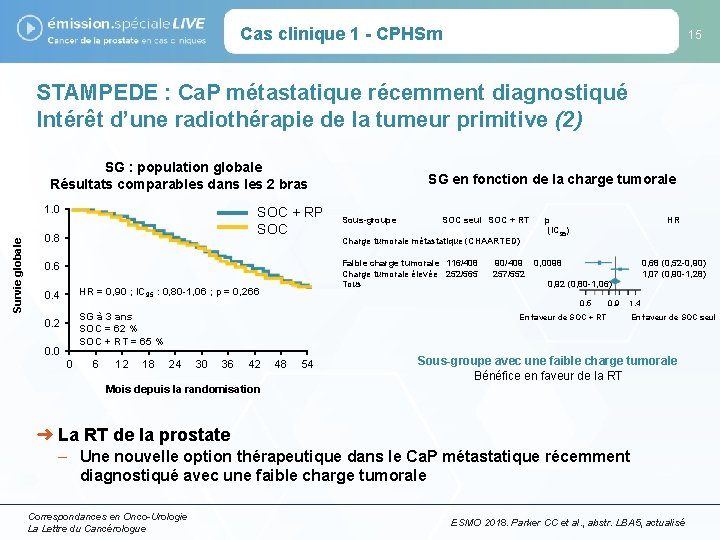
Cas clinique 1 - CPHSm 15 STAMPEDE : Ca. P métastatique récemment diagnostiqué Intérêt d’une radiothérapie de la tumeur primitive (2) SG : population globale Résultats comparables dans les 2 bras Survie globale 1. 0 SOC + RP SOC 0. 8 Sous-groupe SOC seul SOC + RT Charge tumorale métastatique (CHAARTED) Faible charge tumorale 116/408 Charge tumorale élevée 252/565 Tous 0. 6 HR = 0, 90 ; IC 95 : 0, 80 -1, 06 ; p = 0, 266 0. 4 SG en fonction de la charge tumorale p (IC 95) HR 90/409 0, 0098 257/552 0, 92 (0, 80 -1, 06) 0, 5 SG à 3 ans SOC = 62 % SOC + RT = 65 % 0. 2 0. 0 0 6 12 18 En faveur de SOC + RT 24 30 36 42 48 54 0, 9 0, 68 (0, 52 -0, 90) 1, 07 (0, 90 -1, 28) 1, 4 En faveur de SOC seul Sous-groupe avec une faible charge tumorale Bénéfice en faveur de la RT Mois depuis la randomisation ➜ La RT de la prostate – Une nouvelle option thérapeutique dans le Ca. P métastatique récemment diagnostiqué avec une faible charge tumorale Correspondances en Onco-Urologie La Lettre du Cancérologue ESMO 2018. Parker CC et al. , abstr. LBA 5, actualisé
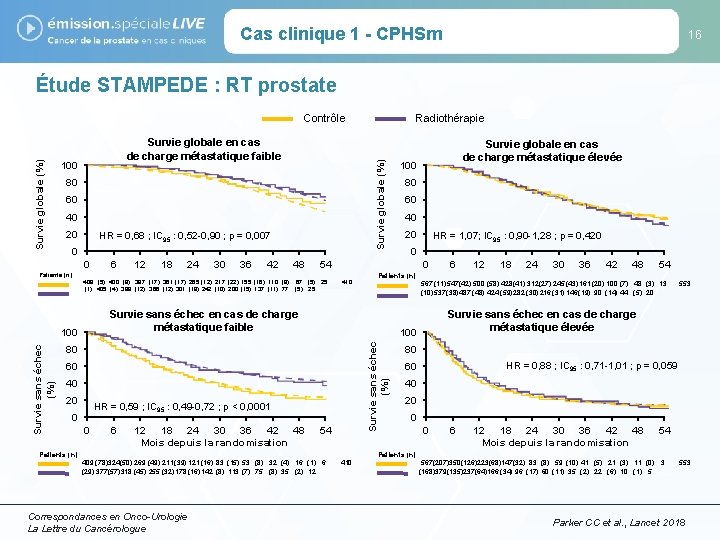
Cas clinique 1 - CPHSm 16 Étude STAMPEDE : RT prostate Survie globale en cas de charge métastatique faible 100 80 60 40 20 HR = 0, 68 ; IC 95 : 0, 52 -0, 90 ; p = 0, 007 0 0 6 12 18 24 30 36 42 48 410 40 HR = 0, 59 ; IC 95 : 0, 49 -0, 72 ; p < 0, 0001 0 6 12 18 24 30 36 42 48 Mois depuis la randomisation 40 20 HR = 1, 07; IC 95 : 0, 90 -1, 28 ; p = 0, 420 0 54 Patients (n) 6 12 18 24 30 36 42 48 54 567 (11)547(42) 500 (58) 428(41) 312(27) 245 (43)161 (20) 100 (7) 48 (3) 13 (10) 537(38)487 (48) 424 (59)282 (30) 216 (31) 146(19) 90 (14) 44 (5) 20 Survie sans échec (%) 60 0 80 20 80 Patients (n) Survie sans échec en cas de charge métastatique faible 100 Survie sans échec (%) 67 (5) 25 Survie globale en cas de charge métastatique élevée 100 54 Patients (n) 409 (5) 400 (9) 387 (17) 361 (17) 265 (12) 217 (22) 155 (16) 110 (8) (1) 405 (4) 399 (12) 366 (12) 301 (19) 242 (10) 200 (15) 137 (11) 77 Radiothérapie Survie globale (%) Contrôle 553 Survie sans échec en cas de charge métastatique élevée 100 80 HR = 0, 88 ; IC 95 : 0, 71 -1, 01 ; p = 0, 059 60 40 20 0 0 6 12 18 24 30 36 42 48 Mois depuis la randomisation 54 Patients (n) 409 (78)324(50) 269 (49) 211(39) 121(16) 83 (15) 53 (8) 32 (4) 16 (1) 6 (29) 377(57)318 (45) 255 (32)178 (16) 142 (8) 113 (7) 75 (8) 35 (2) 12 Correspondances en Onco-Urologie La Lettre du Cancérologue 410 567(207)350(126)223(68)147(32) 83 (8) 59 (10) 41 (5) 21 (3) 11 (0) 3 (168)379(135)237(64)166 (34) 96 (17) 60 (11) 35 (2) 22 (6) 10 (1) 5 553 Parker CC et al. , Lancet 2018
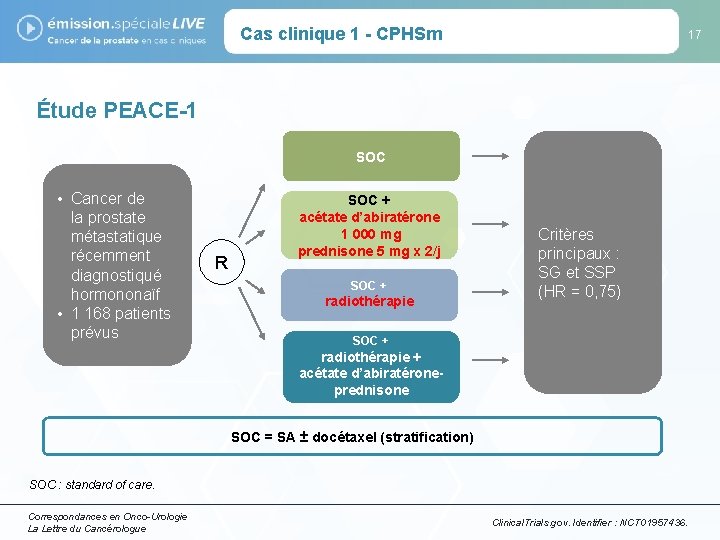
Cas clinique 1 - CPHSm 17 Étude PEACE-1 SOC • Cancer de la prostate métastatique récemment diagnostiqué hormononaïf • 1 168 patients prévus R SOC + acétate d’abiratérone 1 000 mg prednisone 5 mg x 2/j SOC + radiothérapie Critères principaux : SG et SSP (HR = 0, 75) SOC + radiothérapie + acétate d’abiratéroneprednisone SOC = SA ± docétaxel (stratification) SOC : standard of care. Correspondances en Onco-Urologie La Lettre du Cancérologue Clinical. Trials. gov. Identifier : NCT 01957436.

Cas clinique 1 - CPHSm Conclusion : pour la pratique • CPHSm : 2 modalités de traitement – SA + acétate d’abiratérone (haut risque mais aussi bas risque : AMM ? Remboursement ? ) – SA + docétaxel • Pas de zolédronate à doses “antimétastatiques” à ce stade de la maladie • Traitement local du primitif par RT si cancer de la prostate oligométastatique • PEACE-6 : le futur Correspondances en Onco-Urologie La Lettre du Cancérologue 18

Cas clinique 1 - CPHSm • Question 1. L’intérêt d’associer RT locale et docétaxel a été démontré dans l’étude STAMPEDE (ESMO 2018), peut-on également associer RT et acétate d’abiratérone ? • Réponse – Peu de données avec l’acétate d’abiratérone en dehors de quelques études de phase I/II – En attente des résultats de PEACE-1 – Étude ERA-223 (radium-223 seul ou associé à l’acétate d’abiratérone) : résultats négatifs • Pour la pratique • Prudence : ne pas associer pour l’instant RT et acétate d’abiratérone en l’absence de résultats d’étude de phase III Correspondances en Onco-Urologie La Lettre du Cancérologue Parker CC et al. , Lancet 2018. https: //clinicaltrials. gov/ct 2/show/NCT 02043678
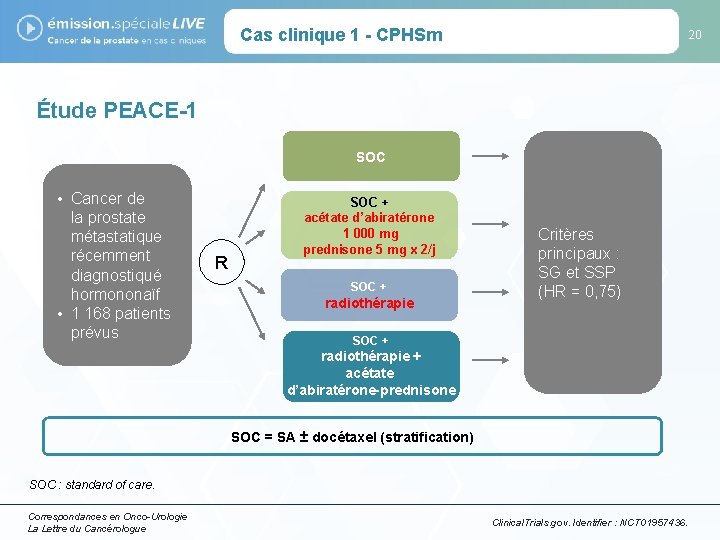
Cas clinique 1 - CPHSm 20 Étude PEACE-1 SOC • Cancer de la prostate métastatique récemment diagnostiqué hormononaïf • 1 168 patients prévus R SOC + acétate d’abiratérone 1 000 mg prednisone 5 mg x 2/j SOC + radiothérapie Critères principaux : SG et SSP (HR = 0, 75) SOC + radiothérapie + acétate d’abiratérone-prednisone SOC = SA ± docétaxel (stratification) SOC : standard of care. Correspondances en Onco-Urologie La Lettre du Cancérologue Clinical. Trials. gov. Identifier : NCT 01957436.

Cas clinique 1 - CPHSm • Question 2. Cancer de la prostate métastatique : résultats de STAMPEDE considérés en faveur d’une RT de la tumeur primitive alors que les résultats sur le critère principal sont négatifs ? • Réponse – Les résultats sont négatifs sur le critère principal dans la population globale • Mais positifs dans le sous-groupe des patients ayant une faible masse tumorale avec un bénéfice sur la survie sans récidive et sur la survie globale • Étude de sous-groupes réalisée a posteriori avec une revue des données des scintigraphies osseuses pour définir le degré de masse tumorale (selon les critères de CHAARTED) – Étude d’envergure avec plus de 2 000 patients inclus – Des résultats comparables dans d’autres pathologies – Des données qui représentent malgré tout une actualité • Pour la pratique – Même s’il ne s’agit pas d’un standard thérapeutique, nouvelle option thérapeutique qui doit être systématiquement discutée en RCP au cas par cas Correspondances en Onco-Urologie La Lettre du Cancérologue Parker CC et al. , Lancet 2018

Cas clinique 1 - CPHSm • Question 3. Quelle est la place de la chirurgie dans la prise en charge de ce patient (cas clinique) ? Quelles modalités de surveillance pour ces patients ? • Réponse – Cela pose la question du traitement de la tumeur primitive • RT : données de STAMPEDE • Chirurgie : pas ou peu de données (essais en cours) • Pour la pratique • Chirurgie uniquement dans le cadre d’un essai thérapeutique Correspondances en Onco-Urologie La Lettre du Cancérologue Parker CC et al. , Lancet 2018

Cas clinique 1 - CPHSm • Question 4. Cancer de la prostate métastatique et RT de la tumeur primitive : quelles modalités de surveillance ? • Réponse – Question complexe : pas de recommandations et peu ou pas de données • Pour la pratique • Répéter régulièrement les examens d’imagerie (scintigraphie osseuse, scanner), même en l’absence de progression biologique • Surveillance métabolique (traitements systémiques dont hormonothérapie) : obésité, diabète, HTA et autres facteurs de risque cardiovasculaire Correspondances en Onco-Urologie La Lettre du Cancérologue Rozet F et al. , Pro Urol 2016

Cas clinique 1 - CPHSm • Question 5. Les radiothérapies proposées dans STAMPEDE sont-elles un standard ? • Réponse – STAMPEDE : 2 schémas thérapeutiques (schémas anglais proches des standards) • Un schéma 6× 6 Gy (36 Gy en stéréotaxie) • Un schéma hypofractionné modéré (55 Gy/20 fr/4 sem. ) • Pour la pratique • Objectif de l’irradiation prostatique : inhiber la progression locale (prostate : premier site de résistance à la castration) • Essai du GETUG (à venir) chez les patients oligométastatiques : RT prostatique + traitement systémique ± irradiation des métastases Correspondances en Onco-Urologie La Lettre du Cancérologue Parker CC et al. , Lancet 2018

Cas clinique 1 - CPHSm • Question 6. Quelle définition des groupes pronostiques (formes oligométastatiques de volume faible/élevé, de risque faible/élevé) • Réponse – Faible/haut volume tumoral (CHAARTED) : définition anatomique • Métastases viscérales • Nombre de métastases osseuses (≥ 4 ou < 4) • Localisation des métastases osseuses (≥ 1 ou < 1 extra-axiale) – Risque faible/élevé (LATITUDE) : < 2 ou ≥ 2 facteurs de gravité • ≥ 3 métastases osseuses • Métastases viscérales • Gleason ≥ 8 • Pour la pratique : – 2 contextes différents : • Maladie oligométastatique avec 1 à 3 métastases osseuses + Gleason intermédiaire • Maladie très métastatique + Gleason élevé Correspondances en Onco-Urologie La Lettre du Cancérologue Kyriakopoulos et al. , JCO 2018 ; Fizazi K et al. , NEJM 2017

Chapitre II Cancer de la prostate résistant à la castration non métastatique Pr Karim Fizazi (Villejuif) Pr Christophe Hennequin (Paris) Dr François Rozet (Paris) Correspondances en Onco-Urologie La Lettre du Cancérologue

Déclaration publique de liens d’intérêts • Pr Karim Fizazi déclare avoir des liens d’intérêts avec Amgen, Astra. Zeneca Bayer, Janssen, Takeda, Sanofi, Essa, Genentech, Clovis • Pr Christophe Hennequin déclare avoir des liens d’intérêts avec Astellas, Bouchara-Recordati, Ipsen, Janssen, Pfizer, Roche, Sanofi • Dr François Rozet déclare avoir des liens d’intérêts avec Amgen, Astellas, Bouchara-Recordati, Ferring, Ipsen, Janssen, Sanofi Correspondances en Onco-Urologie La Lettre du Cancérologue 27

Cas clinique 2 - CPRCnm 28 Cas clinique • M. Laurent F…, âgé de 69 ans, a été opéré d’un cancer de la prostate en février 2013 – Adénocarcinome ; Gleason 3+4 ; c. T 1 c ; PSA préopératoire : 5, 4 ng/ml – PSA post-prostatectomie : 0, 3 ng/ml • Élévation confirmée du PSA en janvier 2014 : radiothérapie de rattrapage • En avril 2015 : PSA à 3 ng/ml, temps de doublement du PSA : 9 mois – Traitement par agoniste de la LH-RH : intermittent (6 mois), puis continu (1 an) • Octobre 2016 : réascension du PSA (5 ng/ml) ; scintigraphie osseuse et scanner normaux – Diagnostic de CPRCnm chez ce patient très anxieux Correspondances en Onco-Urologie La Lettre du Cancérologue Mateo J et al. , Eur Urol 2018

Cas clinique 2 - CPRCnm Définition de la résistance à la castration • CPRC : progression biochimique (PSA), radiologique et clinique en présence d’un faible taux de testostérone (< 0, 5 ng/ml) • CPRCnm : progression biochimique (PSA) et absence de métastases détectables – Testostérone < 50 ng/dl (taux de castration) – Plusieurs définitions de la progression biochimique • PCWG 2 • PSA ≥ 1 ng/ml • Élévation du PSA > 2 ng/ml au-dessus du nadir et taux ≥ 25 % du nadir • Élévation confirmée après ≥ 3 semaines par un 2 e dosage • EAU : • 3 élévations consécutives du PSA à 1 semaine d’intervalle • Avec 2 augmentations du PSA > 50 % au-dessus du nadir et un PSA > 2 ng/ml Correspondances en Onco-Urologie La Lettre du Cancérologue Hong JH, Kim IY. Korean J Urol 2014; 55(3): 153 -60. Scher HI et al. J Clin Oncol 2008; 26(7): 1148 -59. Mottet N et al. 2017. EAU-ESTRO- ESUR-SIOG Guidelines on Prostate Cancer. Disponible sur : http: //uroweb. org/guideline/prostate-cancer/ 29

Cas clinique 2 - CPRCnm 30 CPRC non métastatique : différentes situations Cancer de la prostate localisé ou localement avancé • Ca. P localisé : traitement local à visée curative puis récidive biologique (PSA) – SA ± autres traitements • Élévation isolée du PSA sous SA sans métastases identifiées • Ca. P localisé : patients non éligibles au traitement curatif – SA ± autres traitements • Élévation du PSA sans métastases à distance • Ca. P localement avancé – Radiohormonothérapie • Élévation isolée du PSA sous SA (pas de métastases détectées) Correspondances en Onco-Urologie La Lettre du Cancérologue Mateo J et al. , Eur Urol 2018

Cas clinique 2 - CPRCnm 31 Quel bilan complémentaire chez ce patient atteint d’un CPRCnm ? • Objectif : détection des métastases • Scintigraphie osseuse et scanner • Apport des nouvelles techniques d’imagerie : – IRMmp et IRM corps entier – PET-11 C-choline – PET-68 Ga-PSMA Correspondances en Onco-Urologie La Lettre du Cancérologue Mateo et al. , Eur Urol 2018

Cas clinique 2 - CPRCnm 32 Pourquoi traiter les CPRCnm ? • Déjà résistants à la castration et présence déjà fréquente de micrométastases • Survie sans métastases : 25 -30 mois • Identifier des facteurs de risque de progression métastatique : – PSA initial > 10 ng/ml – Doublement du taux de PSA (PSADT) : < 10 mois Association survie sans métastases, SG • Objectifs – Retarder la progression de la maladie et l’apparition de métastases – Si possible retarder les symptômes et le décès – Prendre en charge l’anxiété des patients face à une élévation du PSA Correspondances en Onco-Urologie La Lettre du Cancérologue Loriot Y et al. , Cancer Treat Rev 2018. Smith MR et al. , JCO 2013

Cas clinique 2 - CPRCnm 33 CPRCnm : encore peu d’options thérapeutiques • Traitement local de la tumeur primitive (RT, PT, cryothérapie) : – à envisager si rechute locale identifiée, peu de données dans cette situation • Impact significatif mais modeste du dénosumab sur la survie sans métastases • Poursuite de la SA • Résultats significatifs récents obtenus avec les HT de 2 e génération (apalutamide, enzalutamide) – STRIVE : étude de phase II randomisée en faveur de l’enzalutamide (versus bicalutamide) – 2 études de phase III • PROSPER • SPARTAN Correspondances en Onco-Urologie La Lettre du Cancérologue Loriot Y et al. , Cancer Treat Rev 2018
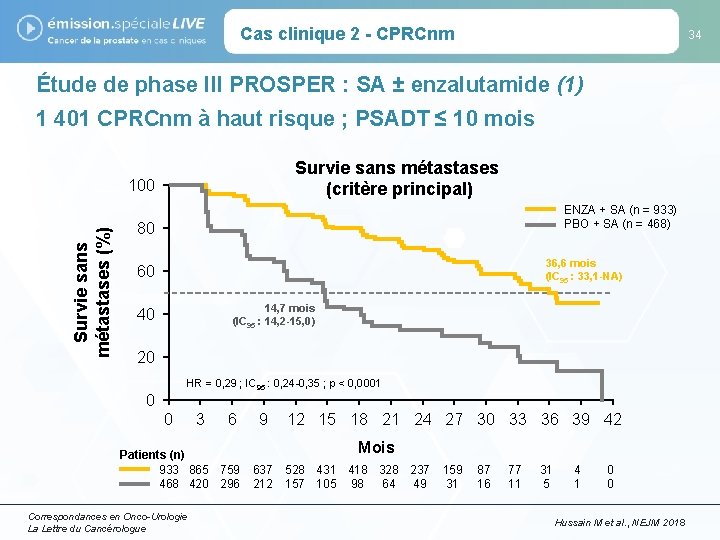
Cas clinique 2 - CPRCnm 34 Étude de phase III PROSPER : SA ± enzalutamide (1) 1 401 CPRCnm à haut risque ; PSADT ≤ 10 mois Survie sans métastases (critère principal) Survie sans métastases (%) 100 ENZA + SA (n = 933) PBO + SA (n = 468) 80 36, 6 mois (IC 95 : 33, 1 -NA) 60 14, 7 mois (IC 95 : 14, 2 -15, 0) 40 20 HR = 0, 29 ; IC 95 : 0, 24 -0, 35 ; p < 0, 0001 0 0 3 6 Patients (n) 933 865 759 468 420 296 Correspondances en Onco-Urologie La Lettre du Cancérologue 9 12 15 18 21 24 27 30 33 36 39 42 Mois 637 212 528 431 418 328 237 157 105 98 64 49 159 31 87 16 77 11 31 5 4 1 0 0 Hussain M et al. , NEJM 2018
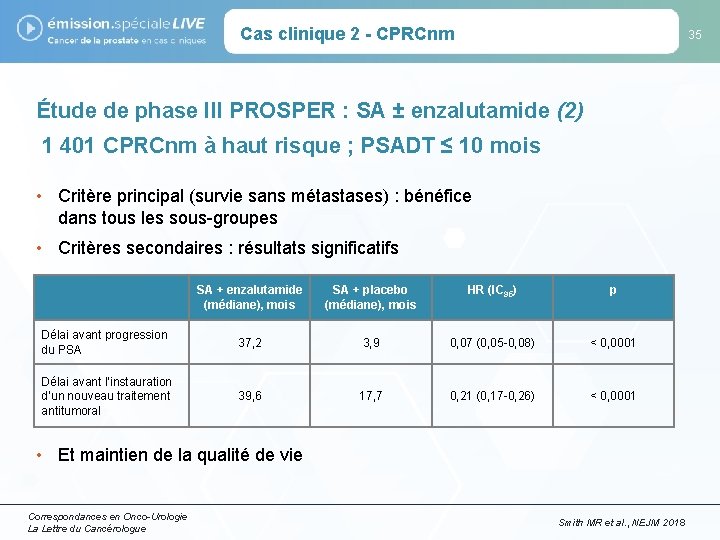
Cas clinique 2 - CPRCnm 35 Étude de phase III PROSPER : SA ± enzalutamide (2) 1 401 CPRCnm à haut risque ; PSADT ≤ 10 mois • Critère principal (survie sans métastases) : bénéfice dans tous les sous-groupes • Critères secondaires : résultats significatifs SA + enzalutamide (médiane), mois SA + placebo (médiane), mois HR (IC 95) p Délai avant progression du PSA 37, 2 3, 9 0, 07 (0, 05 -0, 08) < 0, 0001 Délai avant l’instauration d’un nouveau traitement antitumoral 39, 6 17, 7 0, 21 (0, 17 -0, 26) < 0, 0001 • Et maintien de la qualité de vie Correspondances en Onco-Urologie La Lettre du Cancérologue Smith MR et al. , NEJM 2018
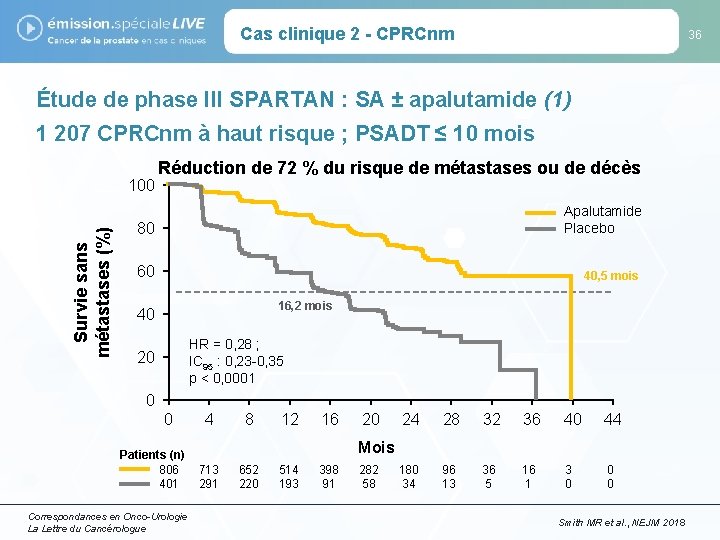
Cas clinique 2 - CPRCnm 36 Étude de phase III SPARTAN : SA ± apalutamide (1) 1 207 CPRCnm à haut risque ; PSADT ≤ 10 mois Survie sans métastases (%) 100 Réduction de 72 % du risque de métastases ou de décès 80 Apalutamide Placebo 60 40, 5 mois 16, 2 mois 40 HR = 0, 28 ; IC 95 : 0, 23 -0, 35 p < 0, 0001 20 0 0 Patients (n) 806 401 Correspondances en Onco-Urologie La Lettre du Cancérologue 4 8 12 16 20 24 28 32 36 40 44 180 34 96 13 36 5 16 1 3 0 0 0 Mois 713 291 652 220 514 193 398 91 282 58 Smith MR et al. , NEJM 2018
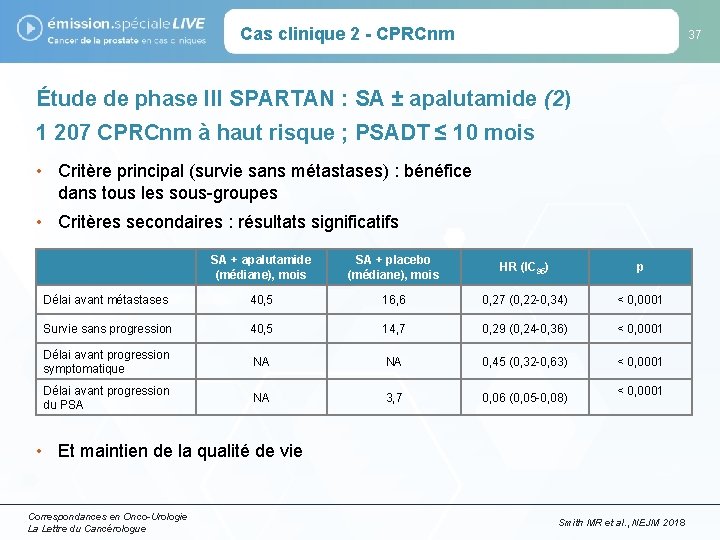
Cas clinique 2 - CPRCnm 37 Étude de phase III SPARTAN : SA ± apalutamide (2) 1 207 CPRCnm à haut risque ; PSADT ≤ 10 mois • Critère principal (survie sans métastases) : bénéfice dans tous les sous-groupes • Critères secondaires : résultats significatifs SA + apalutamide (médiane), mois SA + placebo (médiane), mois HR (IC 95) p Délai avant métastases 40, 5 16, 6 0, 27 (0, 22 -0, 34) < 0, 0001 Survie sans progression 40, 5 14, 7 0, 29 (0, 24 -0, 36) < 0, 0001 Délai avant progression symptomatique NA NA 0, 45 (0, 32 -0, 63) < 0, 0001 Délai avant progression du PSA NA 3, 7 0, 06 (0, 05 -0, 08) < 0, 0001 • Et maintien de la qualité de vie Correspondances en Onco-Urologie La Lettre du Cancérologue Smith MR et al. , NEJM 2018

Cas clinique 2 - CPRCnm Conclusion • CPRCnm : identifier les patients à haut risque (métastases, décès) : PSA, PSADT • Utilité des imageries de nouvelle génération ? • Peu d’alternatives thérapeutiques • Apalutamide et enzalutamide ont un effet net sur la SSM – ATU de cohorte (28 août 2018) pour l’apalutamide – Enzalutamide AMM européenne 30 octobre 2018 • Le mousquetaire arrive Correspondances en Onco-Urologie La Lettre du Cancérologue https: //www. ansm. sante. fr/Activites/Autorisations-temporaires-d-utilisation-ATU/ATU-de-cohorte-encours/Liste-des-ATU-de-cohorte-en-cours/APALUTAMIDE-60 -mg-comprime-pellicule 38

Cas clinique 2 – CPRCnm • Question 1. CPRCnm : en cas de TEP-choline ou de TEP- PSMA positive, quelle est la place des traitements focaux ? • Réponse – Ca. P oligométastatique résistant à la castration : peu de données sur les effets des traitements focaux (RT stéréotaxique) • STOMP : essai mené chez des patients oligométastatiques mais non résistants à la castration – Essai COMET (ASTRO 2018) : • RT stéréotaxique (métastases) versus RT palliative chez plus de 90 patients atteints d’un cancer oligométastatique (sein, poumon, côlon…) • Survie sans récidive en faveur de la RT stéréotaxique • Pour la pratique • Approche à réserver aux essais cliniques Correspondances en Onco-Urologie La Lettre du Cancérologue Decaestecker K et al. , BMC Cancer 2014 ; Palma et al. , ASTRO 2018

Cas clinique 2 – CPRCnm • Question 2. Pourquoi la SG n’était-elle pas l’objectif principal des études PROSPER et SPARTAN ? Quid du délai de survenue de métastases ? • Réponse – Critère principal : survie sans métastases plutôt que SG • Contexte de survie longue avec des décès imputables à d’autres causes que le Ca. P – Délai de survenue de métastases et SG • Association non étudiée de façon spécifique dans les CPRCnm • Mais corrélation significative démontrée dans les Ca. P localisés (plus de 100 essais cliniques analysés) Correspondances en Onco-Urologie La Lettre du Cancérologue Hussain M et al. , NEJM 2018 ; Smith MR et al. , NEJM 2018

Cas clinique 2 – CPRCnm • Question 3. CPRCnm : en cas de rechute biologique isolée, vaut-il mieux recher une cible ou instaurer un nouveau traitement systémique (NHT) ? • Réponse – Problématique de la prise en charge des formes oligométastatiques • Nouvelles techniques d’imagerie : métastases et/ou récidives locales • Traitements focaux et/ou traitement systémique ? Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 2 – CPRCnm • Question 4. CPRCnm : comment être certain de l’absence de récidive locale ? • Réponse – TEP-choline et PSMA et IRM +++ pour la détection des récidives locales – Biopsies envisagées si stratégie thérapeutique (retraitement local) influencée par les résultats Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 2 - CPRCnm • Question 5. CPRCnm : en cas de récidive locale, faut-il proposer un traitement local ou une HT de nouvelle génération ? • Réponse – Retraitement local versus HT de nouvelle génération : pas de données prospectives comparatives directes – Stratégie thérapeutique qui pourrait associer les 2 approches – Situation de résistance à la castration (maladie plus évoluée) : prise en compte de la morbidité potentielle d’un retraitement local Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 2 - CPRCnm • Question 6. Patient avec une TEP positive mais une scintigraphie osseuse et un scanner négatifs : candidat à un traitement par apalutamide ? • Réponse – Profil des patients inclus dans les essais PROSPER et SPARTAN (TEP non systématique) • Pour la pratique • Respect de l’AMM de l’enzalutamide et de l’apalutamide Correspondances en Onco-Urologie La Lettre du Cancérologue Hussain M et al. , NEJM 2018 ; Smith MR et al. , NEJM 2018

Cas clinique 2 - CPRCnm • Question 7. CPRCnm : quels traitements ultérieurs après enzalutamide/apalutamide ? • Réponse – Contexte de résistance aux hormonothérapies de 2 e génération et résistance croisée entre les différentes molécules – Pas de données spécifiques sur cette question – Résultats des études de phase III, COU-AA-302 et PREVAIL, qui suggèrent une activité de la chimiothérapie après progression sous HT de nouvelle génération Correspondances en Onco-Urologie La Lettre du Cancérologue Ryan CJ et al. , NEJM 2013 ; de Beer TM et al. , NEJM 2014

Cas clinique 2 - CPRCnm • Question 8. Quel seuil de temps de doublement du PSA (PSADT) pour réaliser une TEP-choline ? • Réponse – TEP-choline : imagerie de la récidive biologique • Objectifs : détection d’oligométastases • Indications : taux de PSA > 1 ng/ml ou un PSADT < 12 mois – TEP-PSMA : seuils de sensibilité plus bas Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 2 - CPRCnm • Question 9. CPRCnm : profil de tolérance des hormonothérapies de nouvelle génération ? • Réponse – Enzalutamide/apalutamide : profil de tolérance comparable à celui rapporté dans les formes métastatiques – Principaux événements indésirables : fatigue, troubles cognitifs, risque fracturaire – Possibilité d’adapter éventuellement le traitement Correspondances en Onco-Urologie La Lettre du Cancérologue Hussain M et al. , NEJM 2018 ; Smith MR et al. , NEJM 2018

Chapitre III Cancer de la prostate résistant à la castration métastatique Pr Karim Fizazi (Villejuif) Pr Christophe Hennequin (Paris) Dr François Rozet (Paris) Correspondances en Onco-Urologie La Lettre du Cancérologue

Déclaration publique de liens d’intérêts • Pr Karim Fizazi déclare avoir des liens d’intérêts avec Amgen, Astra. Zeneca Bayer, Janssen, Takeda, Sanofi, Essa, Genentech, Clovis • Pr Christophe Hennequin déclare avoir des liens d’intérêts avec Astellas, Bouchara-Recordati, Ipsen, Janssen, Pfizer, Roche, Sanofi • Dr François Rozet déclare avoir des liens d’intérêts avec Amgen, Astellas, Bouchara-Recordati, Ferring, Ipsen, Janssen, Sanofi Correspondances en Onco-Urologie La Lettre du Cancérologue 49

Cas clinique 3 - CPRCm Cas clinique • M. Philippe L…, âgé de 62 ans ; cancer de la prostate localement avancé diagnostiqué en mars 2016 (T 3 b ; Gleason 7 ; scintigraphie osseuse normale), PSA initial : 35 ng/ml – Radio-hormonothérapie (18 mois d’hormonothérapie prévus) • En janvier 2017, M. Philippe L…, toujours sous hormonothérapie, se plaint de douleurs au niveau du rachis. Un nouveau bilan indique une élévation du PSA au-dessus du nadir (+ 5 ng/ml) et plusieurs métastases osseuses sont identifiées à la scintigraphie osseuse (L 3, fémur, côtes) – Diagnostic de CPRCm Correspondances en Onco-Urologie La Lettre du Cancérologue 50

Cas clinique 3 - CPRCm 51 Définition d’une résistance à la castration Recommandations CCAFU-AFU • Taux de testostéronémie < 0, 50 ng/ml ou 1, 7 nmol/l sous suppression androgénique • Et • Critères de progression tumorale – Progression biochimique : • Élévation du taux de PSA > 50 % (confirmée à 3 reprises et à au moins 1 semaine d’intervalle) • Avec PSA > 2 ng/ml – Ou progression radiographique • ≥ 2 nouvelles lésions à la scintigraphie osseuse • et/ou progression d’une lésion mesurable selon les critères RECIST • Une progression symptomatique seule n’est pas suffisante Correspondances en Onco-Urologie La Lettre du Cancérologue Rozet F et al. , Prog Urol 2016

Cas clinique 3 - CPRCm : traitement de 1 re ligne (1) 1. Poursuite de la suppression androgénique, quelle que soit l’option thérapeutique envisagée 2. Pas d’impact démontré des hormonothérapies d’ancienne génération – Supériorité de l’enzalutamide versus bicalutamide (STRIVE et TERRAIN) 3. Cabazitaxel – Pas d’indication en 1 re ligne – Indiqué dans les formes de CPRCm re fractaires a l’hormonothe rapie et déjà traite es par docétaxel Correspondances en Onco-Urologie La Lettre du Cancérologue Rozet F et al. , Prog Urol 2016 ; Penson DF et al. , JCO 2016 ; Shore ND et al. , Lancet Oncol 2016 52
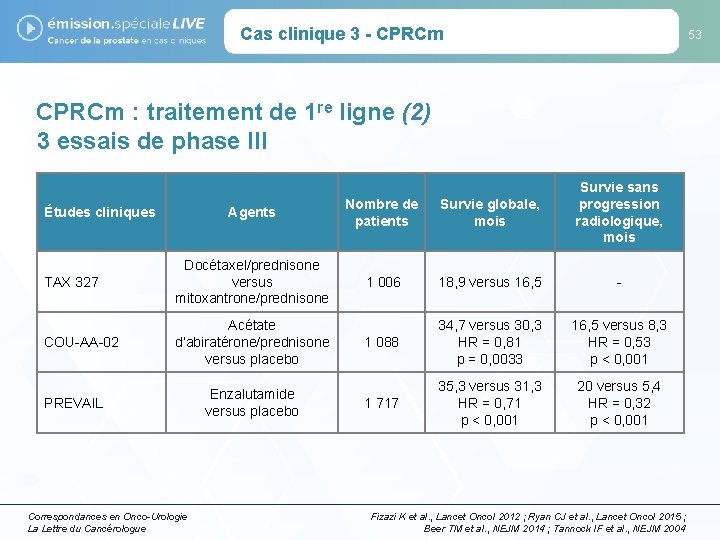
Cas clinique 3 - CPRCm 53 CPRCm : traitement de 1 re ligne (2) 3 essais de phase III Agents Nombre de patients Survie globale, mois Survie sans progression radiologique, mois TAX 327 Docétaxel/prednisone versus mitoxantrone/prednisone 1 006 18, 9 versus 16, 5 - COU-AA-02 Acétate d’abiratérone/prednisone versus placebo 1 088 34, 7 versus 30, 3 HR = 0, 81 p = 0, 0033 16, 5 versus 8, 3 HR = 0, 53 p < 0, 001 1 717 35, 3 versus 31, 3 HR = 0, 71 p < 0, 001 20 versus 5, 4 HR = 0, 32 p < 0, 001 Études cliniques PREVAIL Correspondances en Onco-Urologie La Lettre du Cancérologue Enzalutamide versus placebo Fizazi K et al. , Lancet Oncol 2012 ; Ryan CJ et al. , Lancet Oncol 2015 ; Beer TM et al. , NEJM 2014 ; Tannock IF et al. , NEJM 2004

Cas clinique 3 - CPRCm 54 Optimiser le traitement de 1 re ligne • Plusieurs critères de choix du traitement de 1 re ligne : – La durée de l’hormonosensibilité – Le caractère asymptomatique/peu symptomatique ou symptomatique – La faisabilité ou non d’une chimiothérapie par docétaxel – Le traitement antérieur éventuellement administré au stade de CPHnm – Le choix du patient – Le coût pour la société Correspondances en Onco-Urologie La Lettre du Cancérologue de Bono JS et al. , Eur Urol 2016 ; Maughan BL et al. , Prostate 2017 ; Miyake H et al. , Clin Genitourin Cancer 2016 ; Mori K et al. , Prostate 2017 ; Rozet F et al. , Prog Urol 2016 ; Tannock IF et al. , NEJM 2004 ; Terada N et al. , Int J Urol 2017

Cas clinique 3 - CPRCm 55 Le traitement de 1 re ligne dans le CPRCm a un impact sur l’efficacité des traitements suivants • Étude prospective de phase II, multicentrique – 202 patients CPRCm – Comparaison des séquences (L 1 et L 2) : • Acétate d’abiratérone puis enzalutamide au moment de la progression versus • Enzalutamide puis acétate d’abiratérone au moment de la progression – Critères principaux : • Diminution du PSA (> 50 %) en L 2 • Temps jusqu’à progression du PSA (depuis la 1 re ligne jusqu’à la L 2) Limites : publication en attente, données d’étude, applicabilité en pratique clinique ? Correspondances en Onco-Urologie La Lettre du Cancérologue Khalaf D et al. , ASCO® 2018 : abstr. 5015, actualisé
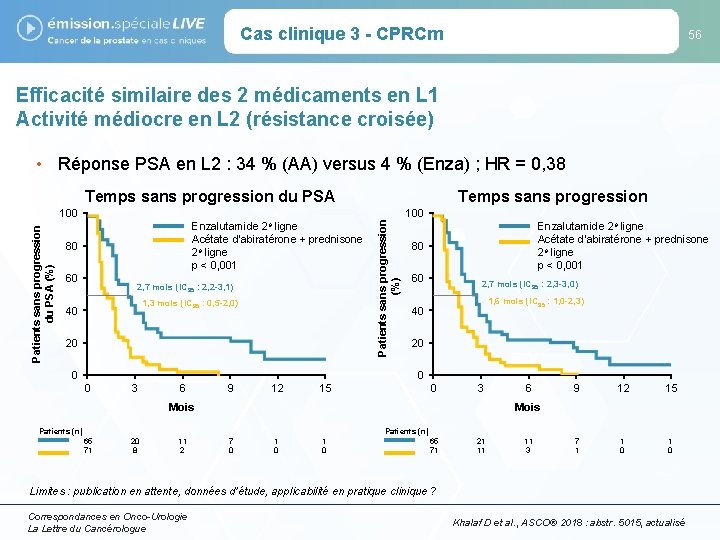
Cas clinique 3 - CPRCm 56 Efficacité similaire des 2 médicaments en L 1 Activité médiocre en L 2 (résistance croisée) • Réponse PSA en L 2 : 34 % (AA) versus 4 % (Enza) ; HR = 0, 38 Patients sans progression du PSA (%) 100 Enzalutamide 2 e ligne Acétate d’abiratérone + prednisone 2 e ligne p < 0, 001 80 60 2, 7 mois (IC 95 : 2, 2 -3, 1) 1, 3 mois (IC 95 : 0, 5 -2, 0) 40 20 0 Temps sans progression Patients sans progression (%) Temps sans progression du PSA 100 Enzalutamide 2 e ligne Acétate d’abiratérone + prednisone 2 e ligne p < 0, 001 80 60 2, 7 mois (IC 95 : 2, 3 -3, 0) 1, 6 mois (IC 95 : 1, 0 -2, 3) 40 20 0 0 3 6 9 12 15 0 3 Mois 6 9 12 15 7 1 1 0 Mois Patients (n) 65 71 20 8 11 2 7 0 1 0 65 71 21 11 11 3 Limites : publication en attente, données d’étude, applicabilité en pratique clinique ? Correspondances en Onco-Urologie La Lettre du Cancérologue Khalaf D et al. , ASCO® 2018 : abstr. 5015, actualisé
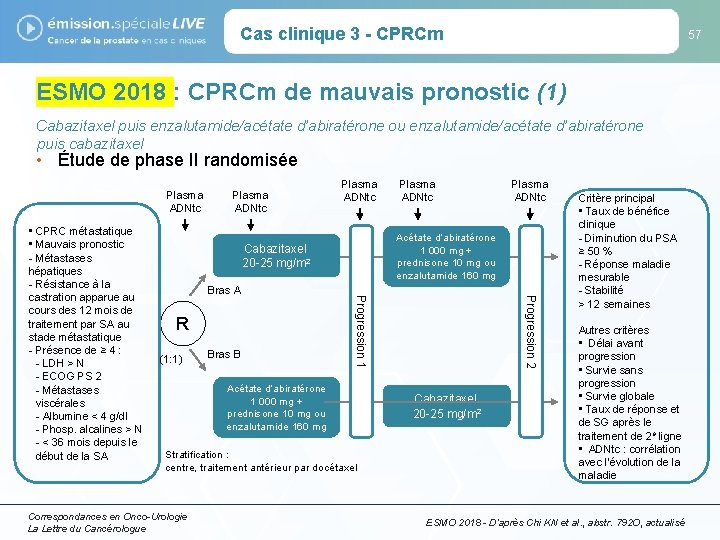
Cas clinique 3 - CPRCm 57 ESMO 2018 : CPRCm de mauvais pronostic (1) Cabazitaxel puis enzalutamide/acétate d’abiratérone ou enzalutamide/acétate d’abiratérone puis cabazitaxel • Étude de phase II randomisée Plasma ADNtc (1: 1) Bras B Acétate d’abiratérone 1 000 mg + prednisone 10 mg ou enzalutamide 160 mg Stratification : centre, traitement antérieur par docétaxel Correspondances en Onco-Urologie La Lettre du Cancérologue Progression 2 R Plasma ADNtc Acétate d’abiratérone 1 000 mg + prednisone 10 mg ou enzalutamide 160 mg Cabazitaxel 20 -25 mg/m 2 Bras A Plasma ADNtc Progression 1 • CPRC métastatique • Mauvais pronostic - Métastases hépatiques - Résistance à la castration apparue au cours des 12 mois de traitement par SA au stade métastatique - Présence de ≥ 4 : - LDH > N - ECOG PS 2 - Métastases viscérales - Albumine < 4 g/dl - Phosp. alcalines > N - < 36 mois depuis le début de la SA Plasma ADNtc Cabazitaxel 20 -25 mg/m 2 Critère principal • Taux de bénéfice clinique - Diminution du PSA ≥ 50 % - Réponse maladie mesurable - Stabilité > 12 semaines Autres critères • Délai avant progression • Survie sans progression • Survie globale • Taux de réponse et de SG après le traitement de 2 e ligne • ADNtc : corrélation avec l’évolution de la maladie ESMO 2018 - D’après Chi KN et al. , abstr. 792 O, actualisé
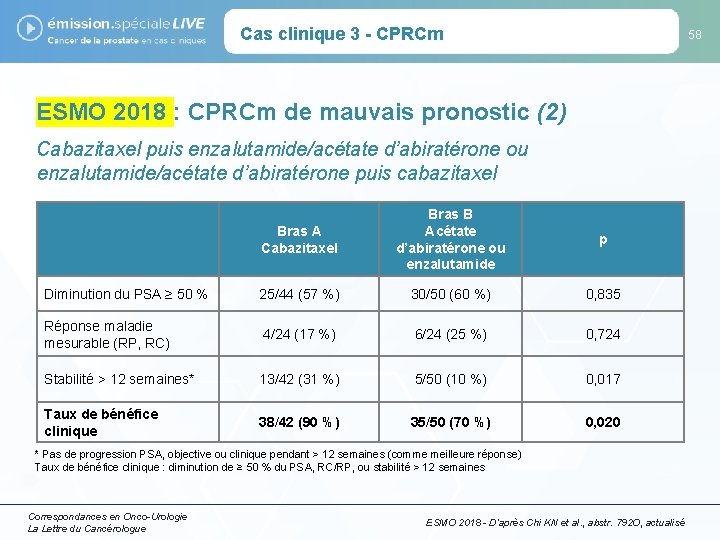
Cas clinique 3 - CPRCm 58 ESMO 2018 : CPRCm de mauvais pronostic (2) Cabazitaxel puis enzalutamide/acétate d’abiratérone ou enzalutamide/acétate d’abiratérone puis cabazitaxel Bras A Cabazitaxel Bras B Acétate d’abiratérone ou enzalutamide p Diminution du PSA ≥ 50 % 25/44 (57 %) 30/50 (60 %) 0, 835 Réponse maladie mesurable (RP, RC) 4/24 (17 %) 6/24 (25 %) 0, 724 Stabilité > 12 semaines* 13/42 (31 %) 5/50 (10 %) 0, 017 Taux de bénéfice clinique 38/42 (90 %) 35/50 (70 %) 0, 020 * Pas de progression PSA, objective ou clinique pendant > 12 semaines (comme meilleure réponse) Taux de bénéfice clinique : diminution de ≥ 50 % du PSA, RC/RP, ou stabilité > 12 semaines Correspondances en Onco-Urologie La Lettre du Cancérologue ESMO 2018 - D’après Chi KN et al. , abstr. 792 O, actualisé
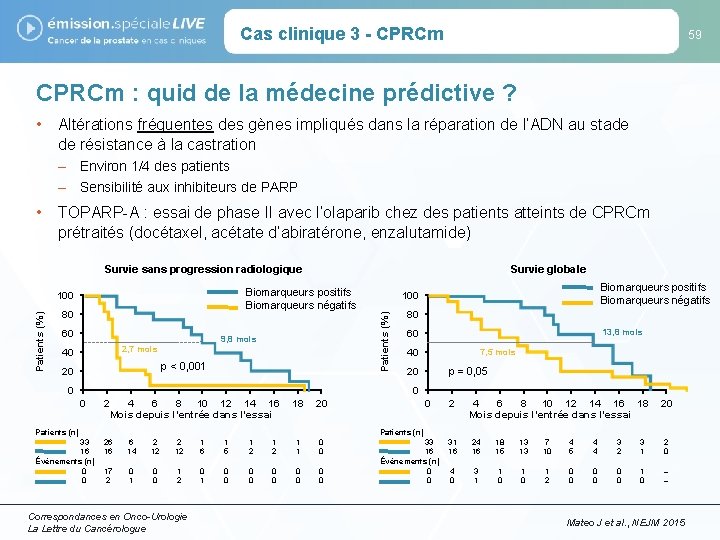
Cas clinique 3 - CPRCm 59 CPRCm : quid de la médecine prédictive ? • Altérations fréquentes des gènes impliqués dans la réparation de l’ADN au stade de résistance à la castration – Environ 1/4 des patients – Sensibilité aux inhibiteurs de PARP • TOPARP-A : essai de phase II avec l’olaparib chez des patients atteints de CPRCm prétraités (docétaxel, acétate d’abiratérone, enzalutamide) Survie sans progression radiologique Biomarqueurs positifs Biomarqueurs négatifs 80 60 9, 8 mois 2, 7 mois 40 p < 0, 001 20 0 Biomarqueurs positifs Biomarqueurs négatifs 100 Patients (%) Survie globale 80 13, 8 mois 60 7, 5 mois 40 p = 0, 05 20 0 0 2 4 6 8 10 12 14 16 Mois depuis l’entrée dans l’essai 18 20 Patients (n) 33 16 Événements (n) 0 0 0 2 4 6 8 10 12 14 16 18 Mois depuis l’entrée dans l’essai 20 Patients (n) 26 16 6 14 2 12 1 6 1 5 1 2 1 1 0 0 17 2 0 1 0 0 1 2 0 1 0 0 0 0 0 Correspondances en Onco-Urologie La Lettre du Cancérologue 33 16 Événements (n) 0 0 31 16 24 16 18 15 13 13 7 10 4 5 4 4 3 2 3 1 2 0 4 0 3 1 1 0 1 2 0 0 0 1 0 – – Mateo J et al. , NEJM 2015
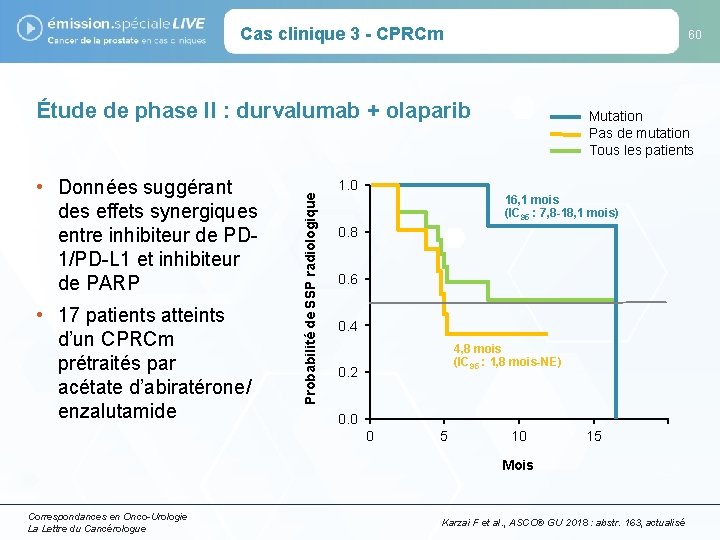
Cas clinique 3 - CPRCm 60 • Données suggérant des effets synergiques entre inhibiteur de PD 1/PD-L 1 et inhibiteur de PARP • 17 patients atteints d’un CPRCm prétraités par acétate d’abiratérone/ enzalutamide Probabilité de SSP radiologique Étude de phase II : durvalumab + olaparib 1. 0 Mutation Pas de mutation Tous les patients 16, 1 mois (IC 95 : 7, 8 -18, 1 mois) 0. 8 0. 6 0. 4 4, 8 mois (IC 95 : 1, 8 mois-NE) 0. 2 0. 0 0 5 10 15 Mois Correspondances en Onco-Urologie La Lettre du Cancérologue Karzai F et al. , ASCO® GU 2018 : abstr. 163, actualisé
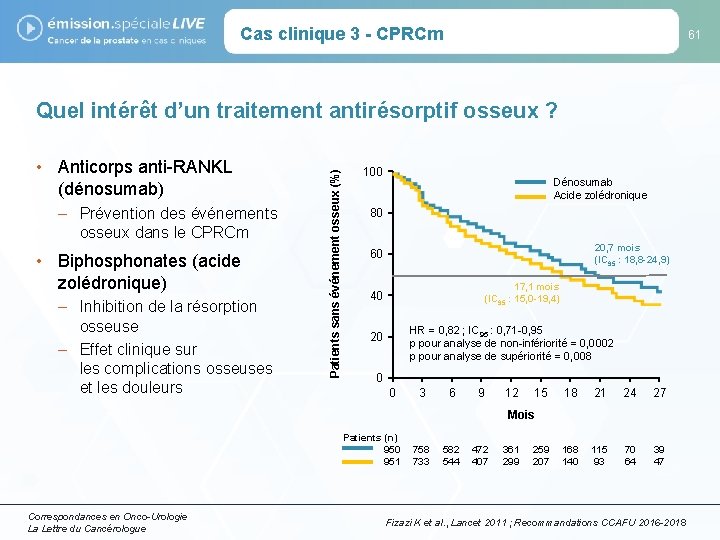
Cas clinique 3 - CPRCm 61 • Anticorps anti-RANKL (dénosumab) – Prévention des événements osseux dans le CPRCm • Biphosphonates (acide zolédronique) – Inhibition de la résorption osseuse – Effet clinique sur les complications osseuses et les douleurs Patients sans événement osseux (%) Quel intérêt d’un traitement antirésorptif osseux ? 100 Dénosumab Acide zolédronique 80 20, 7 mois (IC 95 : 18, 8 -24, 9) 60 17, 1 mois (IC 95 : 15, 0 -19, 4) 40 HR = 0, 82 ; IC 95 : 0, 71 -0, 95 p pour analyse de non-infériorité = 0, 0002 p pour analyse de supériorité = 0, 008 20 0 0 3 6 9 12 15 18 21 24 27 168 140 115 93 70 64 39 47 Mois Patients (n) 950 951 Correspondances en Onco-Urologie La Lettre du Cancérologue 758 733 582 544 472 407 361 299 259 207 Fizazi K et al. , Lancet 2011 ; Recommandations CCAFU 2016 -2018

Cas clinique 3 - CPRCm Antirésorptifs osseux : anti-RANKL (dénosumab) et biphosphonates (zolédronate) • Bilan et prise en charge dentaire préalables +++ Correspondances en Onco-Urologie La Lettre du Cancérologue 62

Cas clinique 3 - CPRCm Conclusion : pour la pratique • CPRCm en pratique – Poursuite de la suppression androgénique (agoniste/antagoniste de la LH-RH) – Traitement de 1 re ligne • Prise en compte – Du traitement antérieur au stade hormononaïf • NHT ou docétaxel • Radium-223 : AMM mais actuellement non remboursé en France – Si métastases osseuses : intérêt d’un traitement antirésorptif osseux (dénosumab, biphosphonates/zolédronate) • Pour prévenir la survenue de complications osseuses Correspondances en Onco-Urologie La Lettre du Cancérologue 63

Cas clinique 3 - CPRCm • Question 1. CPRCm : à l’heure des “combos” en onco-urologie, pourquoi ne pas envisager des essais d’associations plutôt que des essais de séquences thérapeutiques ? • Réponse – Des essais “combos” en cours dans le Ca. P • • Associations d’hormonothérapies de nouvelle génération Association enzalutamide + radium-223 Association docétaxel + radium-223 Association avec les traitements d’immunothérapie Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 2. Recherche d’anomalies des gènes impliqués dans la réparation de l’ADN : chez quels patients et à quel moment ? • Réponse – Existence d’une anomalie germinale de BRCA 1 et surtout de BRCA 2 chez environ 10 % des hommes atteints d’un Ca. P d’emblée métastatique • Fréquence au moins comparable à celle des cancers de l’ovaire ou du sein – Pas de recommandation formelle – Envisager dans ces contextes de demander une consultation d’oncogénétique ? • Implications +++ pour le patient (traitement) et pour les autres membres de la famille Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 3. CPRCm et recherche d’anomalies de BRCA 1/2 : quelle stratégie thérapeutique hors essai clinique ? • Réponse – Inhibiteur de PARP : pas d’AMM, ni de remboursement – Sensibilité accrue aux sels de platine • Chimiothérapie par un sel de platine : envisageable après hormonothérapies de nouvelle génération et taxanes Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 4. Quelle place pour la biopsie des métastases ? • Réponse – Biopsies de métastases à la recherche d’anomalies de gènes impliqués dans la réparation de l’ADN – Plusieurs de ces anomalies et en particulier les mutations (germinales ou somatiques) de BRCA 2 : facteur prédictif de réponse aux inhibiteurs de PARP – Plusieurs essais randomisés ou non, en cours, dans différents centres français Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 5. Faut-il réaliser un screening oncogénétique chez tous les patients atteints d’un CPRCm ? Quid en pratique ? • Réponse – Recherche de mutations germinales de gènes impliqués dans la réparation de l’ADN • Simple prélèvement sanguin, test peu coûteux et résultats après quelques mois – Recherche de mutations somatiques acquises, de gènes impliqués dans la réparation de l’ADN • Biopsie et recherche des anomales par NGS sur les cellules tumorales • Pas de couverture financière : à envisager dans le cadre d’un programme institutionnel, d’un programme de recherche ou d’un essai clinique Correspondances en Onco-Urologie La Lettre du Cancérologue
Cas clinique 3 - CPRCm • Question 6. Le radium-223 : quel avenir en France ? • Réponse • AMM en France mais pas de remboursement • Traitement onéreux • Pour la pratique • Radium-223 dans le cadre d’essais cliniques Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 7. Chez un patient atteint d’un CPRCm n’ayant pas eu de traitement local, l’attitude thérapeutique est-elle la même ? • Réponse – Place du traitement local au stade de CPRCm • Peu de données • Radiorésistance plus importante au stade de résistance à la castration (réparation de l’ADN favorisée par les androgènes) – Proposer plutôt en amont un traitement local, au stade d’hormonosensibilité (STAMPEDE) • Pour la pratique • Traitement local à ce stade de la maladie uniquement dans le cadre d’essais cliniques Correspondances en Onco-Urologie La Lettre du Cancérologue

Cas clinique 3 - CPRCm • Question 8. Taux de testostéronémie : un critère de choix entre hormonothérapie de nouvelle génération et chimiothérapie ? • Réponse – Implications cliniques du taux de testostéronémie après castration chirurgicale ou chimique mal cernée – Analyse a posteriori dans les études menées avec l’acétate d’abiratérone en fonction du taux de testostéronémie : • bénéfice de l’abiratérone quel que soit le taux de testostéronémie • Pour la pratique • Le taux de testostéronémie sous castration ne semble pas, à partir des données disponibles, un critère de choix entre hormonothérapie de nouvelle génération et chimiothérapie Correspondances en Onco-Urologie La Lettre du Cancérologue
- Slides: 72