CHAPITRE 03 SUIVI DUNE REACTION CHIMIQUE TP correction

















- Slides: 18

CHAPITRE 03 SUIVI D’UNE REACTION CHIMIQUE - TP : correction - bilan - exercices - Difficulté du chapitre

TP : CORRECTION Attention erreur dans l’énoncé C= 0. 01 mol/L et vous devez remplacer mes chiffres par les vôtres

Équation de réaction Avance État du ment x système (mol) État x = 0 initial État intermédi x aire État final xmax C 9 H 8 O 4 + HCO 3 -→ C 9 H 7 O 4 - + CO 2 + H 2 O n. C 9 H 8 O 4 n(HCO 3 -) n(…………) (mol) (mol) Excès n 0 = 1, 5. 10 -4 0 0 0 Excès n 0 – x x Excès xmax n 0 – xmax = =1, 5. 10 -4 -4 = 0 1, 5. 10 4 calcul de no: no= Cx. V=10 -2 x 15. 10 -3=1, 5. 10 -4 mol

• I- 3°/ La mesure de pression de dioxyde de carbone formée permet d'établir un bilan de matière car la pression de gaz formée permet de calculer la quantité de matière de gaz formée grâce à l’équation d’état des gaz parfait : PV=n. RT

ETAT INITIAL : Le volume disponible pour le gaz est le volume du ballon, auquel on soustrait le volume déjà occupé par la solution. Le gaz présent dans le ballon est de l'air, dont la quantité vaut nair. D'où : Pi = n. R T air ____________ (Vballon – Vsolution) ETAT FINAL : Le volume disponible pour le gaz n'a pas changé. Par contre la quantité de gaz présente dans le ballon a changé : La quantité d'air reste la même, mais du CO 2 a été créé par la réaction, donc on écrit que ngaz = nair + n. CO 2 donc: Pf =(nair + n. CO 2). RT/(Vballon– Vsolution)

On peut alors écrire que ΔP = Pf – Pi = [(nair + n. CO 2). R T / (Vballon – Vsolution) ] - [ nair. R T / (Vballon – Vsolution)] On met en facteur le terme R T / (Vballon – Vsolution) ce qui donne ΔP = (nair + n. CO 2 – nair ). R T / (Vballon – Vsolution) On simplifie : ΔP = n. CO 2. R T / (Vballon – Vsolution) On déduit donc l'expression de n. CO 2 : n. CO 2 = ΔP. (Vballon – Vsolution) / (R. T)

Av ec m es va leu rs Grâce au tableau d'avancement, on sait que n. CO 2 formé est égal à l'avancement maximal ( x max). On écrit donc xmax, exp = n. CO 2 Pour faire l'application numérique, on fait attention aux unités : V s'exprime en m 3 : Vballon – Vsolution = 250 - 15 = 235 m. L = 0, 235 L = 2, 35. 10 -4 m 3. T s'exprime en K : T = 25 °C = 298, 15 K P s'exprime en Pa : ΔP = 1500 Pa R = 8, 31 USI Le calcul donne xmax, exp = 1, 42. 10 -4 mol

«mon» écart relatif = 100 x 1, 42. 10 -4 - 1, 5. 10 -4 1, 42. 10 -4 Écart relatif = 5, 63 % Avec n° = C. V = 10 -2 x 15. 10 -3 = 1, 5. 10 -4 mol = xmax. Il s'agit de la valeur théorique, que l'on devrait trouver si l'expérience est convenablement réalisée, et bien sûr si la théorie est correcte. Cet écart entre la valeur théorique et la valeur expérimentale s'explique par l'imprécision des mesures de quantités de matière lors de l'expérience. Il faut aussi tenir compte de la fuite éventuelle des gaz hors de l'erlenmeyer malgré le bouchon.

IIIOui, l’équation d’état des gaz parfait nous permet de calculer la quantité de matière formée à partir d’une mesure de pression. Voir l’expression de la quantité de dioxyde de carbone formé que l’on pourrait écrire dans le tableau d’avancement puisqu’elle correspond à x.

rappels de seconde sur la réaction et le bilan de matière

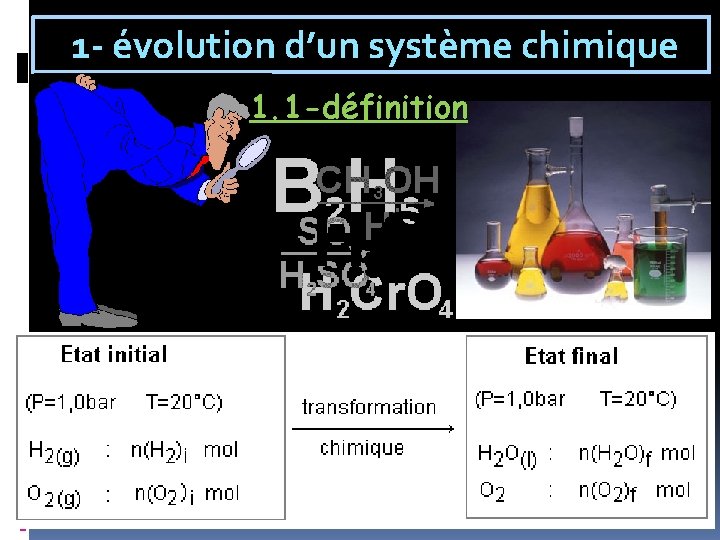
1 - évolution d’un système chimique 1. 1 -définition

1. 2 -équation d’une réaction chimique réactif 1+ réactif 2 → produit 1+ produit 2 l: solide l: liquide g : gaz aq : pour les espèces dissoutes en solution


2 - bilan de matière définition Méthode Avancement de la réaction Tableau descriptif État final Réactif limitant et avancement maximal

Équation de la réaction Quantités de matières initiales (mol) Quantités de matières de réactifs consommés et de produits formés à la date t (mol) Quantités de matières présentes à la date t (mol) lorsque l'avancement est x Quantités de matières finales (mol) lorsque l'avancement est xmax 2 H 2 + O 2 → 2 H 2 O

exercices Exercice 1 Exercice 2 Exercice 3 Exercice 4 + les exercices d’application ainsi que les 2 exercices résolus du livre

Equation de la réaction Etat initial (mol) Etat à la date t l'avancement est x Etat final (mol) l'avancement est xmax(mol)

Difficulté du chapitre q Savoir écrire une équation de réaction q Savoir faire un bilan de matière q Savoir faire un tableau d’avancement q Savoir trouver le réactif limitant