Chap 10 Chaingrowth Polymerization Introduction StepGrowth High conversion

















![Kinetic Chain Reaction C. Reaction Rate by convention, 두 radical 형성 [M ] 가 Kinetic Chain Reaction C. Reaction Rate by convention, 두 radical 형성 [M ] 가](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-24.jpg)



![Kinetic Chain Reaction [M ]을 제거하는 방법 Steady-State Assumption 라디칼 농도가 처음에 증가하고 동시에 Kinetic Chain Reaction [M ]을 제거하는 방법 Steady-State Assumption 라디칼 농도가 처음에 증가하고 동시에](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-29.jpg)
![Kinetic Chain Reaction f<1인 대부분의 system에서 [I 2]1/2가 맞음. (square root dependence of [I Kinetic Chain Reaction f<1인 대부분의 system에서 [I 2]1/2가 맞음. (square root dependence of [I](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-30.jpg)









![Ceiling Temperature Polymer-Depolymerization Equilibria k sec-1 kdp Tc : 이 온도 이상에서 반응이 kp[M] Ceiling Temperature Polymer-Depolymerization Equilibria k sec-1 kdp Tc : 이 온도 이상에서 반응이 kp[M]](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-44.jpg)

- Slides: 47

Chap 10. Chain-growth Polymerization Introduction Step-Growth 두 분자종들이 단계로 중합 분자량이 점차 증가 고분자량 물질은 중합말기에 형성 High conversion과 high mw를 만들려면 long reaction time 이 필요 Chain-Growth 고분자량의 물질을 즉시 중합초기에 형성 Radical이나 anionic, cationic, reaction site를 한번 형성하면 연쇄 반응에 의해 많은 monomer unit에 전달되고 큰 size로 빨리 성장한다. 어느 형태의 active species나 active center를 통해 일어남 고분자 사슬의 형성은 kinetic chain reaction의 성장결과이다. 2020 -11 -27 1 Spring 2004

Chain Growth Polymerization Kinetic Chain Reaction 한 개시제 분자에 의해 유사한 반응이 연속하여 일어나는 것을 의미 세가지 기본 형태 1) 개시(Initiation)- 한 개 이상의 반응을 도입 2) 성장(propagation)- 유사반응의 연속 3) 정지(termination)- kinetic chain 파괴 연쇄이동(chain transfer)- physical chain은 파괴 kinetic chain은 파괴되지 않음 Kinetic Chain Length: ν 각 라디칼당 중합한 모노머분자의 평균수 2020 -11 -27 2 Spring 2004

Chain Growth Polymerization General Kinetic Scheme 1) Initiation kd I 2 R* active center들을 형성(radical or ion) kd: 개시제 분해 속도 상수 ~10 -4~10 -6 l/mole·sec R* +M ki RM* or M 1* (primary active species or primary radical or initiator radical) ki : 개시반응 속도상수 2020 -11 -27 3 Spring 2004

Chain Growth Polymerization 2) Propagation M 1 * + M M 2 * + M M 3 * + M Mn * + M kp kp kp M 2* M 3* M 4* Mn+1* kp: 모노머의 성장반응 속도상수 102~104 l/mole·sec 로서 step-growth 보다 훨씬 빠름 2020 -11 -27 4 Spring 2004

Chain Growth Polymerization 3) Termination 재결합(coupling): 두 Kinetic chain length가 한 polymer가 됨 DPn = 2ν kp Mn * + M m * Mn+m 불균화 (不均化, disproportionation) : 두 kinetic chain length가 두 polymer가 됨 DPn = ν k Mn*+ Mm* td Mn + M m 전반적으로 k Mn*+ Mm* t kt = ktc + ktd 2020 -11 -27 Mdead polymer ~106 -108 l/mole·sec 5 Spring 2004

Chain Growth Polymerization ※kp가 kt보다 낮은데 중합을 방해하지 않는 이유? - radical species가 매우 낮은 농도에서 존재 - 중합속도가 kt의 1/2승에 비례 4) Chain Transfer Mn * + S Mn + S* physical chain length kinetic chain length monomer, polymer solvent or chain transfer agent 전 중합 반응 속도는 모든 단계들에 의해 결정됨 2020 -11 -27 6 Spring 2004

Chain Growth Polymerization Kinetic Chain Length : 각 개시제 라디칼 분자당 중합에 필요한 평균 모노머 분자수(ν) ex) 라디칼 4개가 모노머 4, 000개를 중합하고 disproportionation 에 의해 정지되었다면, ν=4, 000/4 =1, 000 로서 step 1, 2, 3 에 의해 결정됨. 즉, Chain Transfer가 없을 때의 중합도 Physical Chain Length : Step 1, 2, 3, 4 모두 포함한 경우 2020 -11 -27 7 Spring 2004

Kinetic Chain Reaction Non-Polymerization Reaction Peroxide induced Bromination of Toluene 1) Initiation Two types of reaction R-O-O-R 2 RO • R-O • + Br 2 ROBr + Br • R-O • + ФCH 3 ROH + ФCH 2 • (1) (2) (3) ROOR 각분자가 분해하여 두개의 라디칼과 두개의 kinetic chain 을 형성 2020 -11 -27 8 Spring 2004


Kinetic Chain Reaction 3) Termination 2 Br • Br 2 2 ФCH 2 • ФCH 2 Ф ФCH 2 • + Br • ФCH 2 Br + Br • 각 반응이 두개의 자유라디칼과 두 kinetic chain 이 파괴되어 이루어진다. NET EFFECT OF KINETIC Chain rexn: One ROOR molecule can cause formation of Br 2, CH 2 Br, H ‥. 2020 -11 -27 10 Spring 2004

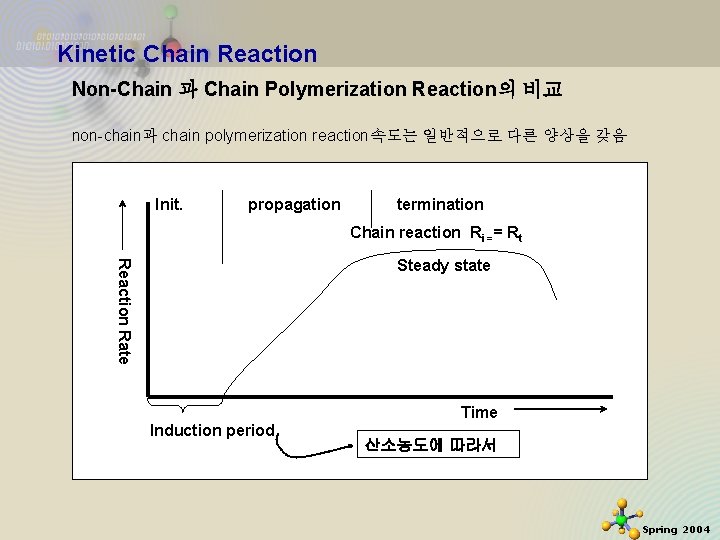
Kinetic Chain Reaction Non-Chain 과 Chain Polymerization Reaction의 비교 non-chain과 chain polymerization reaction속도는 일반적으로 다른 양상을 갖음 Init. propagation termination Chain reaction Ri == Rt Reaction Rate Steady state Time Induction period 2020 -11 -27 산소농도에 따라서 11 Spring 2004

Kinetic Chain Reaction Chain reaction 인 경우는 주로 유도기(induction period) 가 있음. 주된 이유는 inhibitor가 있기 때문 일단 active center가 형성되면 반응속도가 빨라지고 일정하게 됨 (steady state) 동시에 정지반응도 증가하여 전반응속도는 plateau region으로 level off 함 후에 반응속도는 모노머, 개시제 등의 손실로 감소함 Linear Chain-Growth: Polymer of high DPn found easily in early reaction Linear Step-Growth: high extent of reaction value required to obtain high DPn 2020 -11 -27 12 Spring 2004

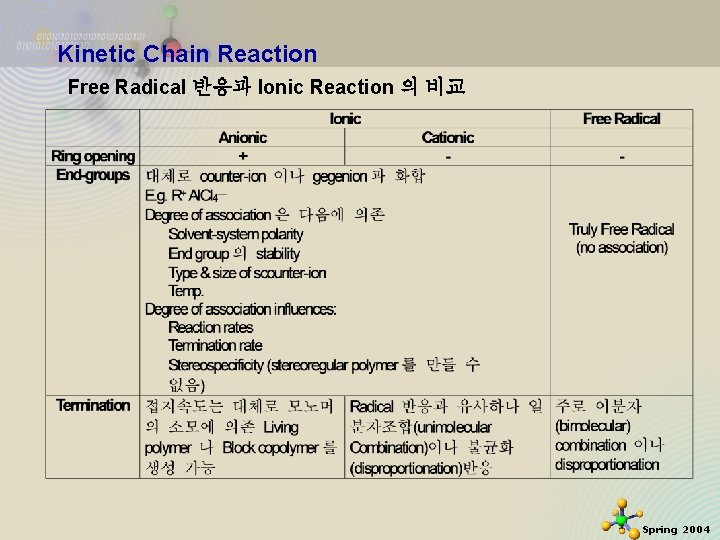
Kinetic Chain Reaction Free Radical 반응과 Ionic Reaction 의 비교 - Ionic Initiation – multiple bond addition 과 ring opening polymerization이 가능 - Radical Initiation – Ring-opening polymerization은 개시 안함 Free Radical 과 ionic 개시중합, 음이온과 양이온 중합이mechanism 적으로 다르므로 개시제의 선택에 영향을 줌 2020 -11 -27 13 Spring 2004

Kinetic Chain Reaction Free Radical 반응과 Ionic Reaction 의 비교 2020 -11 -27 14 Spring 2004

Kinetic Chain Reaction Free Radical 반응과 Ionic Reaction 의 Termination Step 비교 A) Free Radical Termination Two molecules involved = bimolecular reaction 2020 -11 -27 15 Spring 2004

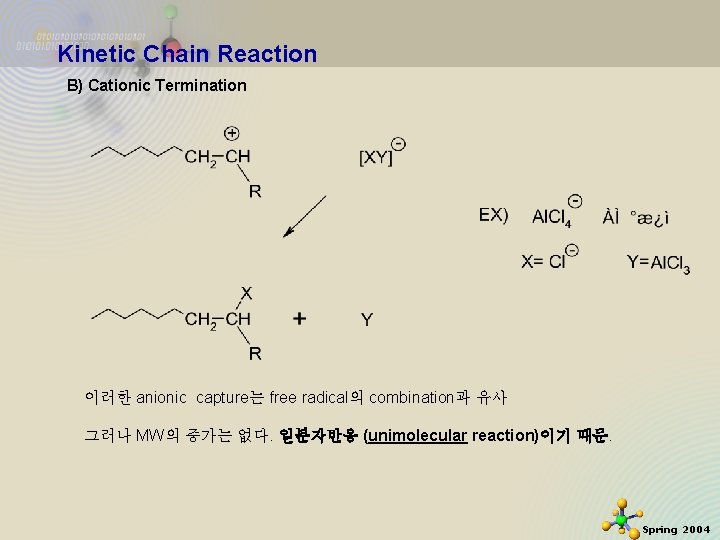
Kinetic Chain Reaction B) Cationic Termination 이러한 anionic capture는 free radical의 combination과 유사 그러나 MW의 증가는 없다. 일분자반응 (unimolecular reaction)이기 때문. 2020 -11 -27 16 Spring 2004

Kinetic Chain Reaction 또는 다른 가능성은 이러한 proton release는 free radical의 disproportion과 유사. 그러나 one chain만이 반응에 참여. 따라서 이 경우도 unimolecular reaction 2020 -11 -27 17 Spring 2004

Kinetic Chain Reaction Surfing to the internet For further details about Chain Growth Polymerization Click next homepage. 2020 -11 -27 http: //www. psrc. usm. edu/macrog/synth. htm 18 Spring 2004

Kinetic Chain Reaction Free Radical Initiated Polymerization of Unsaturated monomers Kinetic Scheme Initiation Two step sequence-Both enter into overall rate 1. Initiator decomposition I 2 kd 2 I 2. Initiator fragment 가 모노머에 첨가, Chain growth의 개시. I +M ki IM Primary radical species Initiator의 efficiency는 desired reaction과 side reaction 과의 경쟁에 의해 결정됨. 일반적으로, 2020 -11 -27 0. 5 << f << 1 19 Spring 2004

Kinetic Chain Reaction A. Cage Effect –primary recombination Initiator fragments surrounded by restricting cage of solvent Ex) (acetyl peroxide) 2020 -11 -27 20 Spring 2004

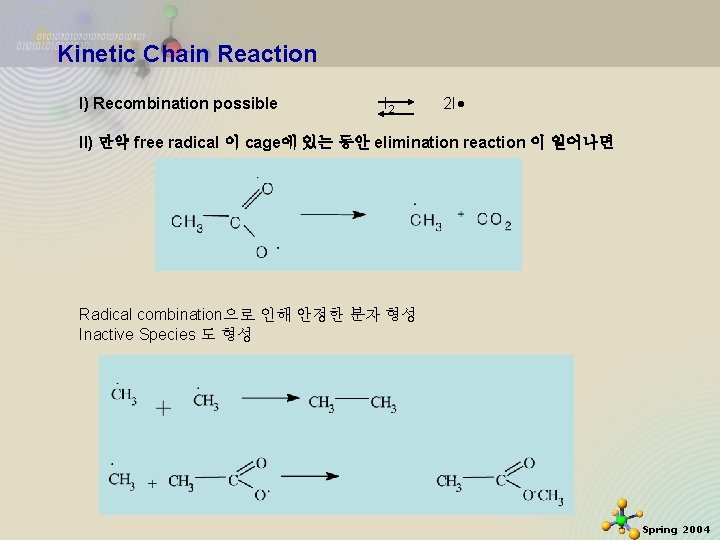
Kinetic Chain Reaction I) Recombination possible I 2 2 I II) 만약 free radical 이 cage에 있는 동안 elimination reaction 이 일어나면 Radical combination으로 인해 안정한 분자 형성 Inactive Species 도 형성 2020 -11 -27 21 Spring 2004

Kinetic Chain Reaction B. Induced Decomposition –Secondary combination I) Radical이 peroxide 분자를 공격함으로 해서 R + R -O-O-R 결국, R + R OOR RH + R OOR R =O + R O ROR + R O Total number of radical 은 변하지 않았으나 그중 반수의 분자들이 낭비. II) Chain Transfer to Solvent 이 경우도 한 라디칼 밖에 못 얻으므로 개시제의 반이 낭비되었다. 2020 -11 -27 22 Spring 2004

Kinetic Chain Reaction III) Reaction with Chain Radical 개시제 분자 모두가 중합반응 개시에 관여하지 않으므로 efficiency factor를 집어넣 음. f: Initiator Efficiency = mole fraction of initiator fragments that actually initiate polymer chains. 0. 5 < f < 1. 0 2020 -11 -27 23 Spring 2004
![Kinetic Chain Reaction C Reaction Rate by convention 두 radical 형성 M 가 Kinetic Chain Reaction C. Reaction Rate by convention, 두 radical 형성 [M ] 가](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-24.jpg)
Kinetic Chain Reaction C. Reaction Rate by convention, 두 radical 형성 [M ] 가 크기에 관계없이 모든 Chain radical 농도를 대표한다면 즉, M = IM or = I M f 1 Ri는 [M] 과 무관 f= [M] f < 1 Ri 는 [M]과 관련 [M] , f [I 2] , f 2020 -11 -27 due to induced decomposition 24 Spring 2004

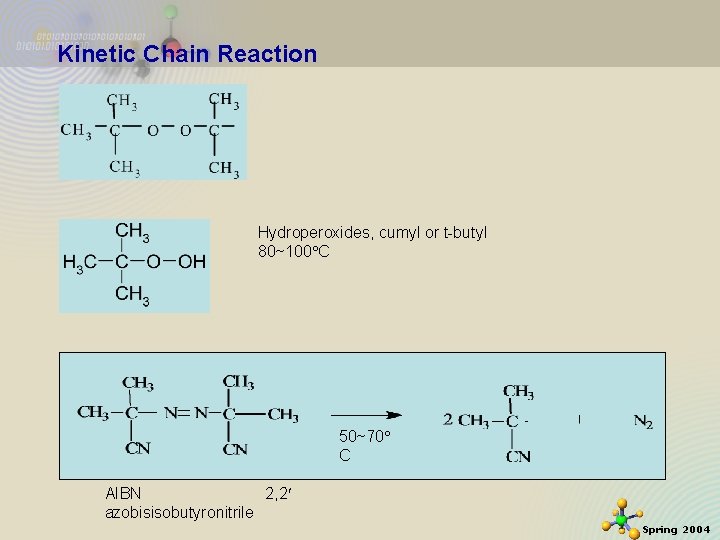
Kinetic Chain Reaction D. Initiator 등의 결합을 가진 화합물들. Acetyl peroxide, or benzoyl peroxide 80~100 C Alkyl peroxide, cumyl or t-butyl peroxide 120~140 C 2020 -11 -27 25 Spring 2004

Kinetic Chain Reaction Hydroperoxides, cumyl or t-butyl 80~100 C 50~70 C AIBN 2, 2 azobisisobutyronitrile 2020 -11 -27 26 Spring 2004

Kinetic Chain Reaction Propagation Termination By convention 2개의 라디칼이 소멸되므로 2020 -11 -27 27 Spring 2004

Kinetic Chain Reaction Overall Rate of Polymerzation (# of propagation step >>> # of initiation step) Radical concentration • 측정하기 어려움, 농도가 작다. (~10 -8 molar) • 따라서 이 term을 이용하는 것이 비현실적. • [M ]을 제거하는 것이 바람직. 2020 -11 -27 28 Spring 2004
![Kinetic Chain Reaction M 을 제거하는 방법 SteadyState Assumption 라디칼 농도가 처음에 증가하고 동시에 Kinetic Chain Reaction [M ]을 제거하는 방법 Steady-State Assumption 라디칼 농도가 처음에 증가하고 동시에](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-29.jpg)
Kinetic Chain Reaction [M ]을 제거하는 방법 Steady-State Assumption 라디칼 농도가 처음에 증가하고 동시에 constant한 정상상태에 도달한다. 그리고는 reaction rate change가 0이 됨. (active centers created and destroyed at the same Ri = Rt ※중합속도식 1/2승 법칙 recall 2020 -11 -27 29 Spring 2004
![Kinetic Chain Reaction f1인 대부분의 system에서 I 212가 맞음 square root dependence of I Kinetic Chain Reaction f<1인 대부분의 system에서 [I 2]1/2가 맞음. (square root dependence of [I](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-30.jpg)
Kinetic Chain Reaction f<1인 대부분의 system에서 [I 2]1/2가 맞음. (square root dependence of [I 2]) ※ Odian Fig. 3 -4 MMA using BPO Rp Vinyl Acetate using AIBN [I 2]1/2 2 BPO -CO 2 300 C + N 2 2020 -11 -27 Azobisisobutyronitrile 30 Spring 2004

Kinetic Chain Reaction f < 1인 경우에 SRD 가 맞지 않는 경우 왜냐하면 f 가 [M] 에 ‘dependent’. Why? Due to induced decomposition of toluene + [I 2] 2020 -11 -27 31 Spring 2004

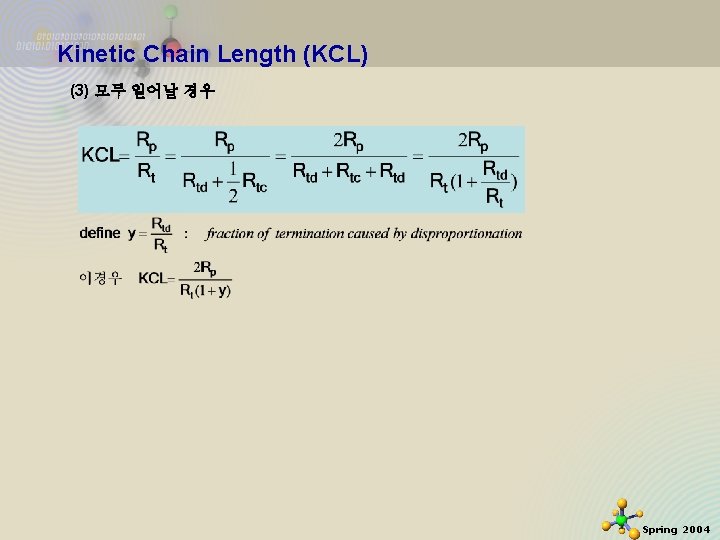
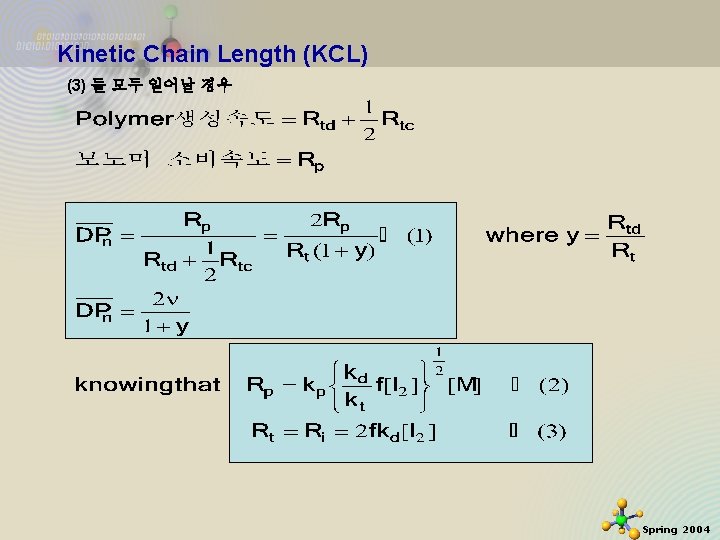
Kinetic Chain Length (KCL) At S-S assumption (1) Disproportionation의 경우 Knowing that (2) Coupling or combination의 경우 2020 -11 -27 32 Spring 2004

Kinetic Chain Length (KCL) (3) 모두 일어날 경우 2020 -11 -27 33 Spring 2004

Kinetic Chain Length (KCL) Degree of Polymerization (중합도) 중합도 DP 는 모노머 농도가 증가할수록 개시제 농도가 감소할수록 (1) Dispropotionation의 경우 (2) Coupling의 경우 2020 -11 -27 34 Spring 2004

Kinetic Chain Length (KCL) (3) 둘 모두 일어날 경우 2020 -11 -27 35 Spring 2004

Kinetic Chain Length (KCL) (1), (2), (3)식으로부터 만약 Chain transfer가 없고 S-S assumption이 valid한 경우 개시제 효과 (2), (4) 식으로 알 수 있다. 이 valid 한 경우 , 2020 -11 -27 36 Spring 2004

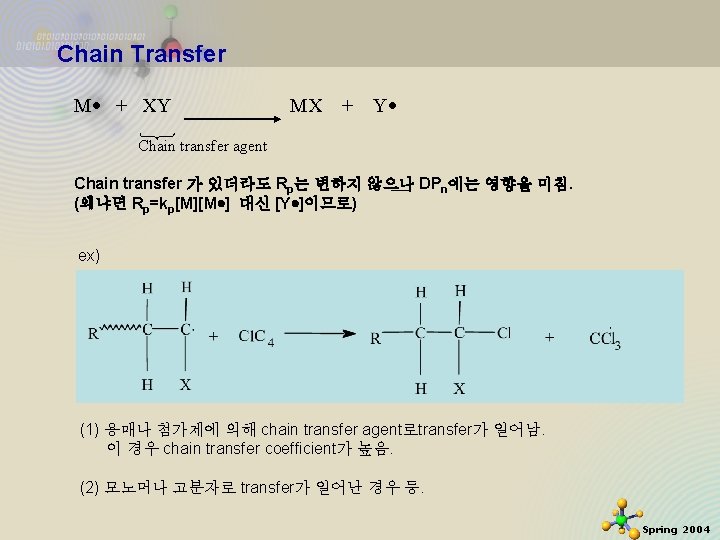
Chain Transfer M + XY MX + Y Chain transfer agent Chain transfer 가 있더라도 Rp는 변하지 않으나 DPn에는 영향을 미침. (왜냐면 Rp=kp[M][M ] 대신 [Y ]이므로) ex) (1) 용매나 첨가제에 의해 chain transfer agent로transfer가 일어남. 이 경우 chain transfer coefficient가 높음. (2) 모노머나 고분자로 transfer가 일어난 경우 등. 2020 -11 -27 37 Spring 2004


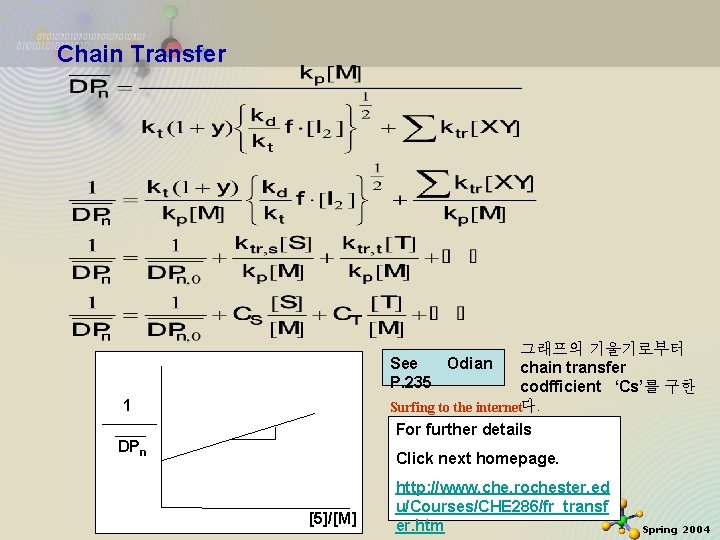
Chain Transfer 그래프의 기울기로부터 See Odian chain transfer P. 235 codfficient ‘Cs’를 구한 Surfing to the internet다. 1 For further details DPn 2020 -11 -27 Click next homepage. [5]/[M] http: //www. che. rochester. ed u/Courses/CHE 286/fr_transf er. htm 39 Spring 2004

Temperature Dependence of Rp and DPn Assume : no chain transfer 2020 -11 -27 40 Spring 2004

Temperature Dependence of Rp and DPn slope of ln. Rp/T is ( + ) as T ln. Rp but Rate of Increase as d ln. Rp/d. T 2020 -11 -27 41 Spring 2004

Temperature Dependence of Rp and DPn 2020 -11 -27 42 Spring 2004

Ceiling Temperature Polymer-Depolymerization Equilibria kp Mn + M Mn+1 as T kdep Equilibrium const. for any chemical rexn. Ceiling Temperature for 2020 -11 -27 each [M] get various Tc 43 Spring 2004
![Ceiling Temperature PolymerDepolymerization Equilibria k sec1 kdp Tc 이 온도 이상에서 반응이 kpM Ceiling Temperature Polymer-Depolymerization Equilibria k sec-1 kdp Tc : 이 온도 이상에서 반응이 kp[M]](https://slidetodoc.com/presentation_image_h/ac74b4773057f012a63f1351dd1f0175/image-44.jpg)
Ceiling Temperature Polymer-Depolymerization Equilibria k sec-1 kdp Tc : 이 온도 이상에서 반응이 kp[M] 일어나지 않는다. 이 온도 이하에서 안정 kp[M]- kdp 300 2020 -11 -27 400 500 Tc 44 Spring 2004

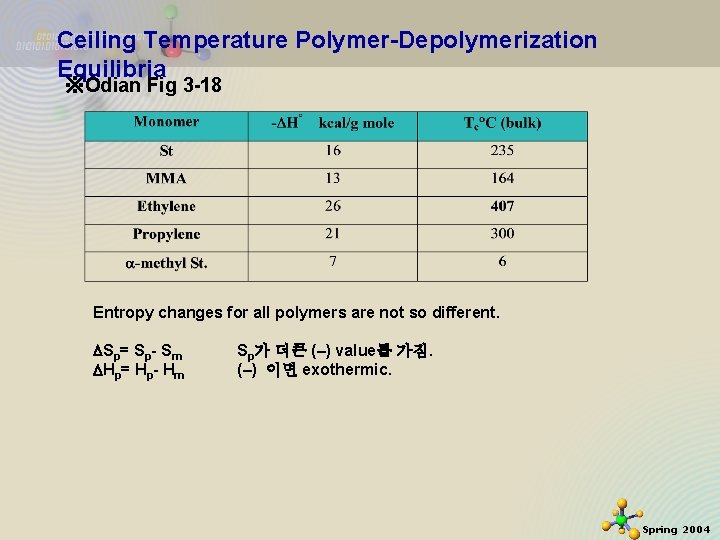
Ceiling Temperature Polymer-Depolymerization Equilibria ※Odian Fig 3 -18 Entropy changes for all polymers are not so different. Sp= Sp- Sm Hp= Hp- Hm 2020 -11 -27 Sp가 더큰 (–) value를 가짐. (–) 이면 exothermic. 45 Spring 2004

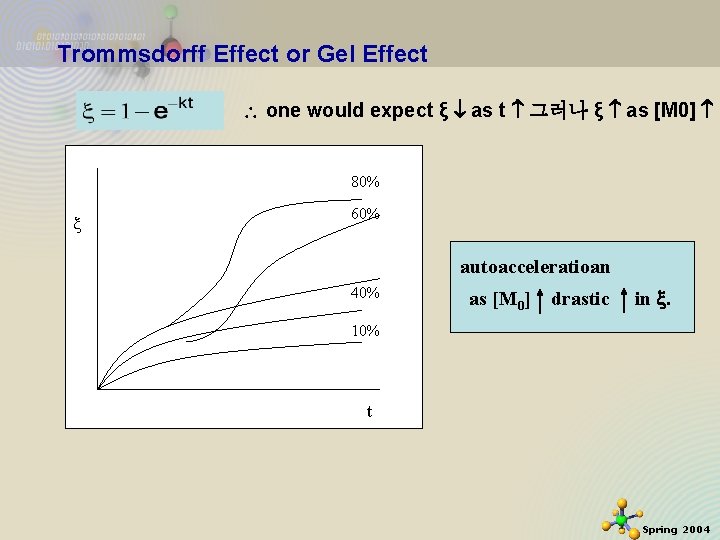
Trommsdorff Effect or Gel Effect Remember At CSTR conc const, Batch conc const. intergrat e 2020 -11 -27 46 Spring 2004

Trommsdorff Effect or Gel Effect one would expect ξ as t 그러나 ξ as [M 0] 80% 60% autoacceleratioan 40% as [M 0] drastic in . 10% t 2020 -11 -27 47 Spring 2004