Chane respiratoire et oxydation phosphorylante La chane respiratoire























- Slides: 38

Chaîne respiratoire et oxydation phosphorylante La chaîne respiratoire Les composants de la chaîne La théorie chimiosmotique Structure et fonction de l’ATPase mitochondriale Systèmes navette de NAD/NADH Agents découplants

Formation de NADH et FADH 2

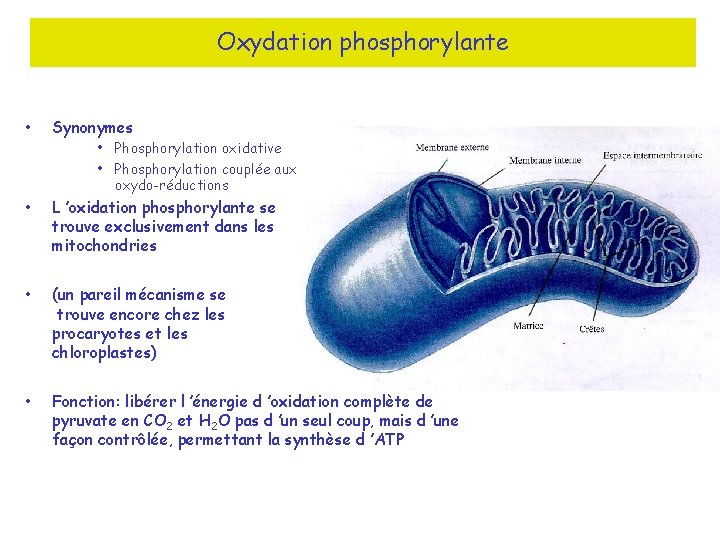
Oxydation phosphorylante • Synonymes • L ’oxidation phosphorylante se trouve exclusivement dans les mitochondries • (un pareil mécanisme se trouve encore chez les procaryotes et les chloroplastes) • Fonction: libérer l ’énergie d ’oxidation complète de pyruvate en CO 2 et H 2 O pas d ’un seul coup, mais d ’une façon contrôlée, permettant la synthèse d ’ATP • Phosphorylation oxidative • Phosphorylation couplée aux oxydo-réductions

Mitochondries • Le nombre de mitochondrie par cellule varie énormément: • • • Trypanosome: Levure: Muscle blanc: Muscle rouge: Foie: • Dimensions: 1 1 -10 peu (glycolyse) nombreuses (oxidation phoshorylante) 5000 • diamètre de 0. 2 -0. 8 µm • longueur de 0. 5 -1. 5 µm • Constituants: • • • membrane externe membrane interne espace intermembranaire crêtes matrice

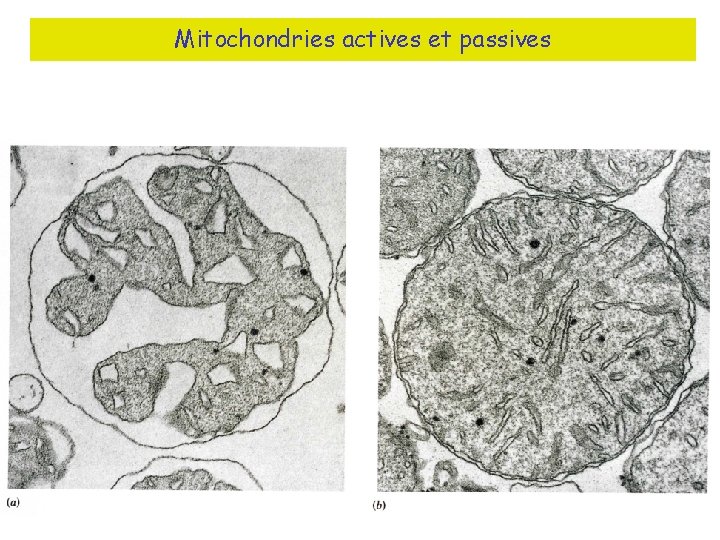
Mitochondries actives et passives

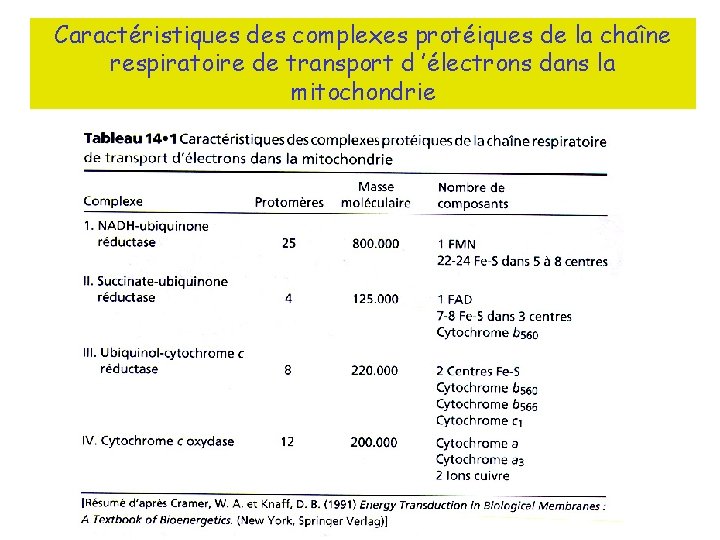
Caractéristiques des complexes protéiques de la chaîne respiratoire de transport d ’électrons dans la mitochondrie

Oxydation phosphorylante

Composants de la chaîne respiratoire • • Protéines avec un ou deux centres fer-soufre Protéines à FMN Ubiquinone Cytochromes

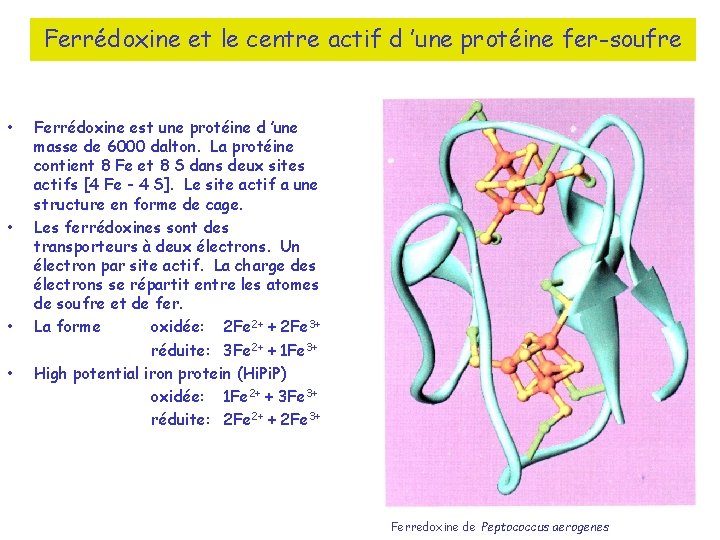
Ferrédoxine et le centre actif d ’une protéine fer-soufre • • Ferrédoxine est une protéine d ’une masse de 6000 dalton. La protéine contient 8 Fe et 8 S dans deux sites actifs [4 Fe - 4 S]. Le site actif a une structure en forme de cage. Les ferrédoxines sont des transporteurs à deux électrons. Un électron par site actif. La charge des électrons se répartit entre les atomes de soufre et de fer. La forme oxidée: 2 Fe 2+ + 2 Fe 3+ réduite: 3 Fe 2+ + 1 Fe 3+ High potential iron protein (Hi. P) oxidée: 1 Fe 2+ + 3 Fe 3+ réduite: 2 Fe 2+ + 2 Fe 3+ Ferredoxine de Peptococcus aerogenes

Composants de la chaîne respiratoire (2)

Composants de la chaîne respiratoire (3) • Les cytochromes – Cytochrome b (560 nm) – Cytochrome c (550 nm) – Cytochrome c 1 (553 nm, complex III) – Cytochrome a (600 nm, complex IV ou cytochrome oxidase) – Cytochrome a 3 (600 nm, complex IV ou cytochrome oxidase)

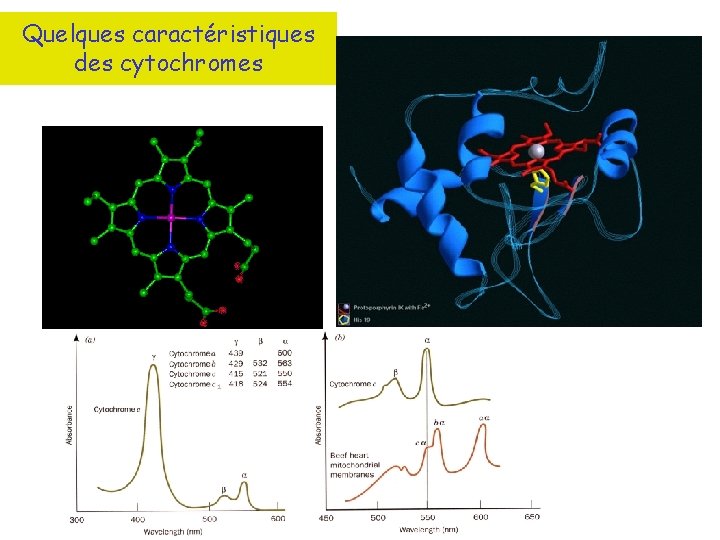
Quelques caractéristiques des cytochromes

Dans la chaîne respiratoire les porteurs d ’hydrogène et d ’électrons alternent • • Porteurs d ’hydrogène porteur + 2 H porteur -H 2 Porteurs d ’électrons porteur - Fe 3+ + H porteur -Fe 2+ + H+ Quand des porteurs d ’électrons sont réduits par des porteurs d ’hydrogène, des protons sont libérés Par contre, pendant la réduction des porteurs d ’hydrogènes par des porteurs d ’électrons, des protons sont utilisés

Formation d ’ATP par la chaîne respiratoire

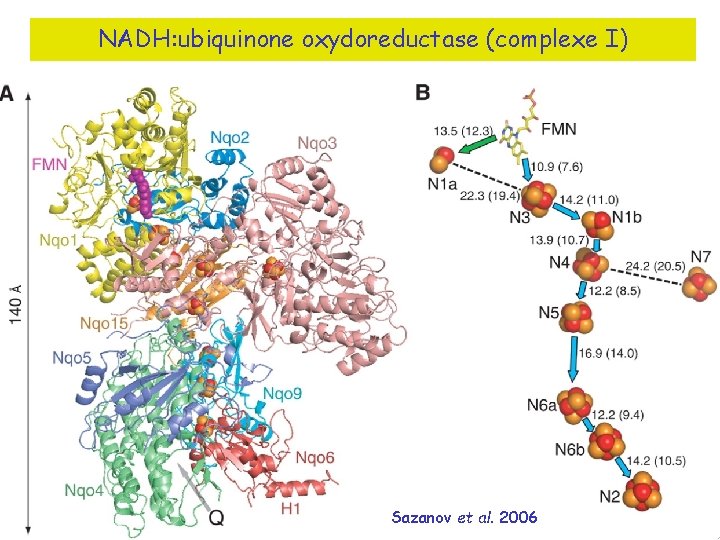
NADH: ubiquinone oxydoreductase (complexe I) Sazanov et al. 2006

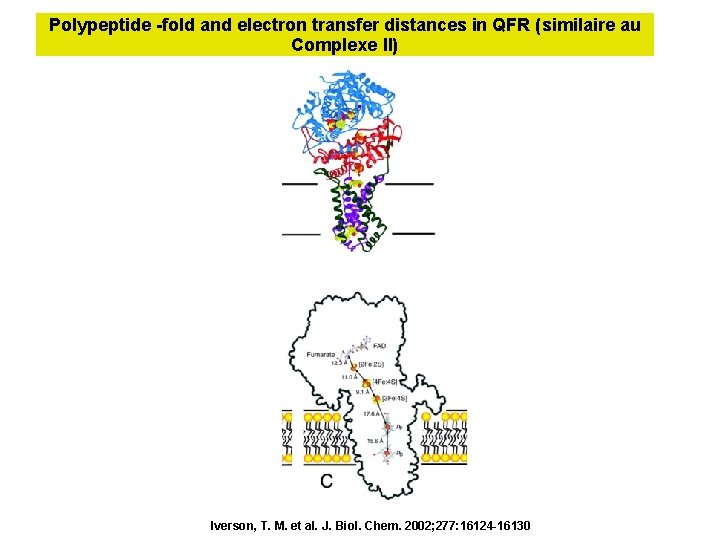
Polypeptide -fold and electron transfer distances in QFR (similaire au Complexe II) Iverson, T. M. et al. J. Biol. Chem. 2002; 277: 16124 -16130

Complexe III

Ubiquinone: cytochrome c oxydoreductase (complexe III) Cyt c Hème c 1 Fe. S Hème b. L Hème b. H Lange and Hunte, 2002

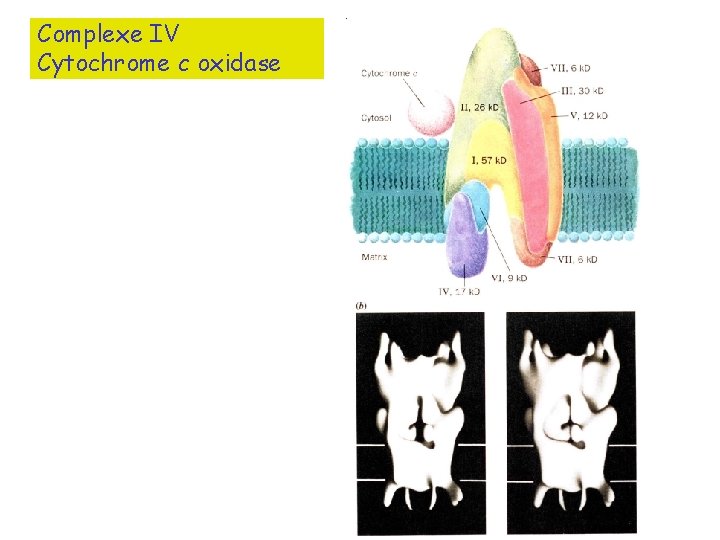
Complexe IV Cytochrome c oxidase

Le potentiel de réduction • Aréd • Box + 2 e • Aréd + Box Aox + 2 e. Bréd Aox + Bréd • ∆G°’ = -n. F∆E°’ • ∆E°’ = -2, 3 RT log Kéq Equation de Nernst n. F • ∆E = ∆E°’ -2, 3 RT log [Aox] [Bréd ] n. F • ∆E = ∆E°’ 0, 059 log. Q n [Aréd] [Box]

Potentiels de réduction standard Demi-réaction de réduction 1/2 O 2 + 2 H+ + 2 e- ---> H 2 O Fe 3+ + e- ---> Fe 2+ Cytochrome a, Fe 3+ + e- ---> Fe 2+ Cytochrome c, Fe 3+ + e- ---> Fe 2+ Ubiquinone (Q) + 2 H+ + 2 e- ---> QH 2 Cytochrome b, Fe 3+ + e- ---> Fe 2+ Fumarate + 2 H+ + 2 e- ---> Succinate Oxaloacétate + 2 H+ + 2 e- ---> Malate Pyruvate + 2 H+ + 2 e- ---> Lactate FMN + 2 H+ + 2 e- ---> FMNH 2 FAD + 2 H+ + 2 e- ---> FADH 2 NAD + 2 H+ + 2 e- ---> NADH + H+ Ferrédoxine, Fe 3+ + e- ---> Fe 2+ 2 H+ + 2 e- ---> H 2 E°’(V) 0, 82 0, 77 0, 29 0, 25 0, 10 0, 08 0, 03 -0, 17 -0, 18 -0, 22 -0, 32 -0, 43 -0, 42

Architecture de la chaîne respiratoire

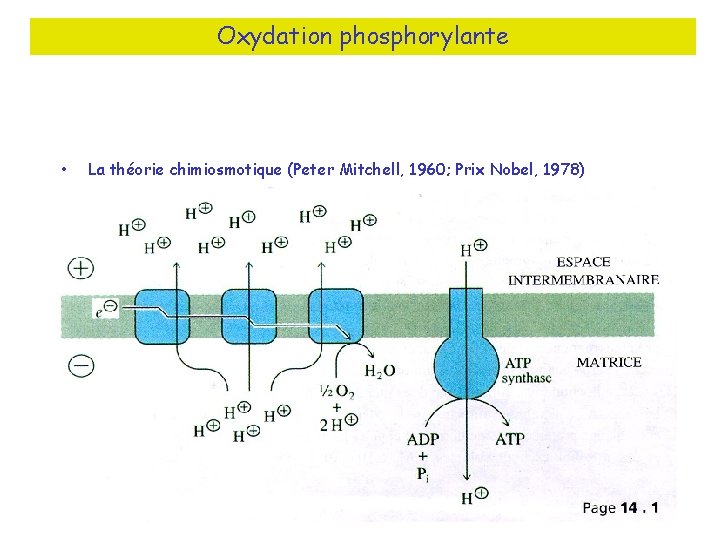
Oxydation phosphorylante • La théorie chimiosmotique (Peter Mitchell, 1960; Prix Nobel, 1978)

La force proton motrice ∆p est exprimé en volt • ∆Gchim = 2. 3 n RT (p. Hint-p. Hext) • ∆Gélec =n F∆ Y • ∆G = ∆ Gchim + ∆Gélec = 2. 3 n RT (∆p. H) + n F∆ Y • ∆G / n F = ∆ Y + (2. 3 RT (∆p. H) / F) • Z = 2. 3 RT /F • ∆p = ∆ Y + Z ∆p. H (Z = 59 m. V à 25°C)

La force proton motrice ∆p • DP consiste de deux composants: • 1. Le potentiel de membrane (Dy) • 2. Le gradient de protons (Dp. H) • Les valeurs typiques pour les mitochondries sont: p. H = 0, 75 Dy = 0, 14 V Dp = Dy + ZDp. H = 0, 14 V + (0, 059 V)x (0, 75) = 0, 18 V = 180 m. V • Chez E. coli (à p. H = 6) p. Hint = 7. 8 Dy = 95 m. V Dp = 200 m. V

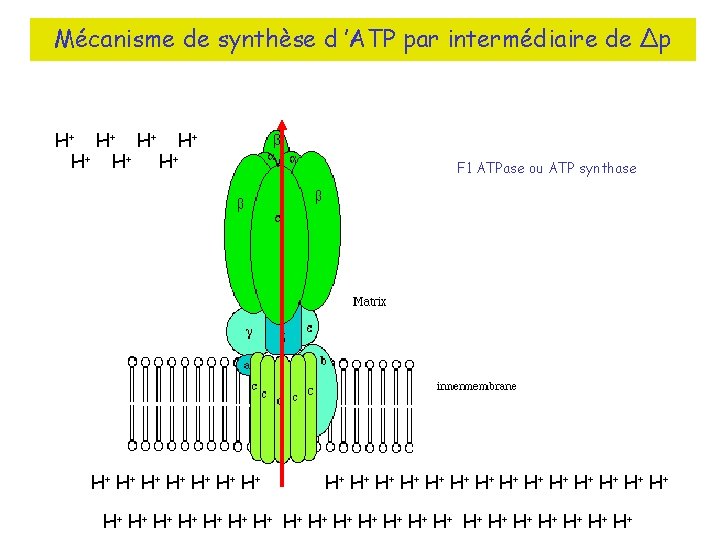
Mécanisme de synthèse d ’ATP par intermédiaire de ∆p H+ H + H + H + H + F 1 ATPase ou ATP synthase H+ H + H + H + H + H + H + H+ H + H + H +

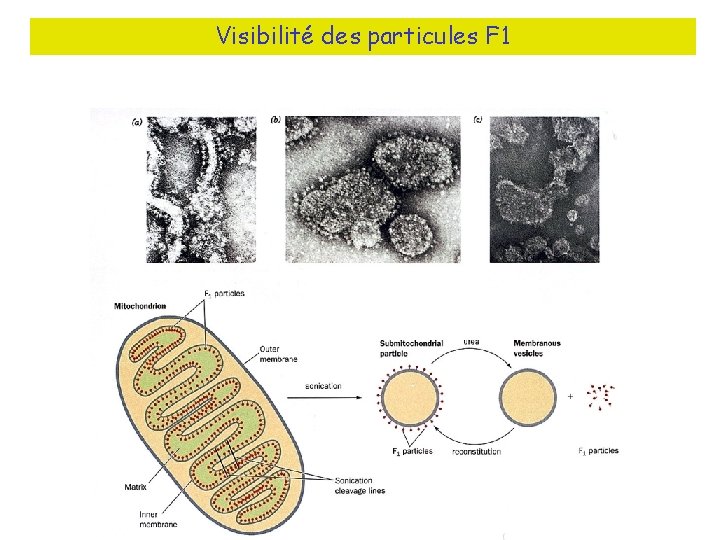
Visibilité des particules F 1

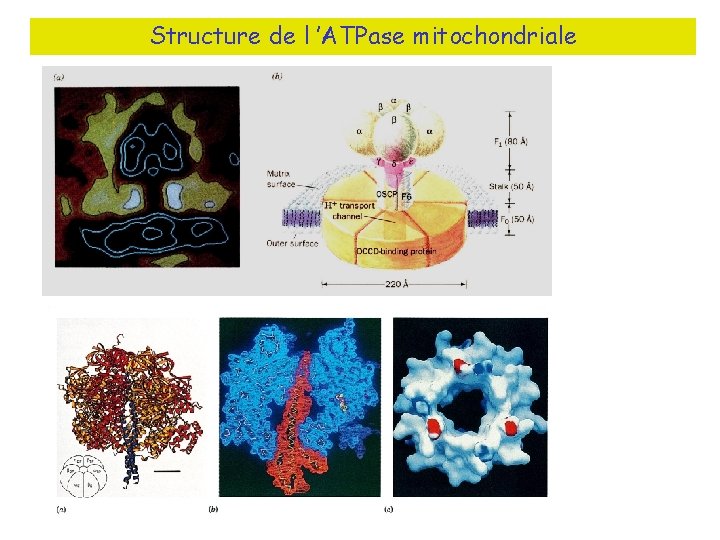
Structure de l ’ATPase mitochondriale

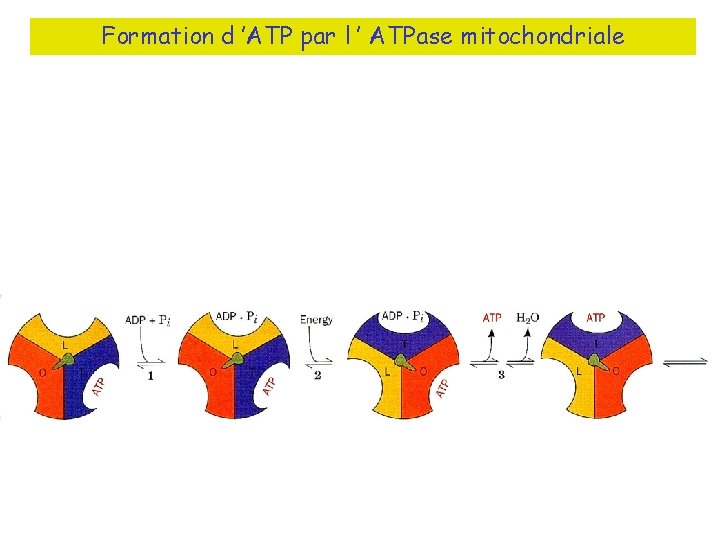
Formation d ’ATP par l ’ ATPase mitochondriale

Moteur moléculaire d’ATPase

An animation showing why the F 1 motor is rotating counter clockwise and how the chemical reaction and the rotation are coordinated by two switches: switch 1 (red) controls the ATP binding; switch 2 (blue) controls the phosphate release.

A perspective view of alpha 3 beta 3 gamma in spacefill display with specular highlights.

A perspective view of alpha 3 beta 3 gamma in cartoon display (frames are generated using Molscript).

GRT video of ATP synthase Available from You. Tube http: //www. youtube. com/watch? v=u. Oo. HKCMAUMc

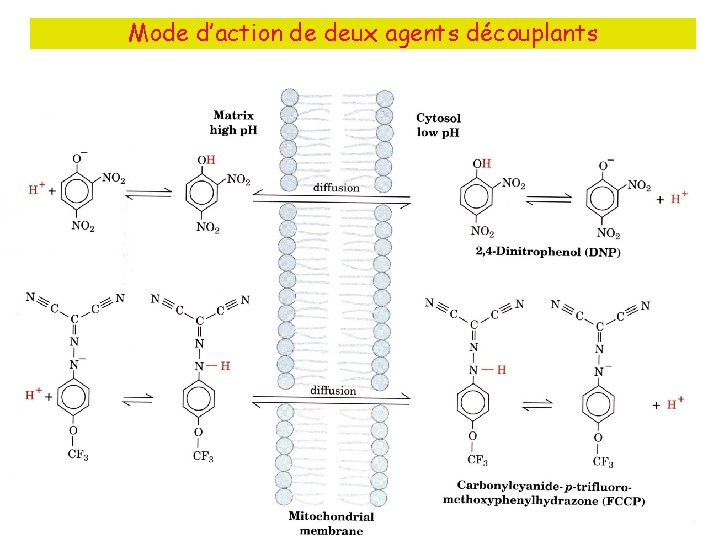
Mode d’action de deux agents découplants • Fig. 4. 12, 4. 13

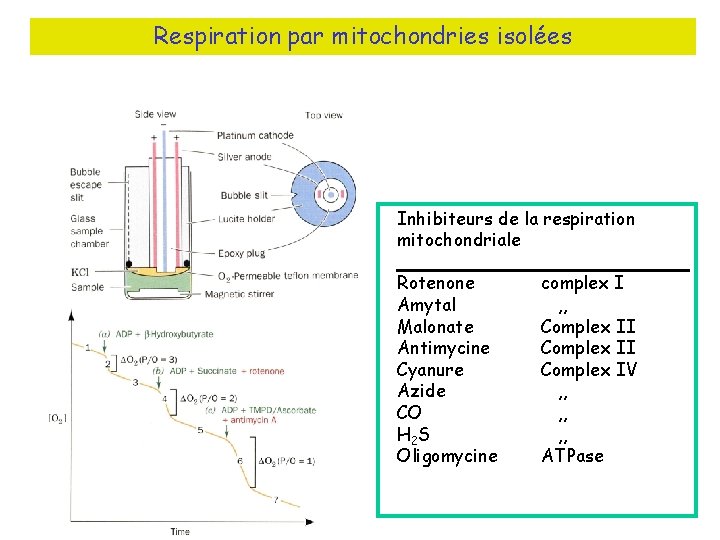
Respiration par mitochondries isolées Inhibiteurs de la respiration mitochondriale Rotenone Amytal Malonate Antimycine Cyanure Azide CO H 2 S Oligomycine complex I , , Complex II Complex IV , , , ATPase

Les systèmes navette assurant l ’oxydation du NADH du cytosol (1)

Les systèmes navette assurant l ’oxydation du NADH du cytosol (2)
 Amytal mechanism of action
Amytal mechanism of action Ou a lieu la glycolyse
Ou a lieu la glycolyse Explosimètre oxydation catalytique
Explosimètre oxydation catalytique Degré d'oxydation calcul
Degré d'oxydation calcul Murakoze chane
Murakoze chane Omar chane contact info
Omar chane contact info Cla 30 respiratoire
Cla 30 respiratoire Mouvement respiratoire
Mouvement respiratoire Chaine respiratoire
Chaine respiratoire Test respiratoire a l'urée
Test respiratoire a l'urée Formation en ligne protection respiratoire
Formation en ligne protection respiratoire Organes respiratoires du dauphin
Organes respiratoires du dauphin Organes respiratoires des animaux aquatiques
Organes respiratoires des animaux aquatiques Encombrement respiratoire
Encombrement respiratoire Merci de votre attention
Merci de votre attention