Cara Pemeriksaan LCS Liquor Cerebrospinalis atau yang biasa

Cara Pemeriksaan LCS

• Liquor Cerebrospinalis atau yang biasa disingkat LCS adalah cairan yang menyelimuti susunan syaraf pusat. • Fungsinya adalah sebagai pelindung terhadap otak maupun tulang belakang. Selain itu juga berfungsi sebagai pengatur eksitabilitas dengan mengatur komposisi ion, membawa keluar metabolit-metabolit (karena otak tidak mempunyai pembuluh limpe) dan memberikan perlindungan terhadap tekanan. • Liquour Cerebrospinalis adalah cairan otak yang diambil melalui lumbal punksi. • Kelainan hasil pemeriksaan dapat memberikan petunjuk ke arah suatu penyakit susunan saraf pusat, baik kasus akut maupun kronis yang akan diberikan tindakan lebih lanjut oleh klinisi berupa pemberikan terapi adekuat. • Pemeriksaan Liquor Cerebrospinalis ditujukan untuk mengetahui adanya kelainan pada otak maupun sumsum tulang, meningitis, tumor, abses, enchefilitis maupun infeksi virus pada daerah tersebut.
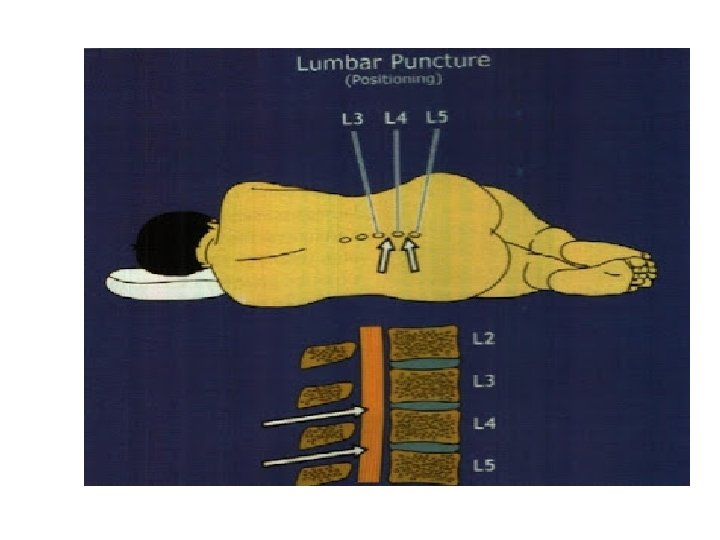

Pemeriksaan terhadap LCS terdiri atas : a. b. c. Pemeriksaan Rutin - makroskopis - mikroskopis - kimia - bakteriologi Pemeriksaan Fisik - tekanan Pemeriksaan Khusus - elektroforesa protein - imunoelektroforesa - serologi - imunoglobulin

MAKROSKOPIS Pemeriksaan makroskopis meliputi – Warna – Kekeruhan – p. H – Konsistensi (bekuan) – Berat jenis • Metode : Visual (Manual) • Tujuan Untuk mengetahui cairan LCS secara makroskopik meliputi : warna, kejernihan, bekuan, p. H dan BJ. • Alat : Tabung reaksi Beaker gelas Kertas indikator p. H universal Refraktometer abbe • Spesimen : Cairan LCS

• Prinsip : pada keadaan normal wujud LCS seperti air, dengan membandingkannya dapat dinilai adanya perubahan pada LCS. • Cara Kerja : A. Tes Warna, Kekeruhan, dan Bekuan - Tabung reaksi diisi aquadest secukupnya sebagai pembanding. - Contoh bahan diisikan pada tabung reaksi yang sama ukurannya dengan pembanding. - Kedua tabung diletakkan berdekatan dengan latar belakang kertas putih. - Bandingkan contoh bahan dengan aquadest. B. Tes Berat Jenis Cairan LCS diteteskan 1 -2 tts dan diperiksa pada BJ eye piece
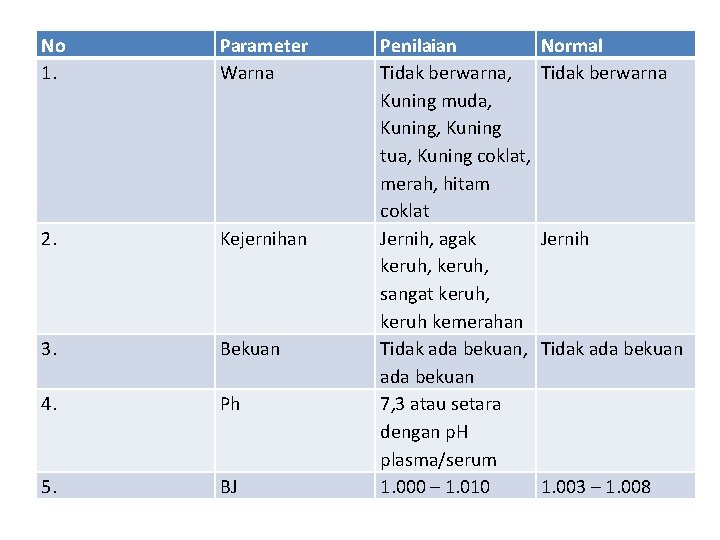
No 1. Parameter Warna 2. Kejernihan 3. Bekuan 4. Ph 5. BJ Penilaian Tidak berwarna, Kuning muda, Kuning tua, Kuning coklat, merah, hitam coklat Jernih, agak keruh, sangat keruh, keruh kemerahan Tidak ada bekuan, ada bekuan 7, 3 atau setara dengan p. H plasma/serum 1. 000 – 1. 010 Normal Tidak berwarna Jernih Tidak ada bekuan 1. 003 – 1. 008

MIKROSKOPIS • Syarat pemeriksaan : Dilakukan dlm waktu < 30’, karena bila > 30’ jml sel akan berkurang yang disebabkan: - Sel mengalami sitolisis - Sel akan mengendap, shg sulit mendapat sampel yang homogen - Sel terperangkap dalam bekuan - Sel cepat mengalami perubahan morfologi

Hitung Jumlah Sel • Metode : Bilik Hitung • Prinsip : LCS diencerkan dengan larutan Turk pekat akan ada sel leukosit dan sel lainnya akan lisis dan dihitung selnya dalam kamar hitung di bawah mikroskop. • Tujuan : Untuk mengetahui jumlah sel dalam cairan LCS. • Alat dan Reagensia : - Mikroskop - Hemaocytometer : Bilik hitung Improved neubauer, kaca penutup, pipet thoma leukosit - Larutan Turk Pekat : Kristal violet 0, 1 gram, asam asetat glacial 10 m. L dan aquadest 90 m. L.

• Cara Kerja : - Larutan Turk pekat diisap sampai tanda 1 tepat - Larutan LCS diisap sampai tanda 11 tepat. - Dikocok perlahan dibuang cairan beberapa tetes. - Diteteskan pada bilik hitung dan dihitung sel dalam kamar hitung pada semua kotak leukosit di mikroskop lensa objektif 10 x/40 x. • Perhitungan : Ʃ Sel = Jumlah sel ditemukan x 1 x pengenceran Jumlah kotak L T = ……. . sel/mm 3 LCS • Ket : T : tinggi bilik hitung : 1/10 mm L : luas 1 satuan kotak yang dipakai • Interpretasi : Jumlah sel normal = 0 – 5 sel/mm 3 LCS

Hitung Jenis Sel • Metode : Tetes tebal dengan pewarnaan Giemsa • Tujuan : Untuk membedakan dan mengetahui jumlah masing-masing jenis sel mononuklear dan polinuklear dalam cairan LCS • Alat dan Reagensia : - Objek Gelas - Kaca Penghapus - Sentrifuge - Timer - Tabung reaksi - Metanol absolut - Giemsa

• Cara Kerja : - Cairan LCS di masukkan dalam tabung secukupnya. - Disentrifugasi selama 5 menit 2000 rpm - Supernatant dibuang dan endapan diambil. - Diteteskan pada objek gelas dan dibuat preparat hapusan tebal - Di keringkan difiksasi selama 2 menit dengan metanol absolut. - Diwarnai dengan Giemsa selama 15 -20 menit. - Dicuci dan diperiksa dimikroskop lensa objektif 100 x denga imersi. Jenis sel 1 2 3 4 5 6 7 MN PMN Jumlah • Interpretasi : Normal MN 100% dan PMN 0% 8 9 10 Jumlah %

Bakterioskopi • Dari pemeriksaan bakteliologi terhadap LCS, bakteri yang sering muncul ialah : Mycobacterium tuberculosa, Neisseria meningitidis, Streptococcus pneumoniae, dan Haemophillus influenzae. • Dengan melakukan pemeriksaan bakteriologi, sering sudah di dapatkan petunjuk ke arah etiologi radang. • Pemeriksaan yang paling diperlukan adalah pewarnaan Gram dan Ziehl Neelsen. • Specimen yang dipakai untuk pewarnaan ini sebaiknya memakai sedimen dari LCS. Untuk pewarnaan tahan asam (Ziehl Neelsen) baik juga dipakai specimen bekuan halus dekat permukaan LCS.

KIMIAWI • Analisa kimia LCS membantu diagnosis / menilai prognosis. • Pemeriksaan rutin yang dilakukan : - penetapan protein secara kualitatif - kadar protein - kadar glukosa - kadar klorida

Protein Kualitatif • Keadaan normal cairan otak mengandung sedikit sekali protein • Perbandingan antara albumin dan globulin LCS leih kecil daripada dalam plasma • Konsentrasi protein ↑ : - Permeabilitas sawar darah-otak ↑ oleh radang - Meningitis yang berat

A. Pandy • Prinsip : reagen pandy memberikan reaksi terhadap protein (albumin dan globulin) dalam bentuk kekeruhan. Pada keadaan normal tidak terjadi kekeruhan atau kekeruhan yang ringan seperti kabut. • Alat dan reagen yang dipakai - Tabung serologi (garis tengah 7 mm) - Kertas putih - Reagen Pandy (larutan phenol jenuh dalam air) • Cara pemeriksaan : - Ke dalam tabung serologi dimasukkan 1 ml reagen Pandy - Tambahkan 1 tetes LCS - Kemudian dilihat segera ada tidaknya kekeruhan. • Interprestasi hasil - Negatif : tidak ada kekeruhan - Positif : terlihat kekeruhan yang jelas +1 : opalescent (kekeruhan ringan seperti kabut) +2 : keruh +3 : sangat keruh +4 : Kekeruhan seperti susu • Nilai normal : (-) / (+1)

B. Nonne Apelt • Prinsip : reagen Nonne memberikan reaksi terhadap protein globulin dalam bentuk kekeruhan yang berupa cincin. Ketebalan cincin berhubungan dengan kadar globulin, makin tinggi kadarnya maka cincin yang terbentuk semakin tebal • Alat dan reagen yang dipakai : - Tabung serologi (garis tengah 7 mm) - Reagen Nonne (larutan ammonium sulfat jenuh dalam air) • Cara pemeriksaan : - Ke dalam tabung serologi dimasukkan 1 ml reagen Nonne - Tambahkan 1 ml LCS dengan cara pelan-pelan sehingga terbentuk 2 lapisan, dimana lapisan atas adalah LCS - Diamkan selama 3 menit. - Kemudian dilihat pada perbatasan kedua lapisan dengan latar belakang gelap • Interprestasi hasil : Negatif : tidak terbentuk cincin antara kedua lapisan +1 : cincin yang terbentuk menghilang setelah dikocok (tidak ada bekasnya). +2 : setelah dikocok terjadi opalesensi +3 : mengawan setelah dikocok • Normal : (-)

Protein Kuantitatif • Metode • Prinsip : Protein dalam sampel bereaksi dengan ion cupri (II) dalam medium alkali membentuk komplek warna yang dapat diukur dengan spektrofotometer • Tujuan • Alat : - Tabung reaksi - Mikropipet 20 µLdan 1000 µL. - Tip kuning dan biru. - Fotometer • : Biuret : Untuk menetapkan kadar protein dalam LCS. Reagensia : - Reagen Kerja: Cupri (II) asetat 6 mmol/L, Kalium Iodida 12 mmol/L, Na. OH 1, 15 mol/L, deterjen. - Reagen standard : 8, 0 g/d. L - Stabilitas : Reagensia stabil setelah dibuka sampai kadaluarsa bila disimpan pada suhu ruang.

• Cara Kerja : -Masukkan ke dalam tabung berlabel Standar Serum Blanko - Standar 20 µl - Sampel 20 μl Reagen kerja 1000 μl - Campur dan inkubasi selama 10 menit pada suhu ruang. - Diukur absorben standar dan sampel pada Photometer gelombang 578 nm terhadap blanko reagent. • Perhitungan : Total Protein = Absorben sampel x konsentrasi standar (8, 0 g/d. L) Absorben standard =. . . g/d. L x 1000 =. . . mg/d. L • Nilai Normal : 15 – 45 mg/dl dengan panjang

Glukosa Kuantitatif • Menyusutnya kadar glukosa dalam LCS meningitis purulenta (metabolisme leukosit & bakteri ↓ kadar glukosa 0). • Semua mikroorganisme menggunakan glukosa pe↓ kadar glukosa dapat disebabkan oleh : fungi, protozoa, bakteri tuberculosis, dan bakteri piogen. • Meningitis oleh virus sedikit me↓ kadar glukosa dalam LCS.

Metode : GOD-PAP Prinsip : Glukosa dioksidasi oleh glukosa oksidase menghasilkan hidrogen peroksida yang bereaksi dengn 4 -aminoantipirin dan fenol dengan pengaruh katalis peroksidase menghasilkan quinoneimine yang berwarna merah. • Tujuan : Untuk menentukan kadar glukosa dalam LCS • • • - Reaksi : Glukosa + ½ O 2 + 2 H 2 O glukosa oxidase Glukonate + H 2 O 2. 2 H 2 O 2 + 4 -Aminoantipyrine + Phenol POD Quinoneimine + 4 H 2 O Alat : Tabung reaksi kecil - Timer Mikropipet 10 dan 1000 µl - Tissue Tip kuning dan biru - Rak Tabung Fotometer Reagensia : Reagen kerja Glukosa Reagen standar Glukosa 100 mg/dl Stabilitas : Reagensia stabil setelah dibuka sampai kadaluarsa bila disimpan pada suhu 2 -8 o. C.

• Cara kerja: - Dipipet ke dalam tabung: Standar Serum Reagen kerja Blanko - Standar 10 µl - Sampel 10 µl 1000 µl - Dicampur dan diinkubasi pada suhu ruang selama 10 menit. - Diukur absorben standar dan sampel pada Photometer terhadap blanko dengan panjang gelombang 546 nm. • • • Pengamatan dan Pembacaan : Absorben blanko aquabidest : 0, 000 Dicatat Absorben pengukuran reagent blanko, standar dan sampel Perhitungan : Glukosa = Absorben sampel x konsentrasi standard (100 mg/d. L) Absorben standard =. . . mg/d. L Nilai Normal : 45 – 70 mg/d. L

Chlorida Kuantitatif • Metode : TPTZ • Prinsip : Ion Chlorida bereaksi dengan Mercury (II), 2, 4, 4 tri-(2 pyridil)-S-triazide kompleks (TPTZ) membentuk merkuri (II) chlorida. TPTZ bebas bereaksi dengan ion besi (II) menghasilkan warna biru kompleks. Perubahan absorben pada 578 nm sebanding dengan kadar chlorida.

• Cara Kerja : Blanko Standar Sampel Standar - 10 µl - Serum - - 10 µl Reagen kerja 1000 µl - Dipipet ke dalam tabung: - Dicampur dan diinkubasi pada suhu ruang selama 10 menit. - Diukur absorben standar dan sampel pada Photometer terhadap blanko dengan panjang gelombang 546 nm. • Perhitungan : Chlorida = Absorben sampel x konsentrasi standard (100 mmol/L) Absorben standard =. . . mmol/L • Nilai Normal : 98 - 106 mmol/L

Terima Kasih
- Slides: 25