Captulo 2 James Joule 1818 1889 2 1
















- Slides: 38

Capítulo 2 James Joule (1818 -1889) 2. 1 2. 2 2. 3 2. 4 2. 5 2. 6 2. 7 Calor e Energia Interna Calor Específico e Calorimetria Calor Latente Trabalho e Calor em Processos Termodinâmicos Primeiro Princípio da Termodinâmica Algumas Aplicações do Primeiro Princípio da Termodinâmica Mecanismos de Transferência de Energia em Processos Térmicos 1

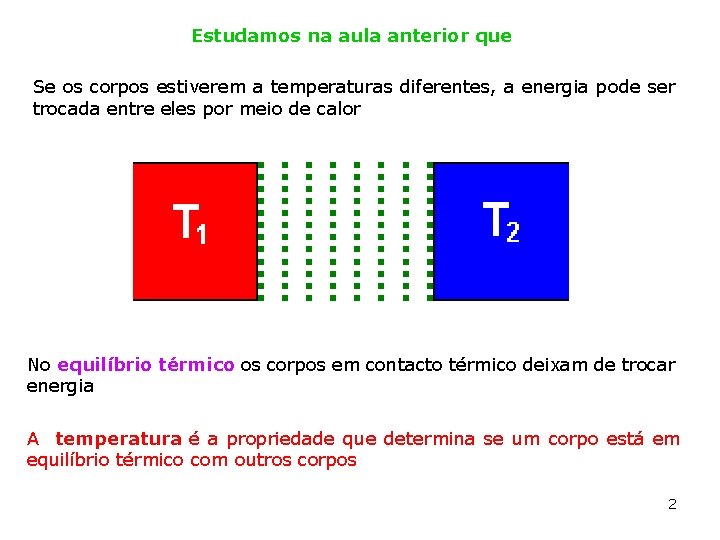
Estudamos na aula anterior que Se os corpos estiverem a temperaturas diferentes, a energia pode ser trocada entre eles por meio de calor No equilíbrio térmico os corpos em contacto térmico deixam de trocar energia A temperatura é a propriedade que determina se um corpo está em equilíbrio térmico com outros corpos 2

2. 1 Calor e Energia Interna Até ~1850, a Termodinâmica e Mecânica eram considerados dois ramos distintos da Ciência Experimentos realizados em meados do século XIX pelo físico inglês James Joule e outros cientistas, demonstraram que a energia pode entrar num sistema (ou abandoná-lo), através do calor e do trabalho Hoje a energia interna é tratada como uma forma de energia que pode ser transformada em energia mecânica e vice-versa 3

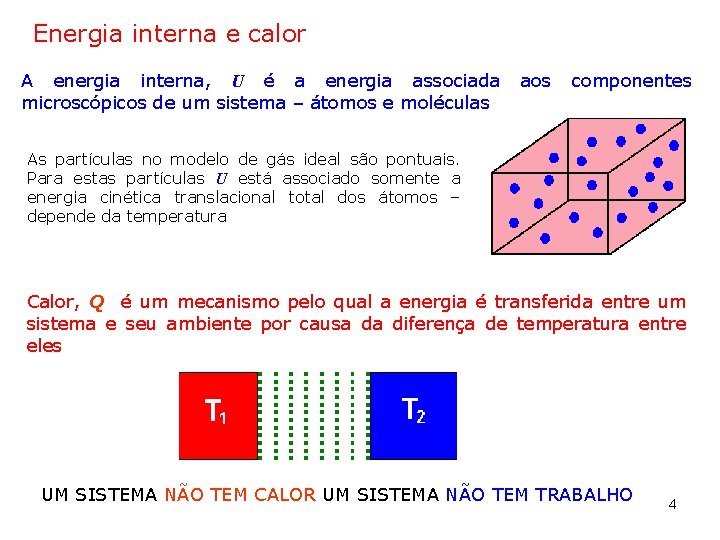
Energia interna e calor A energia interna, U é a energia associada microscópicos de um sistema – átomos e moléculas aos componentes As partículas no modelo de gás ideal são pontuais. Para estas partículas U está associado somente a energia cinética translacional total dos átomos – depende da temperatura Calor, Q é um mecanismo pelo qual a energia é transferida entre um sistema e seu ambiente por causa da diferença de temperatura entre eles UM SISTEMA NÃO TEM CALOR UM SISTEMA NÃO TEM TRABALHO 4

Unidades de calor Antes dos cientistas reconhecerem que havia uma ligação entre a termodinâmica e a mecânica, o calor era definido em termos das variações de temperatura que ele produzia num corpo, e utilizava-se uma unidade separada de energia, a caloria, para o calor. A caloria (cal) era definida como o calor necessário para elevar a temperatura de 1 g de água de para Em 1948, os cientistas concordaram que, como o calor (assim como o trabalho) é uma medida da transferência de energia, e sua unidade no SI deveria ser o joule Equivalente mecânico de calor Dispositivo de Joule para determinar a relação da caloria e joule O trabalho realizado sobre a água pelos pesos em queda (em joules), rodam as pás produzindo um aumento de temperatura, equivalente à absorção, pela água, de uma determinada quantidade de calor (em calorias) 5

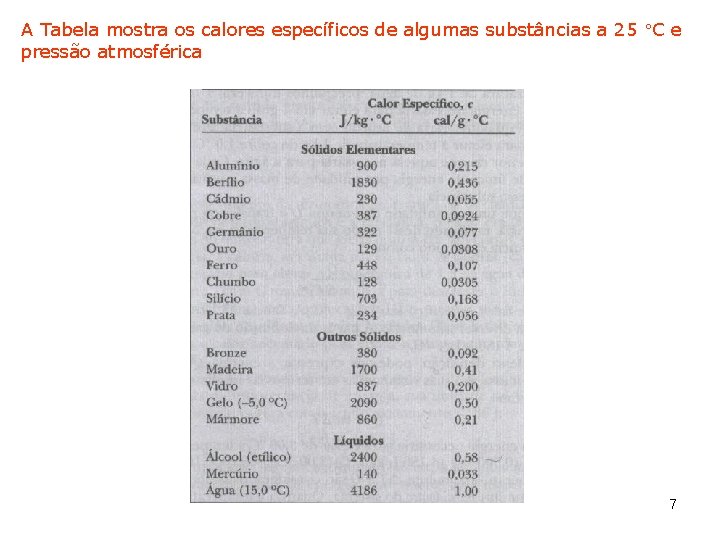
2. 2 Calor Específico e Calorimetria O calor específico c de um substância é Q é a energia transferida para a massa m de uma substância, fazendo com que a sua temperatura varie de As unidades do calor específico são J/kg· C A energia Q transferida do meio para um sistema de massa m varia a sua temperatura de O calor específico elevado da água comparado com a maioria das outras substâncias comuns (Tabela) é responsável pelas temperaturas moderadas nas regiões próximas de grandes volumes de água 6

A Tabela mostra os calores específicos de algumas substâncias a 25 C e pressão atmosférica 7

O ar mais frio empurra o ar quente (menos denso) mais para cima, de acordo com o princípio de Arquimedes 8

Calorimetria Técnica para medir o calor específico de um sólido ou de um líquido 9

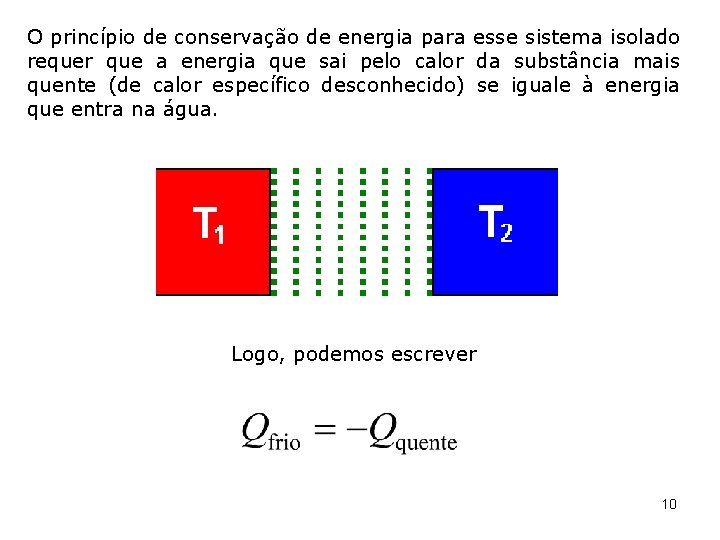
O princípio de conservação de energia para esse sistema isolado requer que a energia que sai pelo calor da substância mais quente (de calor específico desconhecido) se iguale à energia que entra na água. Logo, podemos escrever 10

Água de massa M (ma) Corpo de massa m (mx) ca - calor específico da água Ta - temperatura inicial da água cx - calor específico do corpo Tx - temperatura inicial do corpo T – temperatura de equilíbrio final após a água e a substância se combinarem Obtemos o calor específico do corpo Para medidas mais precisas é necessário levar em conta o calorímetro 11

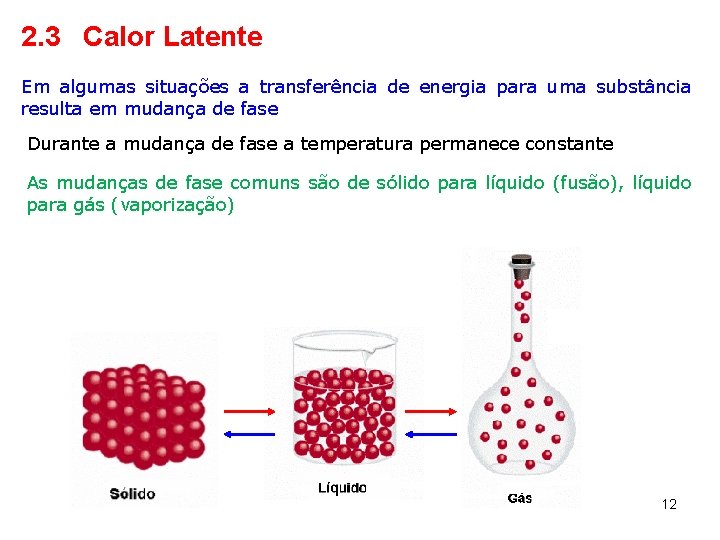
2. 3 Calor Latente Em algumas situações a transferência de energia para uma substância resulta em mudança de fase Durante a mudança de fase a temperatura permanece constante As mudanças de fase comuns são de sólido para líquido (fusão), líquido para gás (vaporização) 12

A transferência de energia necessária para a mudança de fase de uma dada substância de massa m de uma substância pura é L - calor latente da substância depende da natureza da mudança de fase e da substância O calor latente de fusão é a energia necessária para romper todas as ligações intermoleculares num quilograma de uma substância de maneira a converter a fase sólida em fase líquida. fusão ou congelamento calor de fusão O calor latente de vaporização é a energia que deve ser adicionada a um quilograma da fase líquida de uma substância para romper todas as ligações de maneira a formar um gás evaporação ou condensação calor de evaporação 13

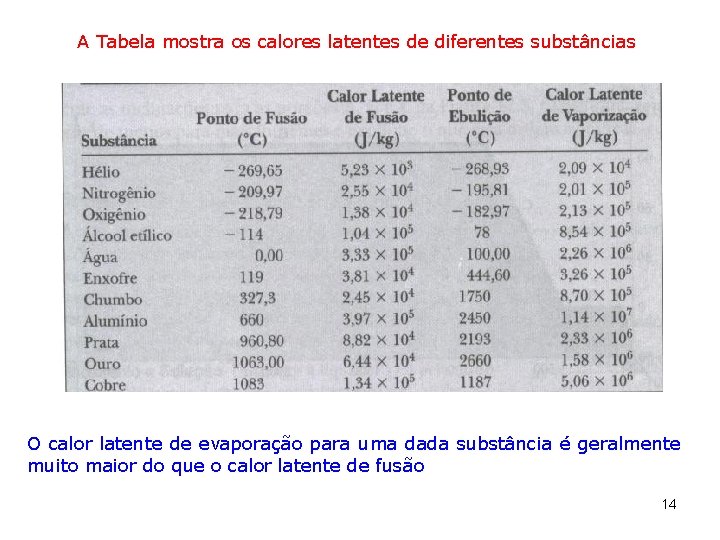
A Tabela mostra os calores latentes de diferentes substâncias O calor latente de evaporação para uma dada substância é geralmente muito maior do que o calor latente de fusão 14

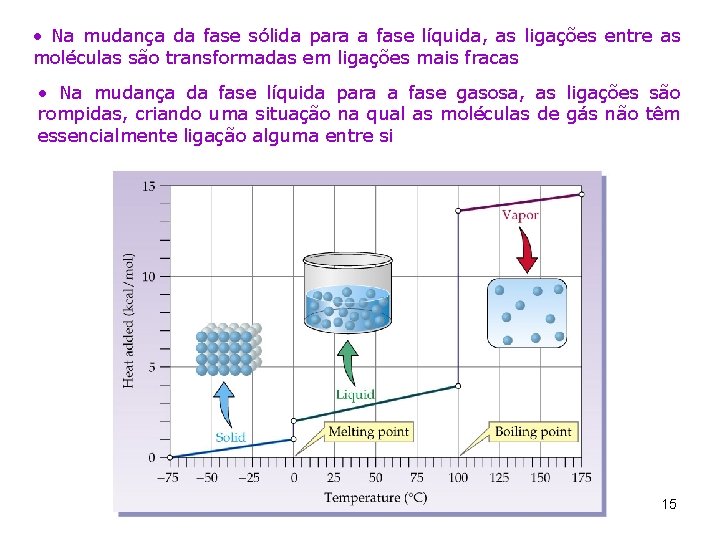
• Na mudança da fase sólida para a fase líquida, as ligações entre as moléculas são transformadas em ligações mais fracas • Na mudança da fase líquida para a fase gasosa, as ligações são rompidas, criando uma situação na qual as moléculas de gás não têm essencialmente ligação alguma entre si 15

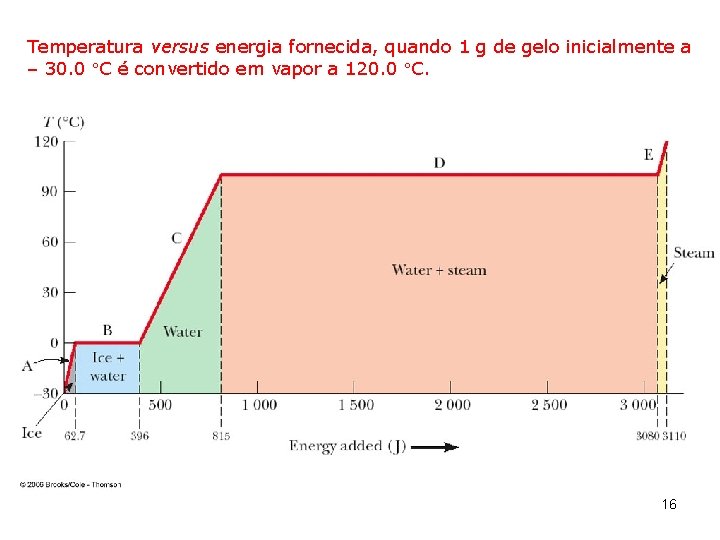
Temperatura versus energia fornecida, quando 1 g de gelo inicialmente a – 30. 0 C é convertido em vapor a 120. 0 C. 16

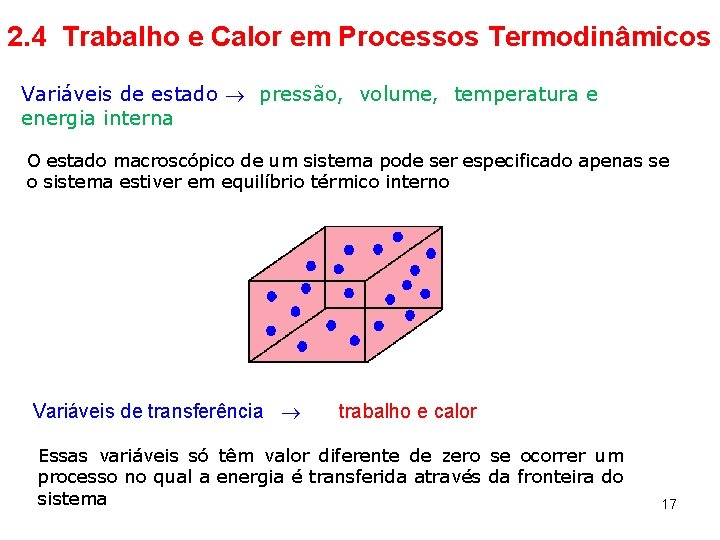
2. 4 Trabalho e Calor em Processos Termodinâmicos Variáveis de estado pressão, volume, temperatura e energia interna O estado macroscópico de um sistema pode ser especificado apenas se o sistema estiver em equilíbrio térmico interno Variáveis de transferência trabalho e calor Essas variáveis só têm valor diferente de zero se ocorrer um processo no qual a energia é transferida através da fronteira do sistema 17

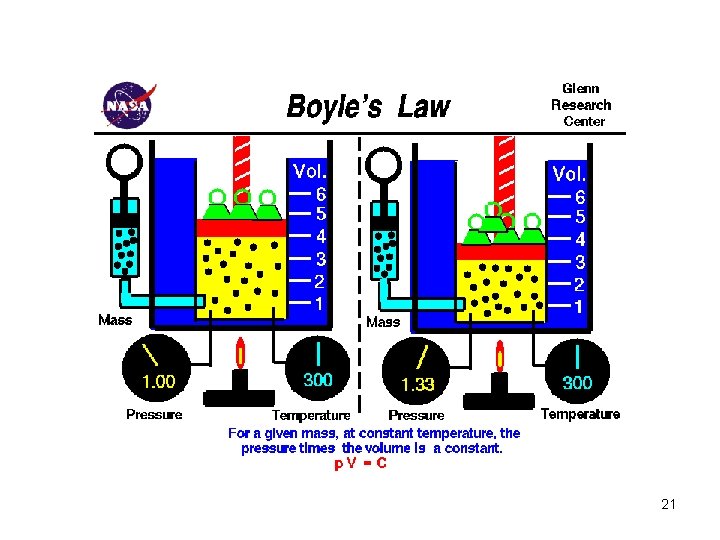
• Trabalho realizado por um sistema deformável – o gás O gás ocupa um volume V e exerce uma pressão P nas paredes do cilindro e no pistão O gás é expandido quasi-estaticamente, isto é, devagar o suficiente para permitir que o sistema se mantenha em equilíbrio térmico em todos os instantes porque 18

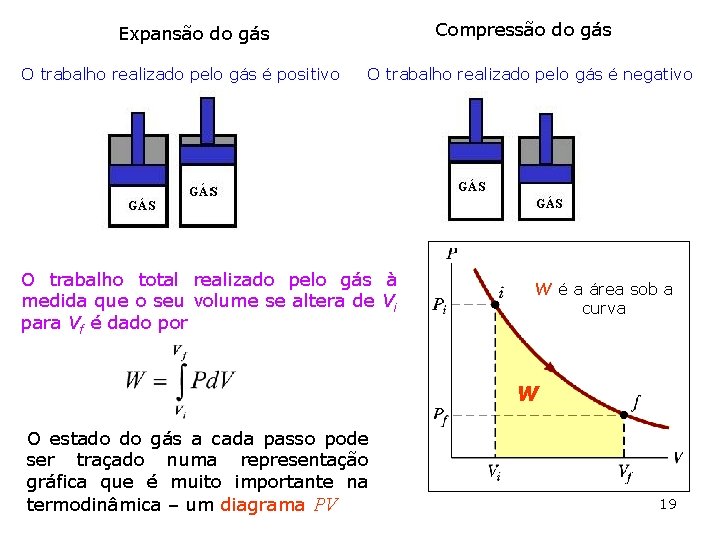
Compressão do gás Expansão do gás O trabalho realizado pelo gás é positivo O trabalho realizado pelo gás é negativo O trabalho total realizado pelo gás à medida que o seu volume se altera de Vi para Vf é dado por W é a área sob a curva W O estado do gás a cada passo pode ser traçado numa representação gráfica que é muito importante na termodinâmica – um diagrama PV 19

20

21

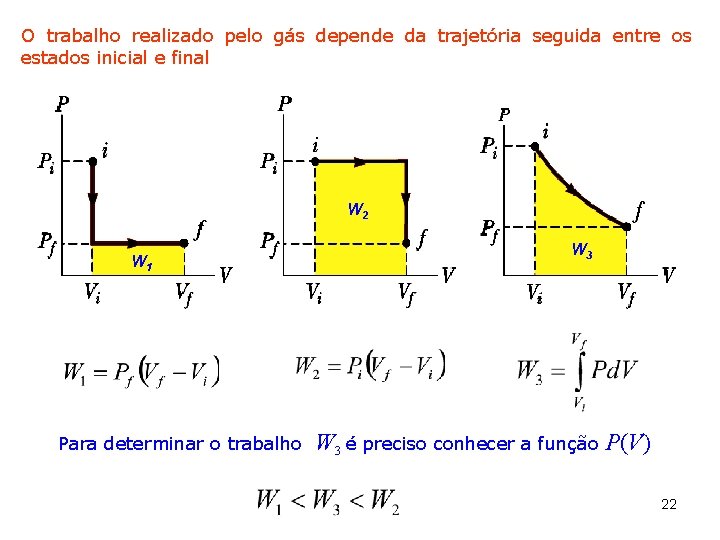
O trabalho realizado pelo gás depende da trajetória seguida entre os estados inicial e final W 2 W 1 Para determinar o trabalho W 3 é preciso conhecer a função P(V) 22

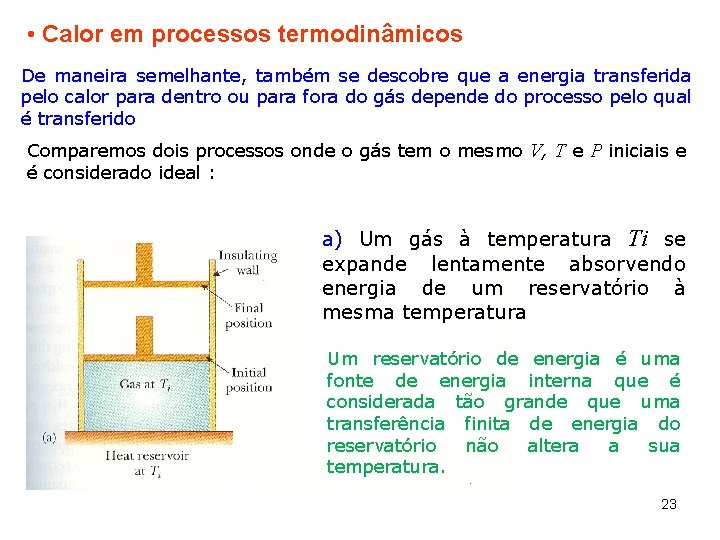
• Calor em processos termodinâmicos De maneira semelhante, também se descobre que a energia transferida pelo calor para dentro ou para fora do gás depende do processo pelo qual é transferido Comparemos dois processos onde o gás tem o mesmo V, T e P iniciais e é considerado ideal : a) Um gás à temperatura Ti se expande lentamente absorvendo energia de um reservatório à mesma temperatura Um reservatório de energia é uma fonte de energia interna que é considerada tão grande que uma transferência finita de energia do reservatório não altera a sua temperatura. 23

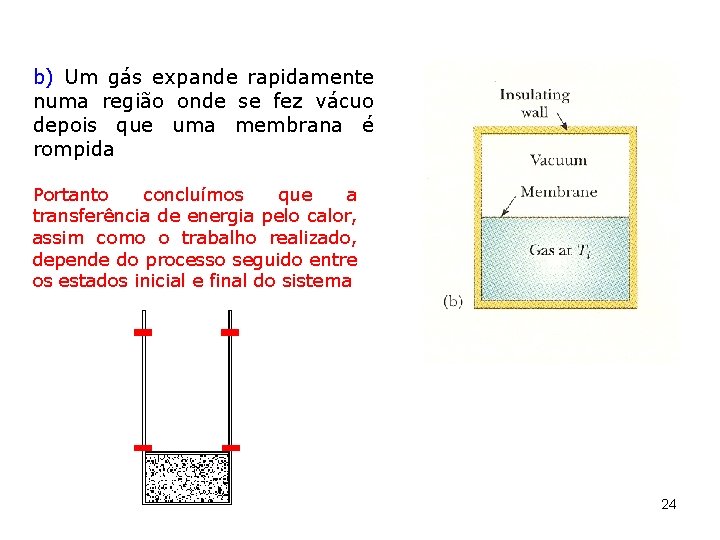
b) Um gás expande rapidamente numa região onde se fez vácuo depois que uma membrana é rompida Portanto concluímos que a transferência de energia pelo calor, assim como o trabalho realizado, depende do processo seguido entre os estados inicial e final do sistema 24

2. 5 Primeiro Princípio da Termodinâmica Caso especial do princípio da conservação de energia: a única variação na energia dum sistema é a variação na sua energia interna U, e os únicos mecanismos de transferência de energia são o calor trabalho Q e o W Primeiro princípio da termodinâmica Q é a energia transferida para o gás -W é o trabalho realizado pelo gás Significa que a variação da energia interna de um sistema, é igual à soma da energia transferida através da fronteira do sistema pelo calor e a energia transferida pelo trabalho 25

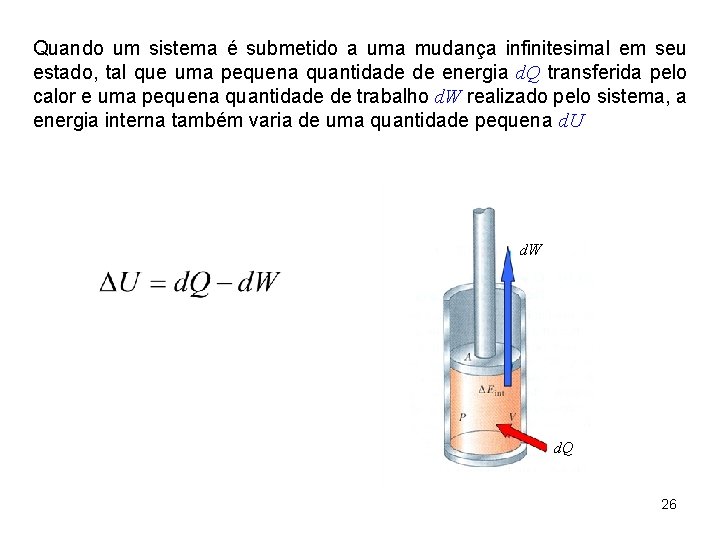
Quando um sistema é submetido a uma mudança infinitesimal em seu estado, tal que uma pequena quantidade de energia d. Q transferida pelo calor e uma pequena quantidade de trabalho d. W realizado pelo sistema, a energia interna também varia de uma quantidade pequena d. U d. W d. Q 26

2. 6 Algumas Aplicações do Primeiro Princípio da Termodinâmica Processos termodinâmicos: adiabático, isométrico (ou isocórico), isotérmico e o cíclico Processo adiabático Todas as superfícies do pistão são isolantes perfeitos, de maneira que a transferência de energia pelo calor não existe Q=0 Aplicando o primeiro princípio da termodinâmica O trabalho realizado pelo gás é negativo, representando a transferência de energia para dentro do sistema, de maneira que a energia interna aumenta. E quando o gás se expande adiabaticamente, é negativo 27

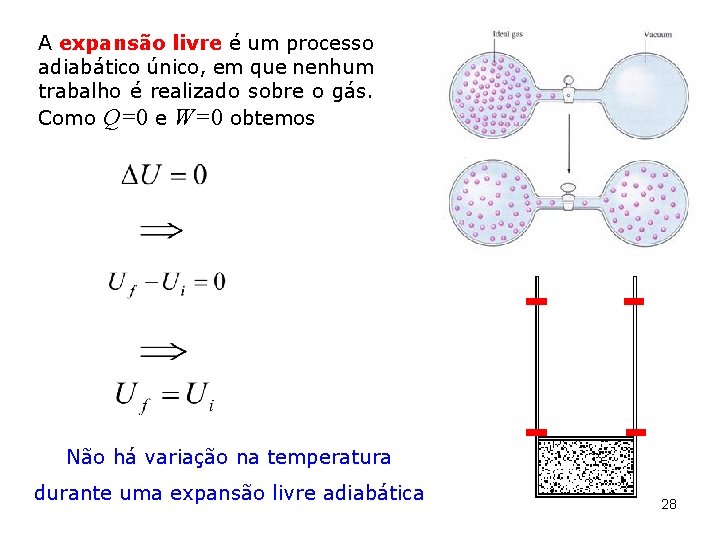
A expansão livre é um processo adiabático único, em que nenhum trabalho é realizado sobre o gás. Como Q=0 e W=0 obtemos Não há variação na temperatura durante uma expansão livre adiabática 28

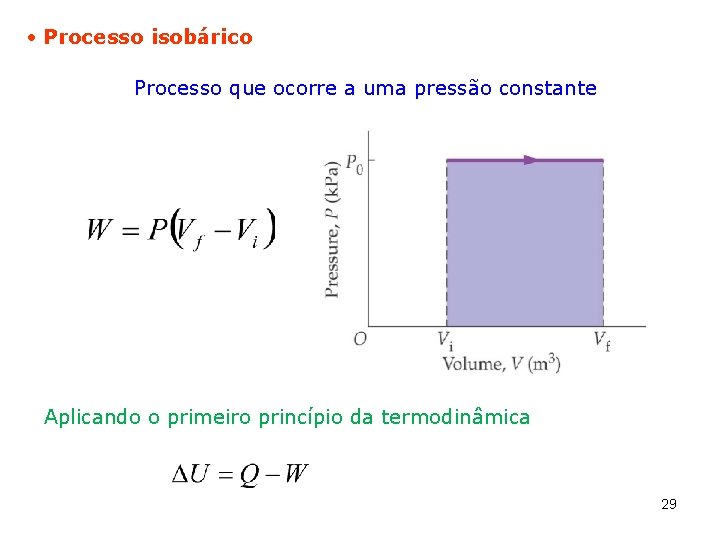
Processo isobárico Processo que ocorre a uma pressão constante Aplicando o primeiro princípio da termodinâmica 29

Processo isométrico (ou isocórico) No processo isométrico, o volume é constante e é criado segurando-se o pistão de maneira que ele não se mova W=0 Aplicando o primeiro princípio da termodinâmica Toda a energia adicionada ao sistema por meio do calor, vai para o aumento da energia interna do sistema 30

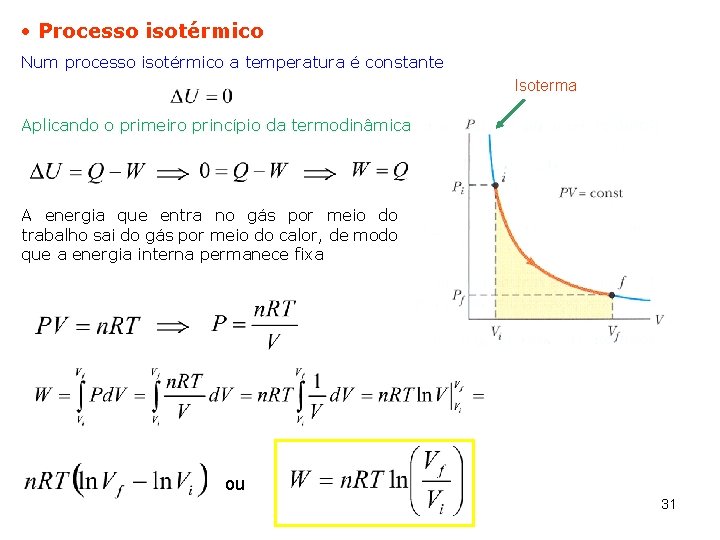
Processo isotérmico Num processo isotérmico a temperatura é constante Isoterma Aplicando o primeiro princípio da termodinâmica A energia que entra no gás por meio do trabalho sai do gás por meio do calor, de modo que a energia interna permanece fixa ou 31

Processo cíclico O sistema não isolado começa e termina no mesmo estado i=f Aplicando o primeiro princípio da termodinâmica V A energia adicionada ao sistema na forma de calor, deve ser igual ao trabalho realizado sobre o sistema durante o ciclo Os processos cíclicos são muito importantes na descrição das máquinas térmicas 32

2. 7 Mecanismos de Transferência de Energia em Processos Térmicos Condução Em escala atómica há uma troca de energia cinética entre moléculas, na qual as moléculas menos energéticas ganham energia colidindo com moléculas mais energéticas - Antes de se inserir a barra na chama, os átomos estão vibrando em torno de suas posições de equilíbrio - À medida que a chama fornece energia à barra, os átomos próximos à chama começam a vibrar com amplitudes cada vez maiores - Colidem com seus vizinhos e transferem um pouco de sua energia nas colisões O aumento da vibração das moléculas representa uma elevação de temperatura do metal A taxa de condução depende das propriedades da substância 33

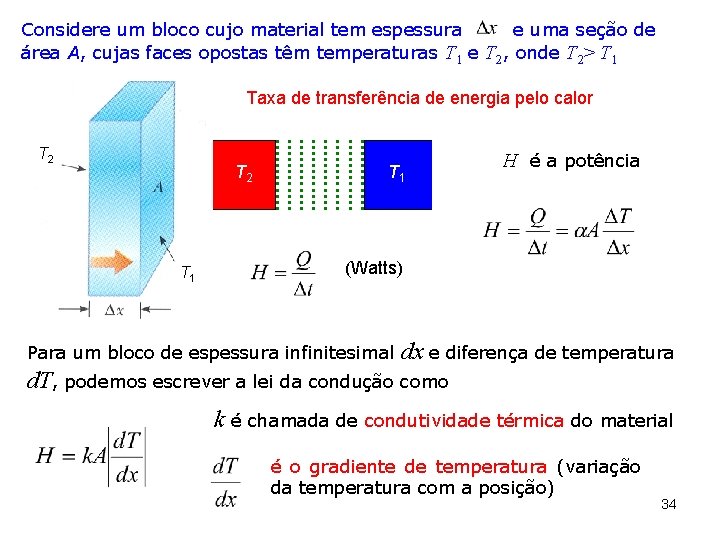
Considere um bloco cujo material tem espessura e uma seção de área A, cujas faces opostas têm temperaturas T 1 e T 2, onde T 2> T 1 Taxa de transferência de energia pelo calor T 2 T 1 H é a potência (Watts) Para um bloco de espessura infinitesimal dx e diferença de temperatura d. T, podemos escrever a lei da condução como k é chamada de condutividade térmica do material é o gradiente de temperatura (variação da temperatura com a posição) 34

Suponha que uma substância esteja na forma de uma barra longa e uniforme e de comprimento L T 2 T 1 Está isolada de modo que a energia não possa escapar pelo calor a partir da superfície exceto nas extremidades, que estão em contacto térmico com reservatórios que têm temperaturas T 1 e T 2 No estado estacionário a temperatura em cada ponto ao longo da barra é constante no tempo A taxa de transferência de energia pelo calor será k é a condutividade térmica 35

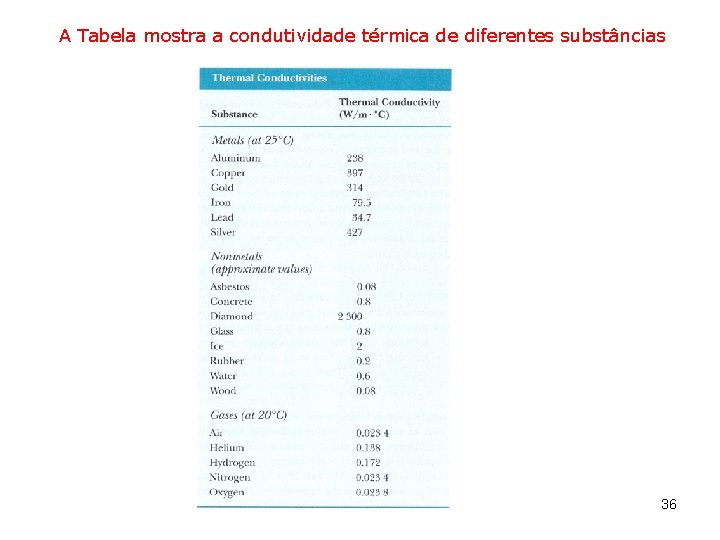
A Tabela mostra a condutividade térmica de diferentes substâncias 36

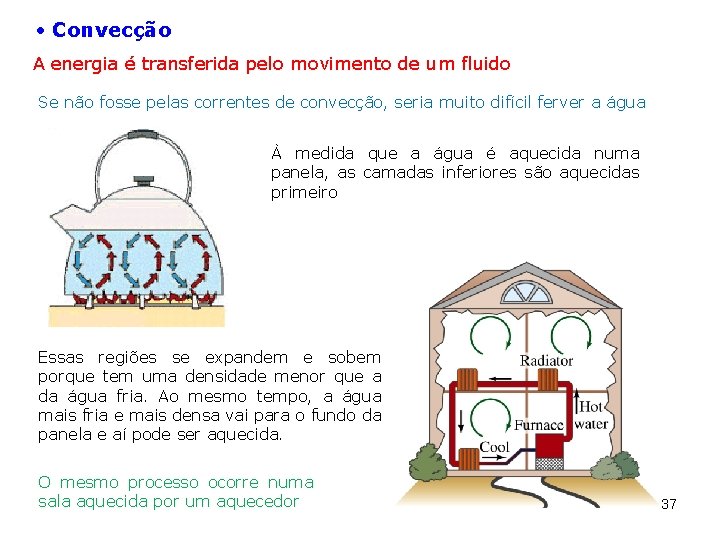
Convecção A energia é transferida pelo movimento de um fluido Se não fosse pelas correntes de convecção, seria muito difícil ferver a água À medida que a água é aquecida numa panela, as camadas inferiores são aquecidas primeiro Essas regiões se expandem e sobem porque tem uma densidade menor que a da água fria. Ao mesmo tempo, a água mais fria e mais densa vai para o fundo da panela e aí pode ser aquecida. O mesmo processo ocorre numa sala aquecida por um aquecedor 37

Radiação A energia é transferida pela radiação eletromagnética A energia eletromagnética é emitida por qualquer corpo que possua temperatura acima de zero absoluto (0 K). Assim, todo corpo com temperatura absoluta acima de zero pode ser considerado como uma fonte de energia eletromagnética A origem da radiação eletromagnética é a aceleração de cargas elétricas Um corpo emite radiação eletromagnética devido ao movimento térmico de suas moléculas A potência irradiada pelo corpo em Watts Constante de Stefan. Boltzmann: W/m 2 K 4 A é a área da superfície do corpo em metros quadrados e é uma constante chamada emissividade T é a temperatura da superfície do corpo em 38 kelvins