CAPITOLO Le reazioni chimiche e la stechiometria 9






- Slides: 10

CAPITOLO Le reazioni chimiche e la stechiometria 9 Indice 1. Le reazioni e le equazioni chimiche 2. Come si classificano le reazioni chimiche 3. Dissociazione ionica 4. Equazioniche nette 5. Calcoli con le equazioni chimiche © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

1 Le reazioni e le equazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Una reazione chimica è un processo in cui una o più sostanze (reagenti) si trasformano in una o più nuove sostanze (prodotti). Un’equazione chimica, invece, è la rappresentazione simbolica di una reazione. La reazione che prendiamo in esame riguarda la sintesi dell’ammoniaca (prodotto) partendo dall’idrogeno e dall’azoto (reagenti). Nel caso in esame, le sostanze sono tutte gassose, per cui l’equazione viene scritta nella forma: N 2(g) + 3 H 2(g) ➞ 2 NH 3(g) I simboli e le formule dei reagenti sono scritti a sinistra di una freccia e i simboli e le formule dei prodotti a destra. I numeri scritti davanti ai simboli e alle formule sono chiamati coefficienti e permettono il bilanciamento dell’equazione, cioè che lo stesso numero di atomi figuri nei reagenti e nei prodotti. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

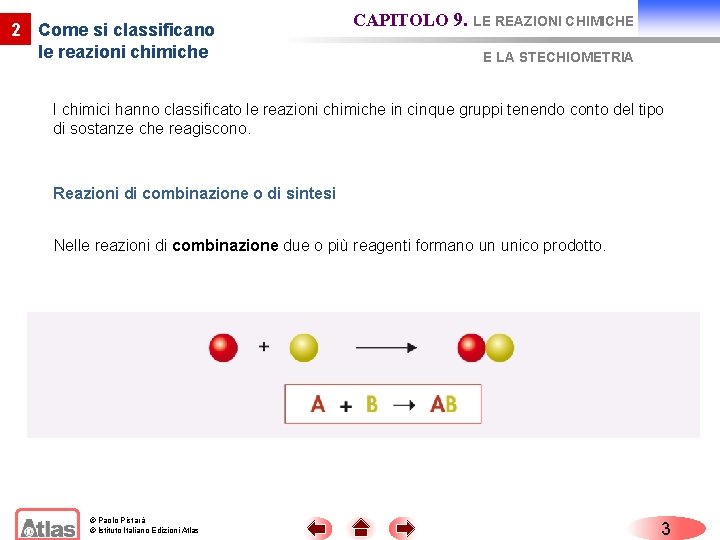
2 Come si classificano le reazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA I chimici hanno classificato le reazioni chimiche in cinque gruppi tenendo conto del tipo di sostanze che reagiscono. Reazioni di combinazione o di sintesi Nelle reazioni di combinazione due o più reagenti formano un unico prodotto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 3

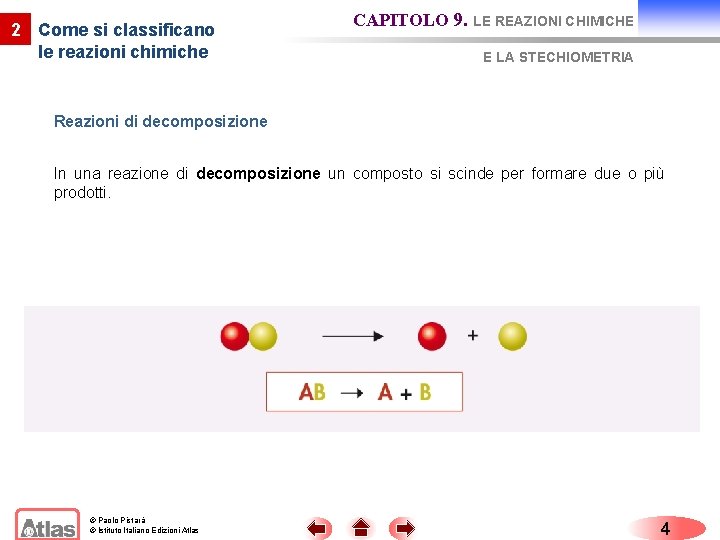
2 Come si classificano le reazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Reazioni di decomposizione In una reazione di decomposizione un composto si scinde per formare due o più prodotti. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

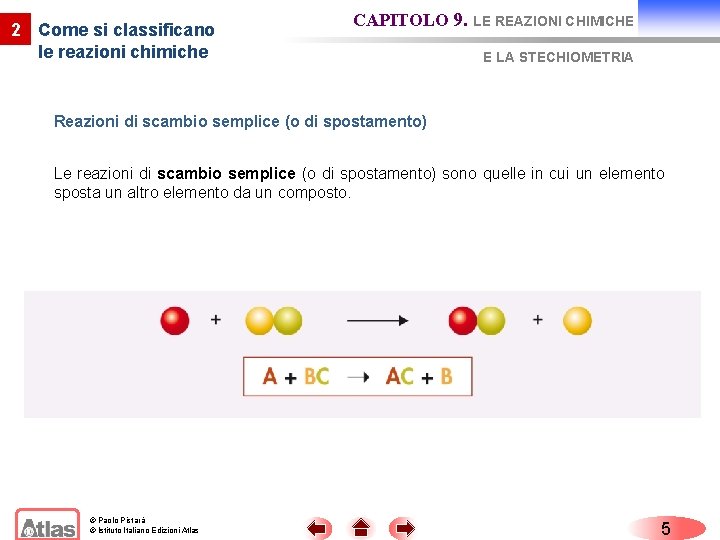
2 Come si classificano le reazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Reazioni di scambio semplice (o di spostamento) Le reazioni di scambio semplice (o di spostamento) sono quelle in cui un elemento sposta un altro elemento da un composto. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

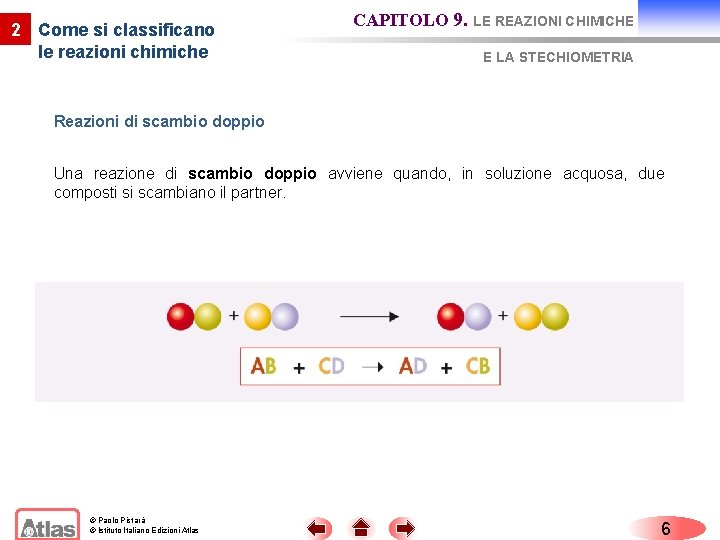
2 Come si classificano le reazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Reazioni di scambio doppio Una reazione di scambio doppio avviene quando, in soluzione acquosa, due composti si scambiano il partner. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

2 Come si classificano le reazioni chimiche CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Reazioni di combustione In una combustione una sostanza brucia con l’ossigeno producendo una notevole quantità di calore e, di solito, una fiamma visibile. CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(g) metano Combustione del metano con l’ossigeno in un Bunsen. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

3 Dissociazione ionica CAPITOLO 9. LE REAZIONI CHIMICHE E LA STECHIOMETRIA Se un composto ionico viene sciolto in acqua, gli ioni che lo costituiscono si separano l’uno dall’altro: il fenomeno è detto dissociazione ionica. Gli ioni in soluzione sono circondati da molecole di acqua, cioè sono idratati. In figura è illustrato, su scala atomica, il processo di dissociazione ionica. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 8

CAPITOLO 9. LE REAZIONI CHIMICHE 4 Equazioniche nette E LA STECHIOMETRIA La seguente equazione che rappresenta la precipitazione del cloruro di argento: Ag. NO 3(aq) + Na. Cl(aq) ➞ Ag. Cl(s) + Na. NO 3(aq) (a) è detta molecolare, perché le formule dei composti sono scritte come se le specie esistessero sotto forma di molecole. In forma ionica l’equazione diventa: Ag+(aq) + NO– 3(aq) + Na+(aq) + Cl–(aq) ➞ Ag. Cl(s) + Na+(aq) + NO– 3(aq) Se si trascurano gli ioni spettatori perché compaiono in entrambi i membri dell’equazione, l’equazione è così rappresentata: Ag+(aq) + Cl –(aq) ➞ Ag. Cl(s) L’equazione scritta è detta equazione ionica netta. In una equazione ionica netta bilanciata si ha conservazione sia degli atomi che della carica. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

CAPITOLO 9. LE REAZIONI CHIMICHE 5 Calcoli con le equazioni chimiche E LA STECHIOMETRIA Lo studio delle relazioni quantitative tra le moli dei reagenti e dei prodotti in una reazione prende il nome di stechiometria. Nell’equazione bilanciata tra alluminio e bromo liquido, ad esempio, il rapporto quantitativo tra le moli delle sostanze è il seguente: Reagenti 2 Al(s) + 2 moli di + alluminio © Paolo Pistarà © Istituto Italiano Edizioni Atlas Prodotto 3 Br 2(ℓ) 2 Al. Br 3(s) 3 moli di bromo 2 moli di bromuro di alluminio 10


















