Capitolo 6 Pillole di chimica Simboli e Formule

Capitolo 6 Pillole di chimica: Simboli e Formule Giovanni Casavecchia

1 Simboli e formule Gli elementi chimici sono sostanze semplici che, combinandosi fra loro, formano tutto ciò che ci circonda sono classificati e raggruppati nella tavola periodica Capitolo 6 Il linguaggio della chimica e la mole 2

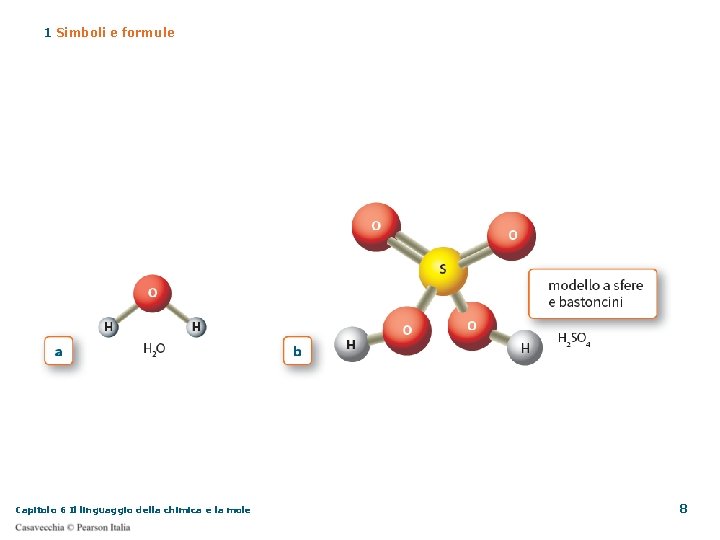
1 Simboli e formule Una molecola è un insieme ben definito di due o più atomi legati tra di loro 1) Pochissimi elementi esistono in natura alla stato monoatomico (He). 2) Alcuni sono presenti allo stato biatomico, cioè una molecola formata da 2 atomi legati insieme (H 2, O 2, N 2) 3) Un numero enorme (tendente ad infinito…. ) si combina per formare molecole via più complesse (H 2 O, CO 2, C 6 H 12 O 6, NH 4 Cl, Na. Cl…. ) Capitolo 6 Il linguaggio della chimica e la mole 3

1 Simboli e formule Quando le molecole sono fatte di atomi di elementi diversi parliamo di composti molecolari un composto binario è formato da due elementi CO (monossido di carbonio) un composto ternario è formato da tre elementi H 2 SO 4 (acido solforico) un composto quaternario è formato da quattro elementi C 17 H 19 NO 3 (piperina) Capitolo 6 Il linguaggio della chimica e la mole 4

1 Simboli e formule Formula molecolare La formula molecolare indica in modo sintetico il tipo e il numero di atomi che formano una molecola Per le molecole elementari si scrive il nome dell’elemento seguito da un indice Capitolo 6 Il linguaggio della chimica e la mole 5

1 Simboli e formule La formula molecolare di un composto (esempio: NH 3) ci dice quali elementi formano il composto – azoto (N) e idrogeno (H) quanti atomi di ogni elemento sono presenti in una molecola – un atomo di azoto e tre atomi di idrogeno in quale rapporto sono legati i due elementi 1 (N) : 3 (H) Il coefficiente stechiometrico è il numero che precede la formula moltiplica per se stesso l’indice di ogni atomo della formula 2 NH 3 indica 2 molecole di ammoniaca Capitolo 6 Il linguaggio della chimica e la mole 6

1 Simboli e formule La formula di struttura usa dei trattini per rappresentare ogni legame I composti ionici e l’unità formula Non tutti i composti sono molecole Il cloruro di sodio è formato da ioni positivi e ioni negativi disposti in un reticolo cristallino Na. Cl rappresenta l’unità formula, cioè il più piccolo insieme complessivamente neutro di ioni Na+ e Cl– – per ogni ione Na+ c’è uno ione Cl– che ne bilancia la carica (e viceversa) Capitolo 6 Il linguaggio della chimica e la mole 7
1 Simboli e formule Capitolo 6 Il linguaggio della chimica e la mole 8

1 Simboli e formule Capitolo 6 Il linguaggio della chimica e la mole 9

1 Simboli e formule Ripassare/Studiare Libro Formula: pag 130, 131, 132 Ex pag 148 n° 1, 2, 3, 4, 5, 6, 7 Capitolo 6 Il linguaggio della chimica e la mole 10
- Slides: 10