CAPITOLO 2 Le trasformazioni fisiche della materia Indice



















- Slides: 31

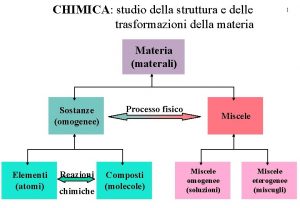
CAPITOLO 2 Le trasformazioni fisiche della materia Indice 1. La materia e il modello particellare 2. Le sostanze pure 3. Miscele 4. La solubilità dei soluti nei liquidi 5. Fattori che influenzano la solubilità dei gas 6. Concentrazione di una soluzione 7. I passaggi di stato 8. La separazione delle miscele in sostanze pure © Paolo Pistarà © Istituto Italiano Edizioni Atlas 1

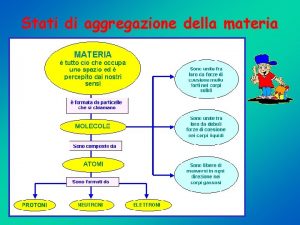
1 La materia e il modello particellare CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Materia è tutto ciò che possiede una massa ed occupa un volume. Secondo il modello particellare, la materia è costituita da particelle estremamente piccole (atomi o molecole) in continuo movimento. Si presenta in tre stati fisici: solido, liquido e gassoso. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 2

1 La materia e il modello particellare CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Conferma della teoria particellare a) La diffusione è il processo con cui i gas si muovono per occupare tutto lo spazio che hanno a disposizione. I vapori di bromo occupano la parte inferiore del cilindro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Al termine dell’esperimento, i vapori di bromo si sono diffusi in tutto il cilindro. 3

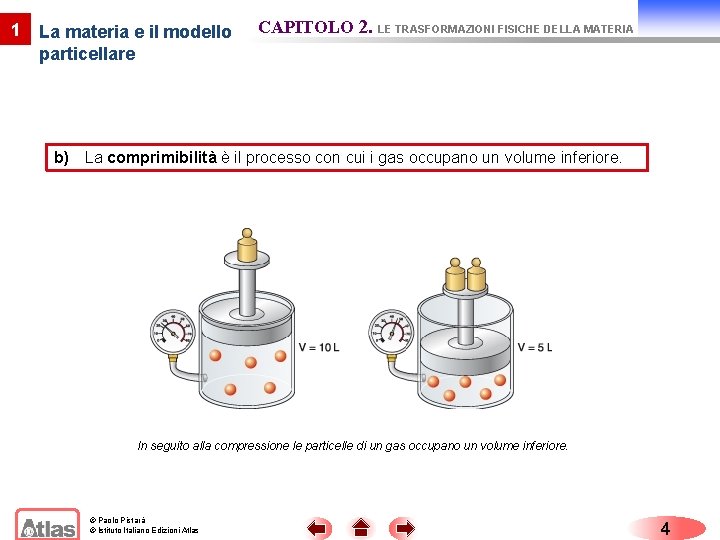
1 La materia e il modello particellare CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA b) La comprimibilità è il processo con cui i gas occupano un volume inferiore. In seguito alla compressione le particelle di un gas occupano un volume inferiore. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 4

1 La materia e il modello particellare c) CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Due liquidi, miscibili tra di loro, occupano un volume inferiore alla somma dei volumi distinti. alcool etilico acqua Nel cilindro è contenuta la miscela dei due liquidi. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 5

2 Le sostanze pure CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Una sostanza pura è materia costituita da un solo componente, cioè da una sola specie chimica. Il cloruro di sodio puro per analisi, anche se contiene piccole percentuali di impurezze, è considerato una sostanza pura. Le impurezze presenti nel cloruro di sodio per analisi, essendo in piccole percentuali, non ne modificano le proprietà. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 6

2 Le sostanze pure CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Le sostanze pure sono caratterizzate da specifiche proprietà fisiche e chimiche permettono di identificarle. Le proprietà fisiche (temperatura di fusione, di ebollizione, densità, ecc), che non dipendono dalla quantità del campione, sono dette intensive. Le proprietà fisiche (massa, volume), che dipendono dalla quantità del campione, sono dette estensive. Le proprietà chimiche delle sostanze, che si manifestano quando una sostanza interagisce con altre sostanze, vengono classificate come intensive. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 7

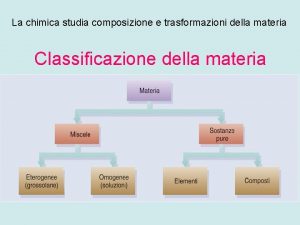
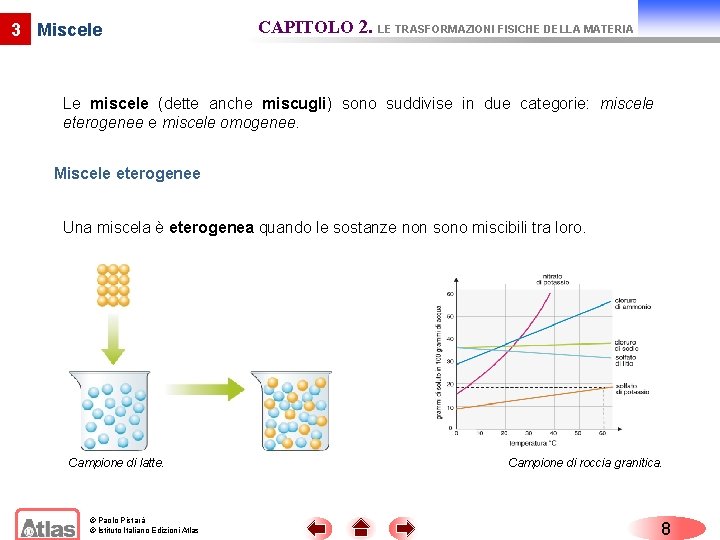
3 Miscele CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Le miscele (dette anche miscugli) sono suddivise in due categorie: miscele eterogenee e miscele omogenee. Miscele eterogenee Una miscela è eterogenea quando le sostanze non sono miscibili tra loro. Campione di latte. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Campione di roccia granitica. 8

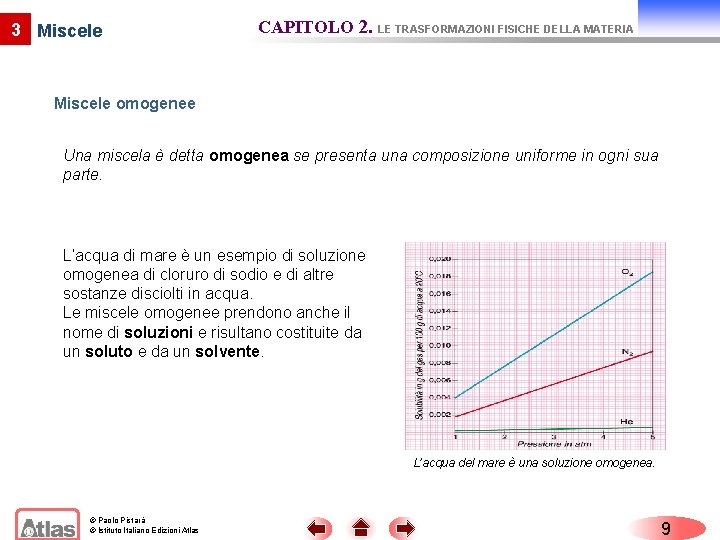
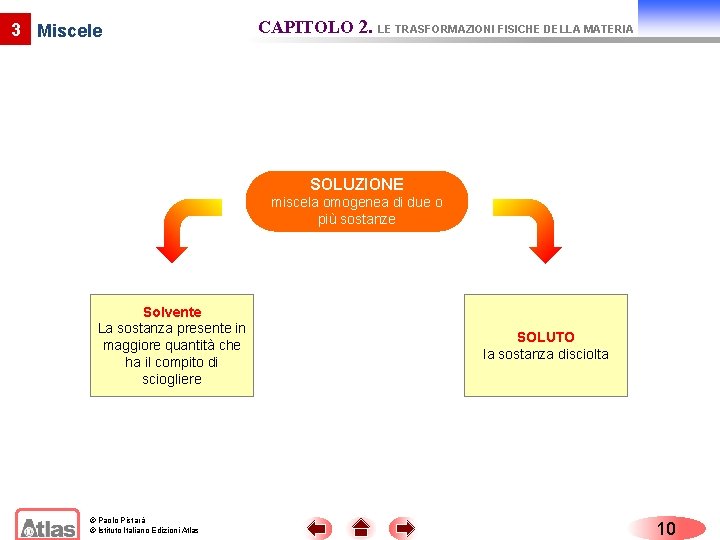
3 Miscele CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Miscele omogenee Una miscela è detta omogenea se presenta una composizione uniforme in ogni sua parte. L’acqua di mare è un esempio di soluzione omogenea di cloruro di sodio e di altre sostanze disciolti in acqua. Le miscele omogenee prendono anche il nome di soluzioni e risultano costituite da un soluto e da un solvente. L’acqua del mare è una soluzione omogenea. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 9

3 Miscele CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA SOLUZIONE miscela omogenea di due o più sostanze Solvente La sostanza presente in maggiore quantità che ha il compito di sciogliere © Paolo Pistarà © Istituto Italiano Edizioni Atlas SOLUTO la sostanza disciolta 10

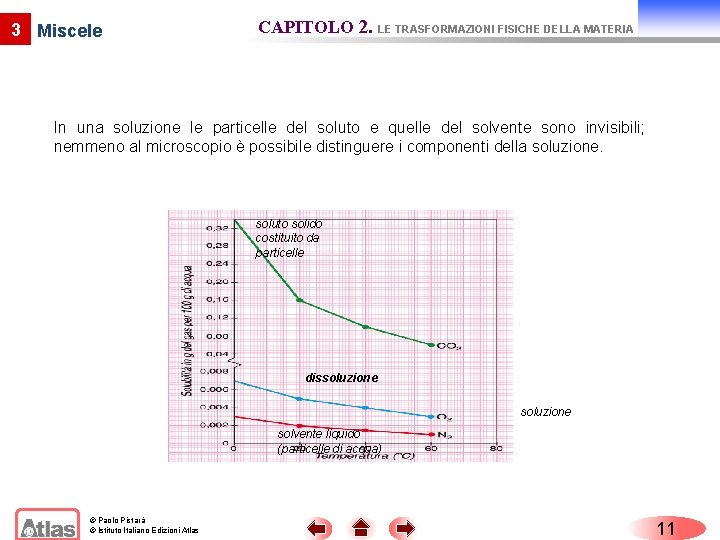
3 Miscele CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA In una soluzione le particelle del soluto e quelle del solvente sono invisibili; nemmeno al microscopio è possibile distinguere i componenti della soluzione. soluto solido costituito da particelle dissoluzione solvente liquido (particelle di acqua) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 11

4 La solubilità dei soluti nei liquidi CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA La solubilità varia da sostanza ed è influenzata dalla temperatura. “Per solubilità s’intende la quantità massima di soluto che può sciogliersi, ad una definita temperatura, in una data quantità di solvente”. In figura sono rappresentate le curve di solubilità di alcuni composti in funzione della temperatura. Queste curve mostrano che la solubilità dei composti dipende dalla temperatura. Ad ogni temperatura corrisponde la massa in grammi di una sostanza che si scioglie in 100 g di acqua. Per esempio, a 60 °C la massa di solfato di potassio che si scioglie in 100 g di acqua è di 18 g. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 12

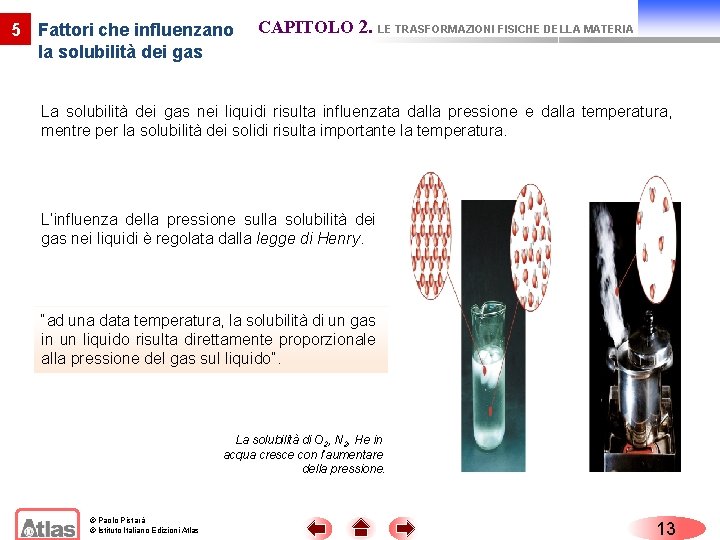
5 Fattori che influenzano la solubilità dei gas CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA La solubilità dei gas nei liquidi risulta influenzata dalla pressione e dalla temperatura, mentre per la solubilità dei solidi risulta importante la temperatura. L’influenza della pressione sulla solubilità dei gas nei liquidi è regolata dalla legge di Henry. “ad una data temperatura, la solubilità di un gas in un liquido risulta direttamente proporzionale alla pressione del gas sul liquido”. La solubilità di O 2, N 2, He in acqua cresce con l’aumentare della pressione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 13

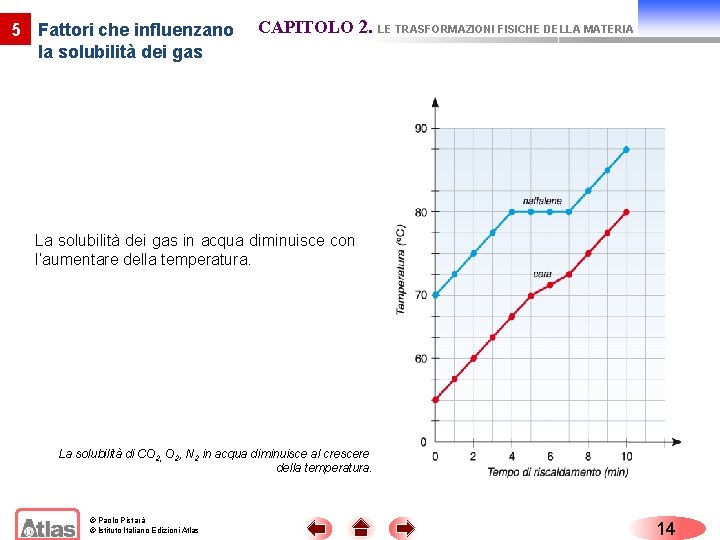
5 Fattori che influenzano la solubilità dei gas CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA La solubilità dei gas in acqua diminuisce con l’aumentare della temperatura. La solubilità di CO 2, N 2 in acqua diminuisce al crescere della temperatura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 14

6 Concentrazione di una soluzione CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA In chimica le soluzioni presentano una concentrazione nota, cioè un rapporto ben definito tra la quantità di soluto e quella di soluzione o di solvente. I modi in cui si può esprimere la concentrazione di una soluzione sono diversi. Percentuale in massa La percentuale in massa è la quantità in grammi di soluto sciolto in 100 g di soluzione (soluto + solvente). percentuale in massa = © Paolo Pistarà © Istituto Italiano Edizioni Atlas massa di soluto × 100 massa della soluzione 15

6 Concentrazione di una soluzione CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Percentuale in volume La percentuale in volume indica il volume in m. L di soluto disciolto in 100 m. L di soluzione. percentuale in volume = © Paolo Pistarà © Istituto Italiano Edizioni Atlas volume di soluto × 100 volume di soluzione 16

6 Concentrazione di una soluzione CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Massa su volume La concentrazione massa su volume indica la massa di soluto disciolto in un determinato volume di soluzione, in genere 1 L. La percentuale in massa su volume è la quantità di soluto (in grammi) diviso il volume totale della soluzione (in millilitri) moltiplicato per 100. percentuale massa su volume = © Paolo Pistarà © Istituto Italiano Edizioni Atlas massa di soluto (g) × 100 volume di soluzione (m. L) 17

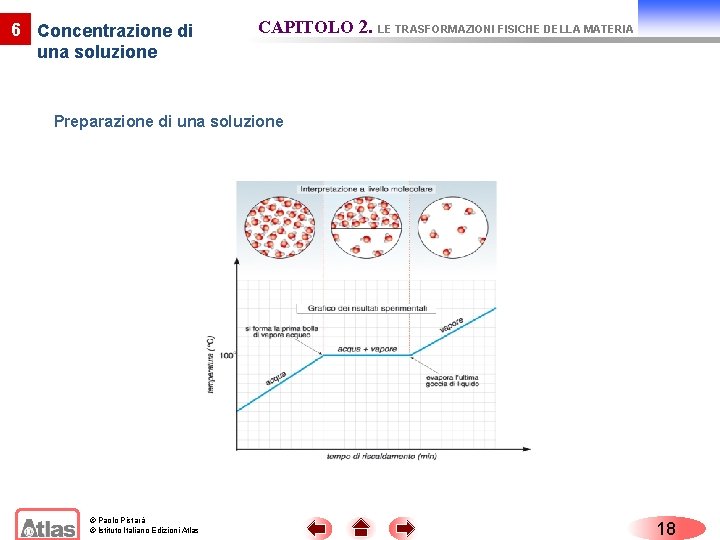
6 Concentrazione di una soluzione CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Preparazione di una soluzione © Paolo Pistarà © Istituto Italiano Edizioni Atlas 18

7 I passaggi di stato CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA I passaggi di stato sono esempi di trasformazioni fisiche. Secondo i modelli delle figure, nei passaggi di stato dell’acqua varia solo l’organizzazione ma non la natura delle particelle (molecole). Sono dette trasformazioni fisiche quelle in cui l’identità delle sostanze non varia. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 19

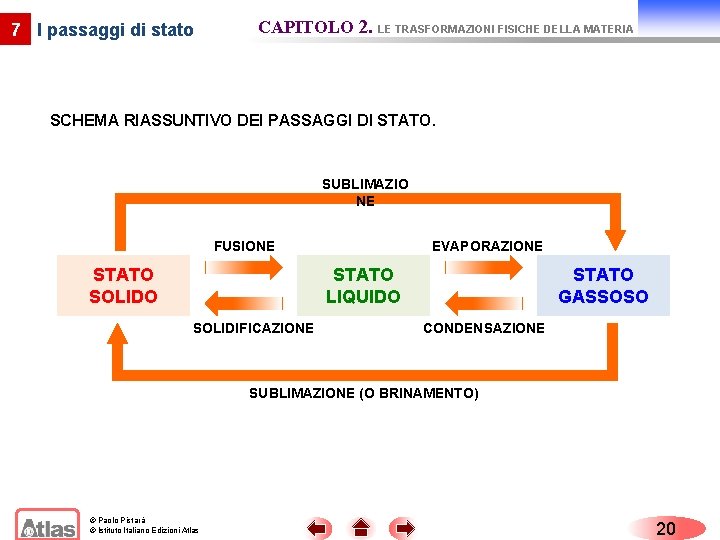
7 I passaggi di stato CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA SCHEMA RIASSUNTIVO DEI PASSAGGI DI STATO. SUBLIMAZIO NE FUSIONE STATO SOLIDO EVAPORAZIONE STATO LIQUIDO SOLIDIFICAZIONE STATO GASSOSO CONDENSAZIONE SUBLIMAZIONE (O BRINAMENTO) © Paolo Pistarà © Istituto Italiano Edizioni Atlas 20

7 I passaggi di stato CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Curve di riscaldamento e di raffreddamento Ogni sostanza pura ha una curva di riscaldamento. Una curva di fusione si ottiene riportando in un grafico i valori di temperatura in funzione del tempo di riscaldamento. Il naftalene presenta una curva di riscaldamento con una temperatura di fusione ben definita (80°C). In corrispondenza della temperatura di fusione si verifica una sosta termica in cui coesistono il solido e il liquido. La cera, che è una miscela di sostanze, fonde in un intervallo di temperatura. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 21

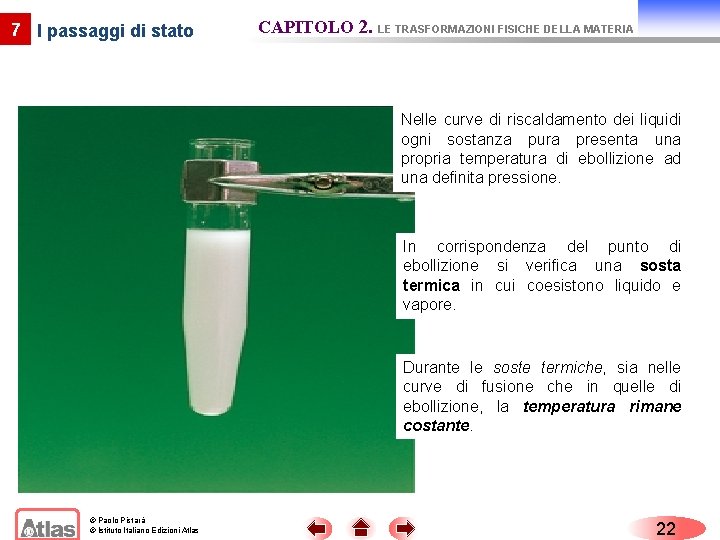
7 I passaggi di stato CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA Nelle curve di riscaldamento dei liquidi ogni sostanza pura presenta una propria temperatura di ebollizione ad una definita pressione. In corrispondenza del punto di ebollizione si verifica una sosta termica in cui coesistono liquido e vapore. Durante le soste termiche, sia nelle curve di fusione che in quelle di ebollizione, la temperatura rimane costante. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 22

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Da una miscela si possono ottenere le sostanze pure che la compongono con diversi processi di separazione. Filtrazione La filtrazione è un processo che separa i componenti di una miscela sfruttando le differenti dimensioni delle particelle. Filtrazione con carta da filtro. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 23

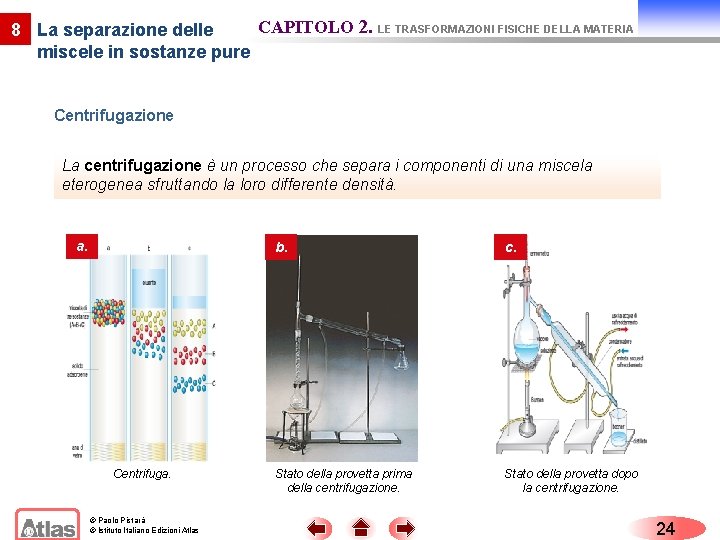
CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Centrifugazione La centrifugazione è un processo che separa i componenti di una miscela eterogenea sfruttando la loro differente densità. a. Centrifuga. © Paolo Pistarà © Istituto Italiano Edizioni Atlas b. c. Stato della provetta prima della centrifugazione. Stato della provetta dopo la centrifugazione. 24

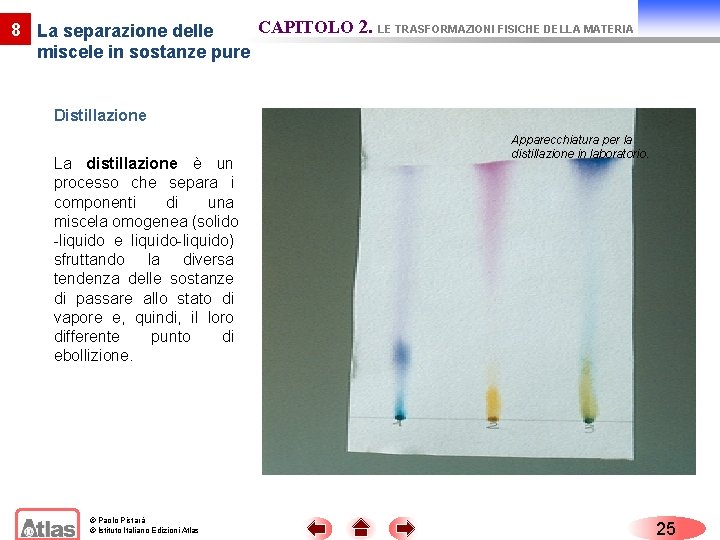
CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Distillazione La distillazione è un processo che separa i componenti di una miscela omogenea (solido -liquido e liquido-liquido) sfruttando la diversa tendenza delle sostanze di passare allo stato di vapore e, quindi, il loro differente punto di ebollizione. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Apparecchiatura per la distillazione in laboratorio. 25

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Per separare due liquidi che hanno temperature di ebollizione molto vicine si ricorre ad una distillazione frazionata. Un esempio è la separazione acqua-alcool etilico. Apparecchiatura per la distillazione frazionata con colonna di Vigreux. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 26

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Cristallizzazione Il processo di cristallizzazione sfrutta la differenza di solubilità dei componenti di una miscela al variare della temperatura. La solubilità di una sostanza in un dato solvente risulta, di norma, maggiore a caldo che non a freddo. Lo zucchero greggio viene raffinato a zucchero bianco mediante cristallizzazione, utilizzando l’acqua come solvente. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 27

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Estrazione con solventi L’estrazione consiste nel rimuovere composti da un campione utilizzando opportuni solventi. La preparazione di una tazza di tè, caffè, camomilla sfrutta questa tecnica. L’estrazione delle essenze dalla buccia di limone utilizza l’alcool etilico come solvente. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 28

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Cromatografia La cromatografia consiste nel fare adsorbire una miscela su un solido o su carta porosa (fase stazionaria) che ha il compito di trattenere con forze decrescenti i componenti della miscela. In seguito, con l’aggiunta di un eluente (fase mobile), i componenti la miscela vengono trascinati con diversa velocità per cui si separano. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 29

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure Le tecniche più comuni di cromatografia sono: la cromatografia in colonna Rappresentazione semplificata della cromatografia per adsorbimento. © Paolo Pistarà © Istituto Italiano Edizioni Atlas 30

CAPITOLO 2. LE TRASFORMAZIONI FISICHE DELLA MATERIA 8 La separazione delle miscele in sostanze pure la cromatografia su carta Cromatografia ascendente. © Paolo Pistarà © Istituto Italiano Edizioni Atlas Cromatogramma asciutto. 31
 Trasformazioni termodinamiche
Trasformazioni termodinamiche Dalla materia all'atomo soluzioni capitolo 3
Dalla materia all'atomo soluzioni capitolo 3 Trasformazioni fisiche e chimiche zanichelli
Trasformazioni fisiche e chimiche zanichelli Grandezze fisiche
Grandezze fisiche Conversioni grandezze fisiche
Conversioni grandezze fisiche Proprietà fisiche degli alcani
Proprietà fisiche degli alcani Le grandezze fisiche riassunto
Le grandezze fisiche riassunto Soluzioni capitolo 18 zanichelli chimica
Soluzioni capitolo 18 zanichelli chimica Gli stati di aggregazione della materia
Gli stati di aggregazione della materia Stati condensati della materia
Stati condensati della materia Cicli della materia
Cicli della materia I passaggi di stato della materia scuola primaria
I passaggi di stato della materia scuola primaria La teoria cinetico molecolare della materia zanichelli
La teoria cinetico molecolare della materia zanichelli Teoria cinetico molecolare zanichelli
Teoria cinetico molecolare zanichelli Proprietà magnetiche della materia
Proprietà magnetiche della materia Teoria atomica della materia
Teoria atomica della materia Forza di lorentz zanichelli
Forza di lorentz zanichelli Velocità media formula
Velocità media formula Proprietà macroscopiche della materia
Proprietà macroscopiche della materia Danilo babusci
Danilo babusci Trasformazioni grafici esercizi
Trasformazioni grafici esercizi Ciclo diesel trasformazioni
Ciclo diesel trasformazioni Trasformazioni lorentz
Trasformazioni lorentz Uda energia
Uda energia Trasformazioni geometriche funzioni goniometriche
Trasformazioni geometriche funzioni goniometriche Trasformazioni omogenee
Trasformazioni omogenee Le particelle che costituiscono i raggi anodici
Le particelle che costituiscono i raggi anodici Trasformazioni geometriche schema
Trasformazioni geometriche schema Isometrie significato
Isometrie significato Lorentz
Lorentz Lavoro in una trasformazione ciclica
Lavoro in una trasformazione ciclica Ciclo di carnot zanichelli
Ciclo di carnot zanichelli