Ca O H 2 O CaOH2 3 H































- Slides: 45




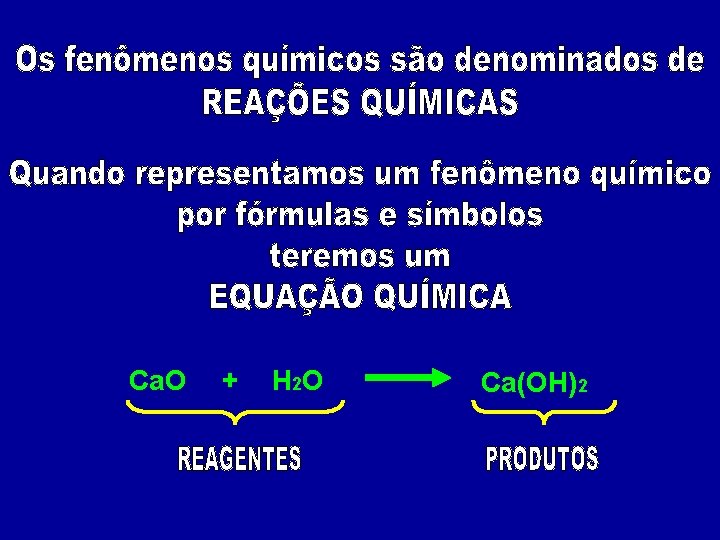
Ca. O + H 2 O Ca(OH)2

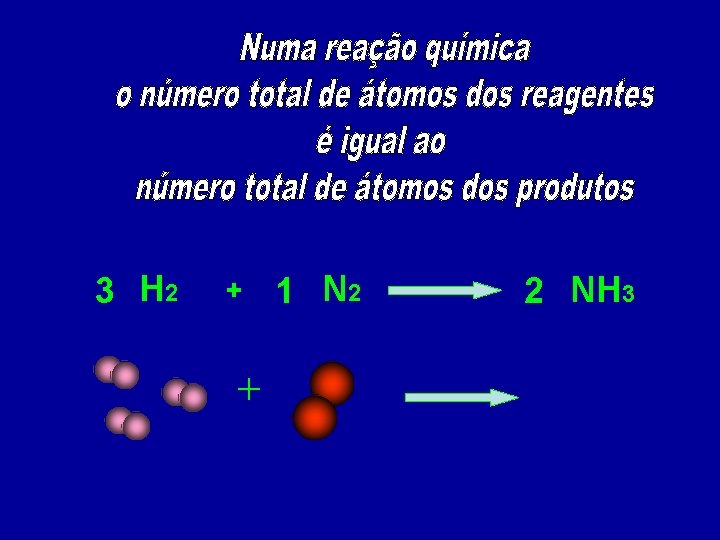
3 H 2 + 1 N 2 2 NH 3

3 H 2 + + 1 N 2 2 NH 3

01) A equação refere-se à transformação de ozônio em oxigênio comum, representada pela equação: 2 O 3 3 O 2 Os números 2 e 3 que aparecem no lado esquerdo da equação representam, respectivamente: a) Coeficiente estequiométrico e número de átomos da molécula. b) Coeficiente estequiométrico e número de moléculas. c) Número de moléculas e coeficiente estequiométrico. d) Número de átomos da molécula e coeficiente estequiométrico. e) Número de átomos da molécula e número de moléculas.

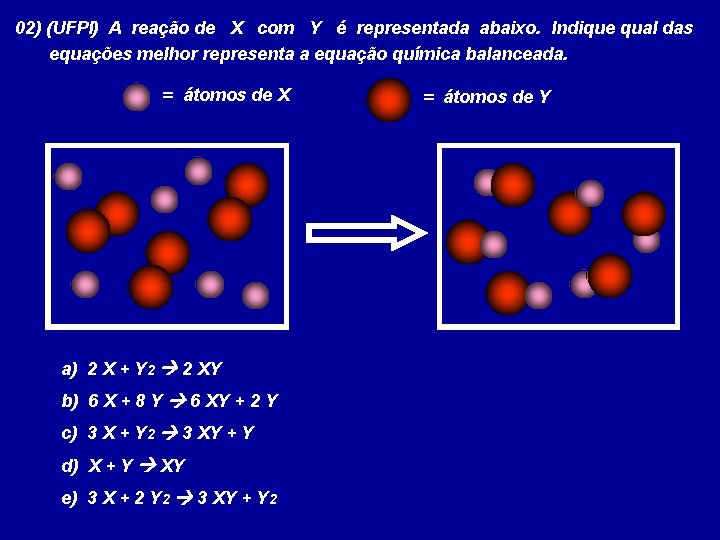
02) (UFPI) A reação de X com Y é representada abaixo. Indique qual das equações melhor representa a equação química balanceada. = átomos de X a) 2 X + Y 2 2 XY b) 6 X + 8 Y 6 XY + 2 Y c) 3 X + Y 2 3 XY + Y d) X + Y XY e) 3 X + 2 Y 2 3 XY + Y 2 = átomos de Y

03) (Covest-2000) Considere as reações químicas abaixo: 1) 2 K(s) + Cl 2 (g) KCl (s) 2) 2 Mg(s) + O 2 (g) 2 Mg. O (s) 3) Pb. SO 4 (aq) + Na 2 S (aq) Pb. S (s) + Na. SO 4 (s) 4) CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (l) 5) SO 2 (g) + H 2 O (l) H 2 SO 4 (aq) Podemos afirmar que: a) todas estão balanceadas b) 2, 3, e 4 estão balanceadas c) somente 2 e 4 estão balanceadas d) somente 1 não está balanceada e) nenhuma está corretamente balanceada, porque os estados físicos dos reagentes e produtos são diferentes.

Basicamente podemos classificar as reações químicas em:

Ca. O + H 2 O Ca(OH)2 N 2 2 NH 3 + 3 H 2

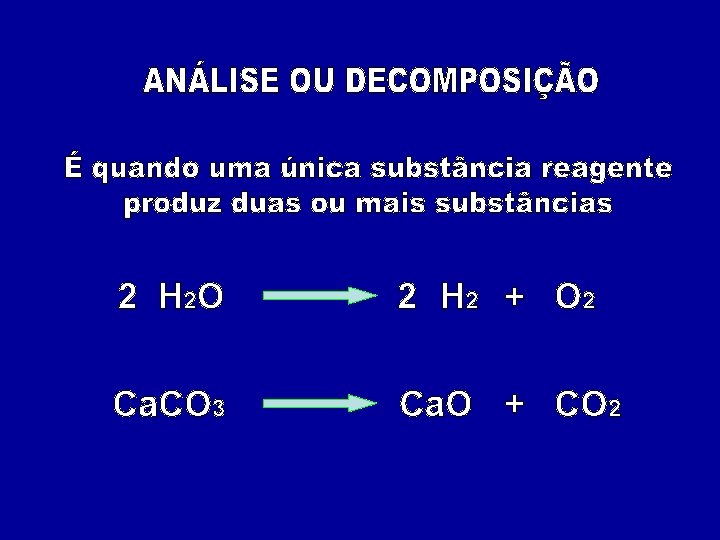
2 H 2 O 2 H 2 + O 2 Ca. CO 3 Ca. O + CO 2


Zn + 2 HCl Cl 2 + 2 Na. Br H 2 + Zn. Cl 2 Br 2 + 2 Na. Cl

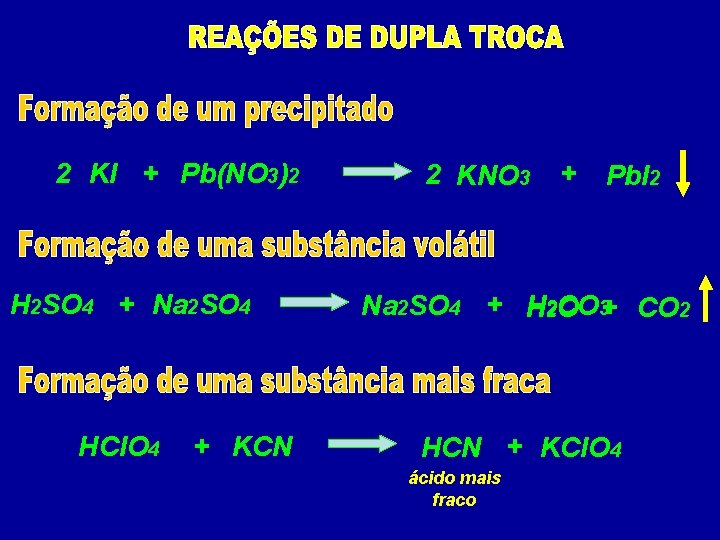
2 KI + Pb(NO 3)2 2 KNO 3 + Pb. I 2

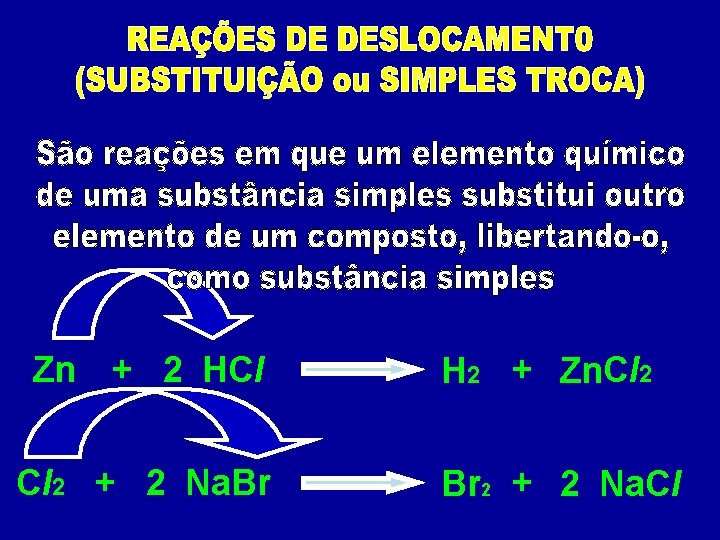
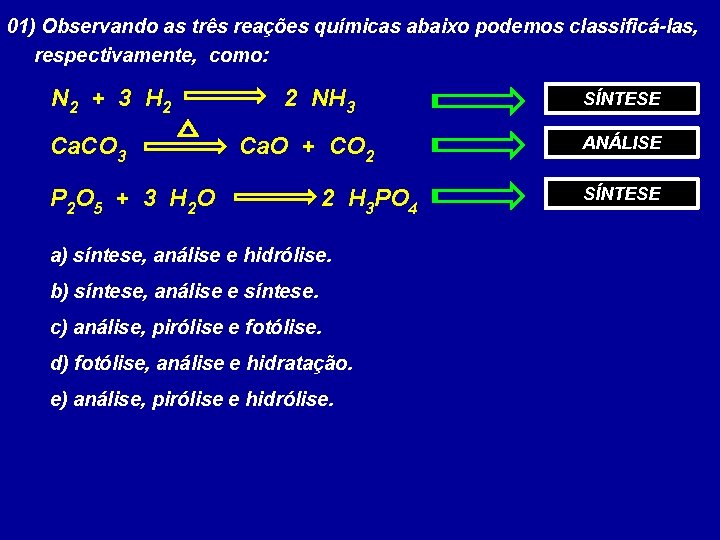
01) Observando as três reações químicas abaixo podemos classificá-las, respectivamente, como: N 2 + 3 H 2 Ca. CO 3 2 NH 3 Ca. O + CO 2 P 2 O 5 + 3 H 2 O 2 H 3 PO 4 a) síntese, análise e hidrólise. b) síntese, análise e síntese. c) análise, pirólise e fotólise. d) fotólise, análise e hidratação. e) análise, pirólise e hidrólise. SÍNTESE ANÁLISE SÍNTESE

02) A reação química: Cu(OH)2 Cu. O + H 2 O é: a) síntese total. b) deslocamento. c) dupla troca. d) análise total. e) análise parcial. ANÁLISE PARCIAL

03) A decomposição de uma substância provocada pela eletricidade recebe o nome especial de: a) pirólise. b) hidrólise. c) eletrólise. d) fotólise. e) deslocamento.

04) No filme fotográfico, quando exposto à luz, ocorre à reação: 2 Ag. Br 2 Ag + Br 2 Essa reação pode ser classificada como: a) pirólise. b) eletrólise. c) fotólise. d) síntese. e) simples troca.

05) (UFRJ) A reação que representa a formação do cromato de chumbo II, que é um pigmento amarelo usado em tintas, é representada pela equação. . . Pb(CH 3 COO)2 + Na 2 Cr. O 4 Pb. Cr. O 4 + 2 Na. CH 3 COO Que é uma reação de: a) oxirredução. b) dupla troca. c) síntese. d) deslocamento. e) decomposição.

06) Colocando-se um pedaço de zinco numa solução aquosa de sulfato de cobre II observa-se a ocorrência da reação abaixo: Zn + Cu. SO 4 Cu + Zn. SO 4 Esta reação pode ser classificada como: a) reação de análise parcial. b) reação de síntese total. c) reação de dupla troca. d) reação de análise total e) reação de deslocamento.

As reações que apresentam elementos químicos sofrendo oxidação ou redução são denominadas de REAÇÕES DE OXI-REDUÇÃO 0 +5 +5 3 P + 5 HNO 3 + 2 H 2 O +2 3 H 3 PO 4 + 5 NO O fósforo sofre OXIDAÇÃO, pois seu Nox aumenta O nitrogênio sofre REDUÇÃO, pois seu Nox diminui


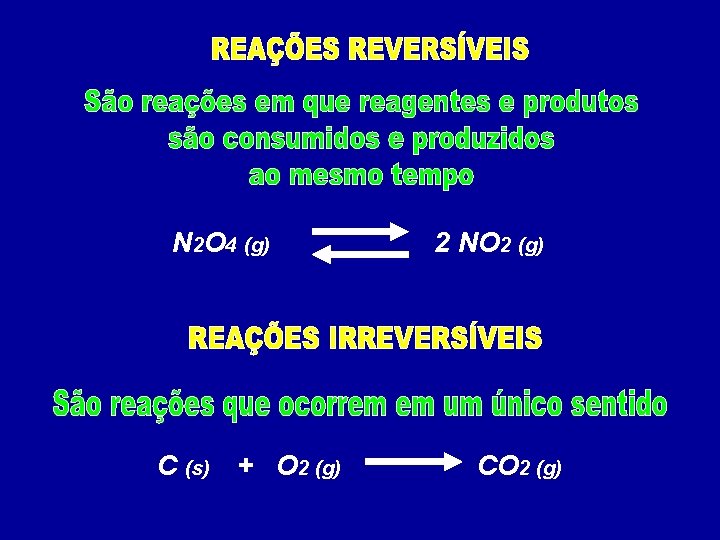
N 2 O 4 (g) C (s) + O 2 (g) 2 NO 2 (g) CO 2 (g)

Zn + 2 HCl H 2 + Zn. Cl 2


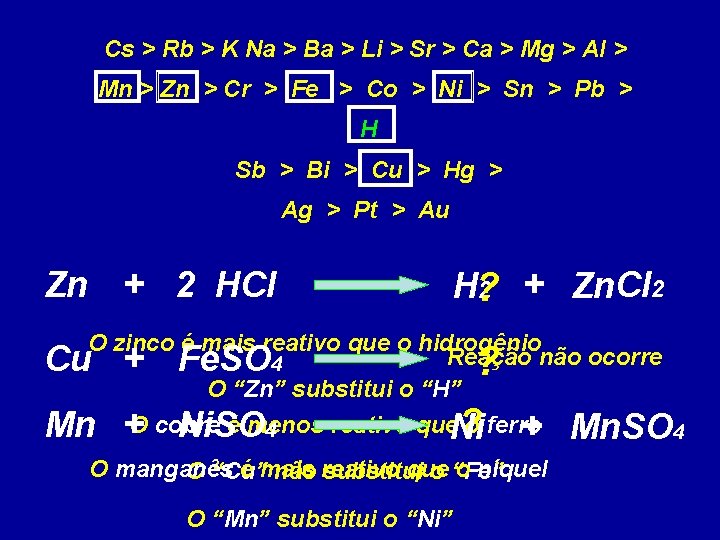
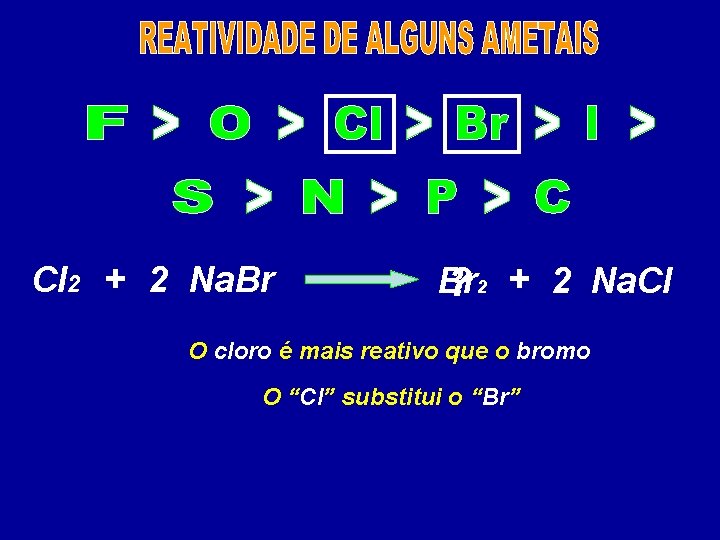
Cs > Rb > K Na > Ba > Li > Sr > Ca > Mg > Al > Mn > Zn > Cr > Fe > Co > Ni > Sn > Pb > H Sb > Bi > Cu > Hg > Ag > Pt > Au Zn + 2 HCl H? 2 + Zn. Cl 2 O zinco é mais reativo que o hidrogênio Reação não ocorre Cu + Fe. SO 4 O “Zn” substitui o “H” é menos reativo que. Ni o ferro Mn +O cobre Ni. SO 4 + Mn. SO 4 ? ? O manganês é mais que o níquel O “Cu” não reativo substitui o “Fe” O “Mn” substitui o “Ni”

Cl 2 + 2 Na. Br Br ? 2 + 2 Na. Cl O cloro é mais reativo que o bromo O “Cl” substitui o “Br”

2 KI + Pb(NO 3)2 H 2 SO 4 + Na 2 SO 4 HCl. O 4 + KCN 2 KNO 3 + Pb. I 2 Na 2 SO 4 + H 2 CO O 3+ CO 2 HCN + KCl. O 4 ácido mais fraco


4 Al + 3 O 2 2 Al 2 O 3 É um método muito útil para as equações químicas simples e baseia-se nas seguintes regras: a)esses Raciocinar, inicialmente, com elementos que d) c) b) Com Escolhido Se vários elementos odois elemento, coeficientes, satisfazem inverter acerte seus aoscondição índices os demais; apareçam emde uma única substância continue doanterior, 1º para somente oescolha 2º membro com os preferência da elementos equação, que já em cadamaiores membro da equação e possuem vice-versa, aquele coeficientes possua usando-os em como um índices coeficientes dos membros Al e 1 e 2 Al (2º membro) O 2 e 3 2 x 2=4

1 Al 2(CO 3)3 Al 12 O 3 + CO 2 3 a) Raciocinar, inicialmente, com os elementos que apareçam em uma única substância em cada membro da equação Al e 12 C 3 e 1 b) Se vários elementos satisfazem a condição anterior, escolha de preferência aquele possua maiores índices c) Escolhido o elemento, inverter seus índices do 1º para o 2º membro da equação, e vice-versa, usando-os como coeficientes Al (1º membro) 1 x 2=2 C 3 e 1

02) (UEPG – PR) Ao efetuarmos o balanceamento da equação da reação 1 H 2 S + 4 Br 2 + 4 H 2 O 1 H 2 SO 4 + 8 HBr podemos observar que a soma de seus menores coeficientes é: a) 10. b) 12. c) 14. d) 15. e) 18. 1 + 4 + 1 + 8 = 18

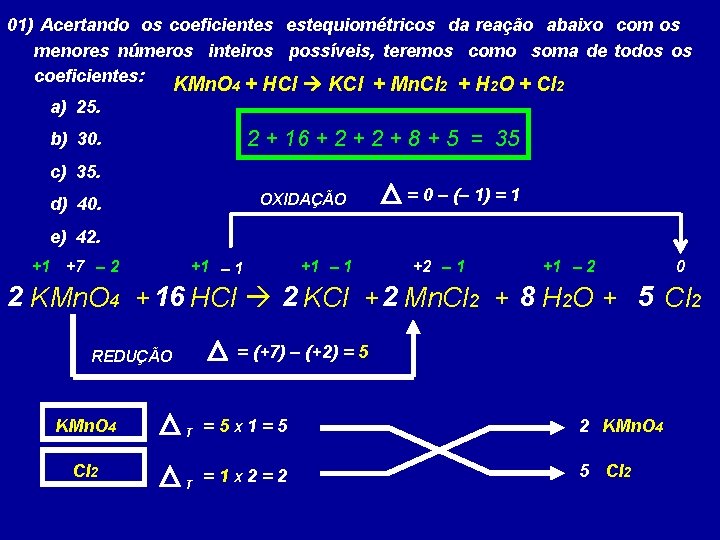
03) Acertando os coeficientes estequiométricos da reação abaixo com os menores números inteiros possíveis, teremos como soma de todos os coeficientes: 2 KMn. O 4 + 16 1 8 HCl a) 25. b) 30. c) 35. d) 40. e) 42. 2 KCl 1 4 H 2 O + 5/2 5 Cl 2 + 12 Mn. Cl 2 + 8 2 + 16 + 2 + 8 + 5 = 35

04) Os coeficientes estequiométricos do ácido e da base, respectivamente, na reação abaixo balanceada com os menores valores inteiros possíveis são: 4 Al(OH)3 + 3 H 4 Si. O 4 1 Al 4(Si. O 4)3 + 12 H 2 O a) 4 e 3. ácido b) 3 e 4. H 4 Si. O 4 Al(OH)3 3 4 c) 1 e 12. d) 12 e 1. e) 3 e 1. base

Este método consiste em atribuir coeficientes literais às substâncias que figuram na reação A seguir, armamos uma equação para cada elemento, baseada no fato de que o total de átomos desse elemento deve ser o mesmo em cada membro

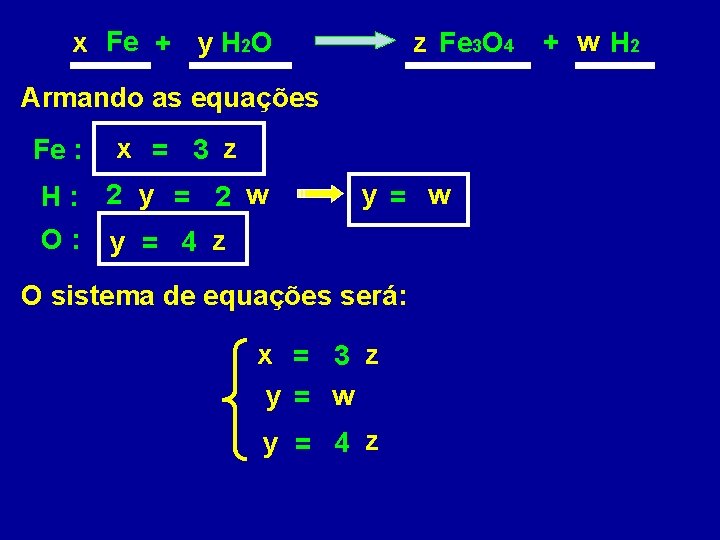
x Fe + y H 2 O z Fe 3 O 4 Armando as equações Fe : x = 3 z H: 2 y = 2 w O: y = w y = 4 z O sistema de equações será: x = 3 z y = w y = 4 z + w H 2

x = 3 z y = w y = 4 z Para resolver o sistema escolhemos uma variável e atribuímos a ela um valor qualquer z=1 x == 33 x z 1 yy == 44 xz 1 Como “ w = y ”, teremos que “ w = 4 ” Substituindo os valores na equação: x 3 Fe + y 4 H 2 O z 1 Fe 3 O 4 + w 4 H 2

Esse método fundamenta-se no fato de que o total de elétrons cedidos é igual ao total de elétrons recebidos

REDUÇÃO 0 N: = (+5) – (+2) = 3 +5 +5 3 P + 5 HNO 3 + 2 H 2 O OXIDAÇÃO P: +2 3 H 3 PO 4 + 5 NO = (+5) – 0 = 5 As regras práticas a serem seguidas são: a) Descobrir todos os elementos que sofreram oxidação e redução, isto é, mudaram o número de oxidação. b) Calculemos agora as variações de Nox desses elementos, que chamaremos de (delta). Criamos então dois ramais; o de oxidação e o de redução c) Multiplicamos a variação do Nox do elemento, na substância escolhida, pela sua atomicidade. Teremos, neste caso, a variação total do Nox. d) Dar a inversão dos resultados para determinar os coeficientes. P Ramal de oxidação: t=5 x 1=5 3 P HNO 3 Ramal de redução: t=3 x 1=3 5 HNO 3

01) Acertando os coeficientes estequiométricos da reação abaixo com os menores números inteiros possíveis, teremos como soma de todos os coeficientes: KMn. O 4 + HCl KCl + Mn. Cl 2 + H 2 O + Cl 2 a) 25. 2 + 16 + 2 + 8 + 5 = 35 b) 30. c) 35. OXIDAÇÃO d) 40. = 0 – (– 1) = 1 e) 42. +1 +7 – 2 +1 – 1 +2 – 1 +1 – 2 0 2 KMn. O 4 + 16 HCl 2 KCl + 2 Mn. Cl 2 + 8 H 2 O + 5 Cl 2 = (+7) – (+2) = 5 REDUÇÃO KMn. O 4 Cl 2 T =5 X 1=5 2 KMn. O 4 T =1 X 2=2 5 Cl 2

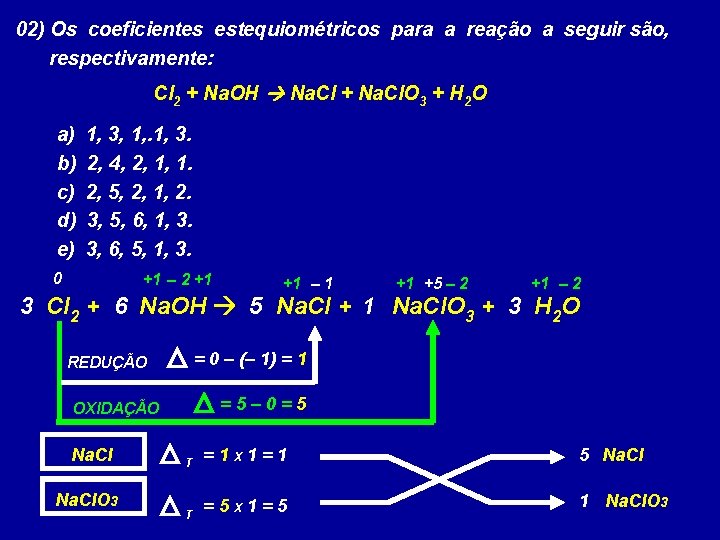
02) Os coeficientes estequiométricos para a reação a seguir são, respectivamente: Cl 2 + Na. OH Na. Cl + Na. Cl. O 3 + H 2 O a) b) c) d) e) 1, 3, 1, 3. 2, 4, 2, 1, 1. 2, 5, 2, 1, 2. 3, 5, 6, 1, 3. 3, 6, 5, 1, 3. 0 +1 – 2 +1 +1 – 1 +1 +5 – 2 +1 – 2 3 Cl 2 + 6 Na. OH 5 Na. Cl + 1 Na. Cl. O 3 + 3 H 2 O = 0 – (– 1) = 1 REDUÇÃO =5– 0=5 OXIDAÇÃO Na. Cl. O 3 T =1 X 1=1 5 Na. Cl T =5 X 1=5 1 Na. Cl. O 3

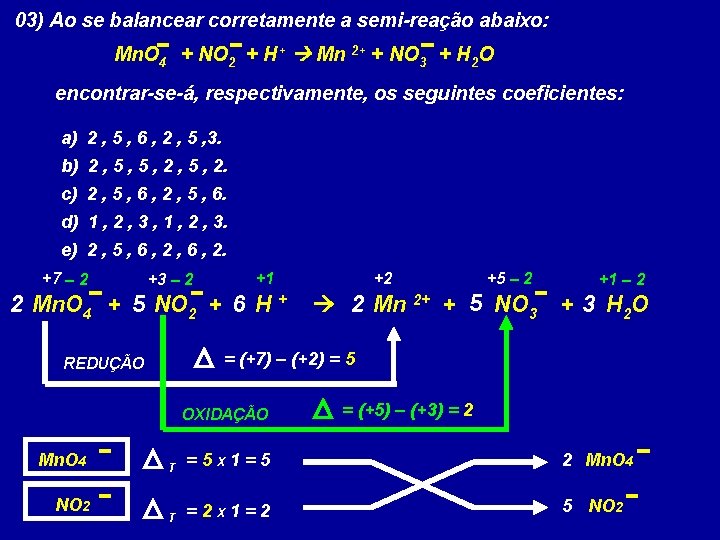
03) Ao se balancear corretamente a semi-reação abaixo: Mn. O 4 + NO 2 + H+ Mn 2+ + NO 3 + H 2 O encontrar-se-á, respectivamente, os seguintes coeficientes: a) 2 , 5 , 6 , 2 , 5 , 3. b) 2 , 5 , 2. c) 2 , 5 , 6 , 2 , 5 , 6. d) 1 , 2 , 3 , 1 , 2 , 3. e) 2 , 5 , 6 , 2. +7 – 2 +3 – 2 +1 2 Mn. O 4 + 5 NO 2 + 6 H + OXIDAÇÃO NO 2 +5 – 2 2 Mn 2+ + 5 NO 3 +1 – 2 + 3 H 2 O = (+7) – (+2) = 5 REDUÇÃO Mn. O 4 +2 = (+5) – (+3) = 2 T =5 X 1=5 2 Mn. O 4 T =2 X 1=2 5 NO 2

04) Acerte, por oxi-redução, os coeficientes das equações abaixo: +3 – 1 +1 – 2 +1 +1 +6 – 2 +1 – 1 +1 – 2 2 Cr. Cl 3 + 3 H 2 O 2 + 10 Na. OH 2 Na 2 Cr. O 4 + 6 Na. Cl + 8 H 2 O = (+6) – (+3) = 3 OXIDAÇÃO REDUÇÃO = (– 1) – (– 2) = 1 Cr. Cl 3 T =3 X 1=3 2 Cr. Cl 3 H 2 O 2 T =1 X 2=2 3 H 2 O 2
