C H N O tartalm vegyletek 96 5



- Slides: 12

C, H, N, O – tartalmú vegyületek (96, 5 %). Kémiai reakciók H 2 O közegben mennek végbe. A sejt a legbonyolultabb kémiai rendszer. Makromolekulák. Szabályzó mechanizmusok térben és időben. Kovalens és nem-kovalens kötések révén összekapcsolodó atomok.

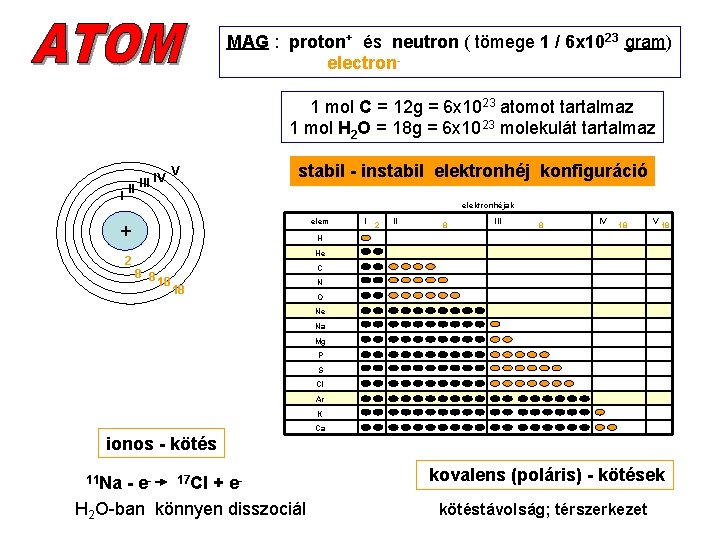
MAG : proton+ és neutron ( tömege 1 / 6 x 1023 gram) electron 1 mol C = 12 g = 6 x 1023 atomot tartalmaz 1 mol H 2 O = 18 g = 6 x 1023 molekulát tartalmaz I IV II III V stabil - instabil elektronhéj konfiguráció elektronhéjak elem + 2 II 8 III 8 IV 18 H He 8 8 18 C 18 N O Ne Na Mg P S Cl Ar K Ca ionos - kötés 11 Na - e- 17 Cl + e. H 2 O-ban könnyen disszociál kovalens (poláris) - kötések kötéstávolság; térszerkezet

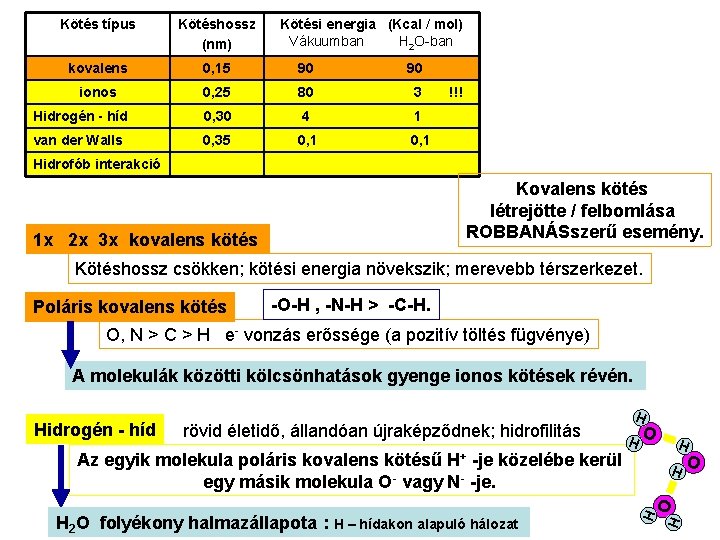
Kötés típus Kötéshossz (nm) Kötési energia (Kcal / mol) Vákuumban H 2 O-ban kovalens 0, 15 90 90 ionos 0, 25 80 3 Hidrogén - híd 0, 30 4 1 van der Walls 0, 35 0, 1 !!! Hidrofób interakció Kovalens kötés létrejötte / felbomlása ROBBANÁSszerű esemény. 1 x 2 x 3 x kovalens kötés Kötéshossz csökken; kötési energia növekszik; merevebb térszerkezet. Poláris kovalens kötés -O-H , -N-H > -C-H. O, N > C > H e- vonzás erőssége (a pozitív töltés fügvénye) A molekulák közötti kölcsönhatások gyenge ionos kötések révén. rövid életidő, állandóan újraképződnek; hidrofilitás H H O H+ Az egyik molekula poláris kovalens kötésű -je közelébe kerül egy másik molekula O- vagy N- -je. O H H H 2 O folyékony halmazállapota : H – hídakon alapuló hálozat H H Hidrogén - híd O

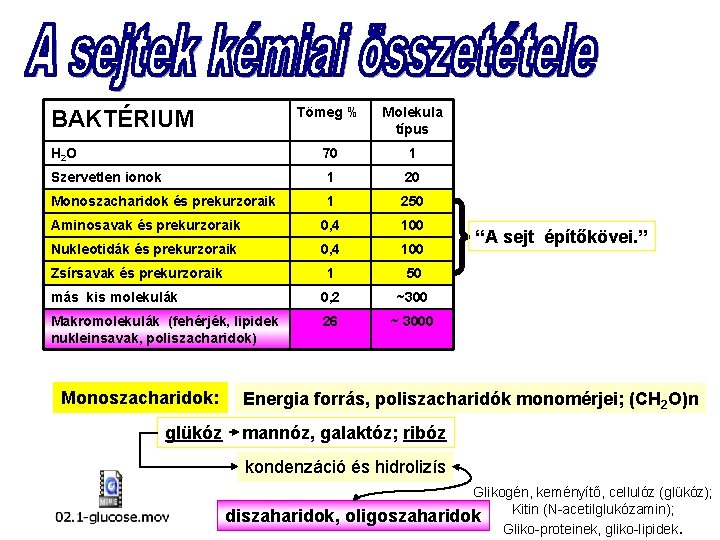
Tömeg % Molekula típus H 2 O 70 1 Szervetlen ionok 1 20 Monoszacharidok és prekurzoraik 1 250 Aminosavak és prekurzoraik 0, 4 100 Nukleotidák és prekurzoraik 0, 4 100 1 50 más kis molekulák 0, 2 ~300 Makromolekulák (fehérjék, lipidek nukleinsavak, poliszacharidok) 26 ~ 3000 BAKTÉRIUM Zsírsavak és prekurzoraik Monoszacharidok: glükóz “A sejt építőkövei. ” Energia forrás, poliszacharidók monomérjei; (CH 2 O)n mannóz, galaktóz; ribóz kondenzáció és hidrolizís diszaharidok, Glikogén, keményítő, cellulóz (glükóz); Kitin (N-acetilglukózamin); oligoszaharidok Gliko-proteinek, gliko-lipidek.

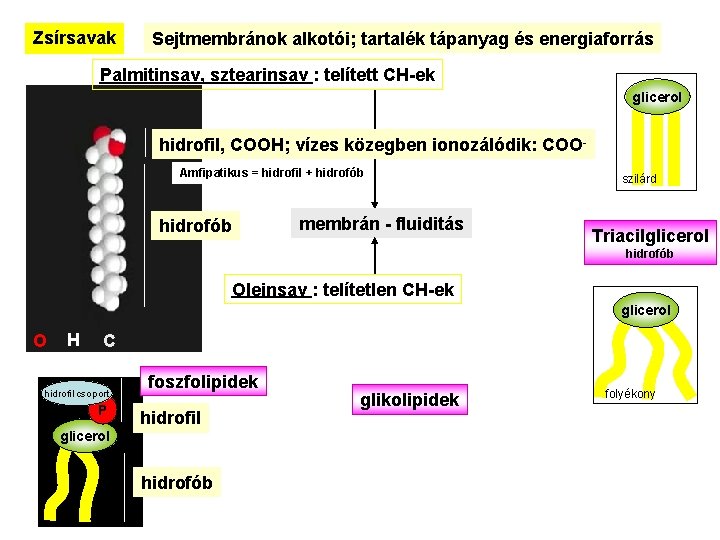
Zsírsavak Sejtmembránok alkotói; tartalék tápanyag és energiaforrás Palmitinsav, sztearinsav : telített CH-ek glicerol hidrofil, COOH; vízes közegben ionozálódik: COOAmfipatikus = hidrofil + hidrofób membrán - fluiditás szilárd Triacilglicerol hidrofób Oleinsav : telítetlen CH-ek glicerol O H C hidrofil csoport P foszfolipidek hidrofil glicerol hidrofób glikolipidek folyékony

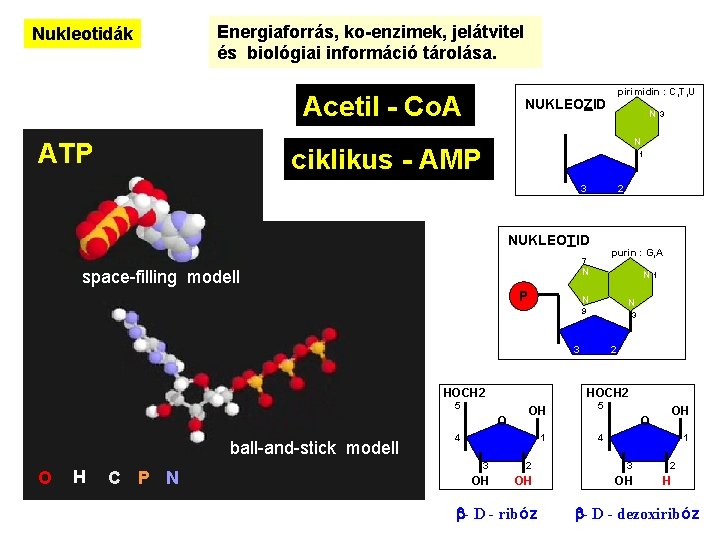
Nukleotidák Energiaforrás, ko-enzimek, jelátvitel és biológiai információ tárolása. Acetil - Co. A ATP pirimidin : C, T, U NUKLEOZID N N ciklikus - AMP 1 3 2 NUKLEOTID purin : G, A 7 N space-filling modell P N N 3 3 HOCH 2 O H C P N 2 HOCH 2 N O ball-and-stick modell 1 N 9 5 3 N OH 5 1 4 4 N 1 3 2 3 OH OH OH b- D - ribóz N OH O 2 H b- D - dezoxiribóz

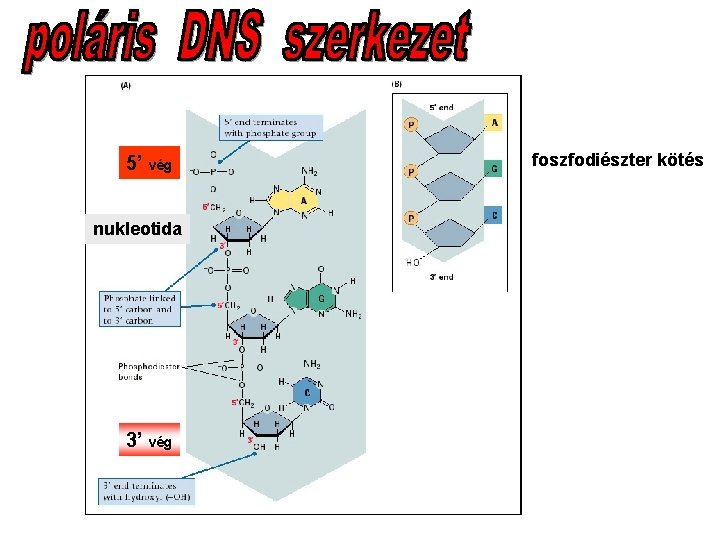
5’ vég nukleotida 3’ vég foszfodiészter kötés

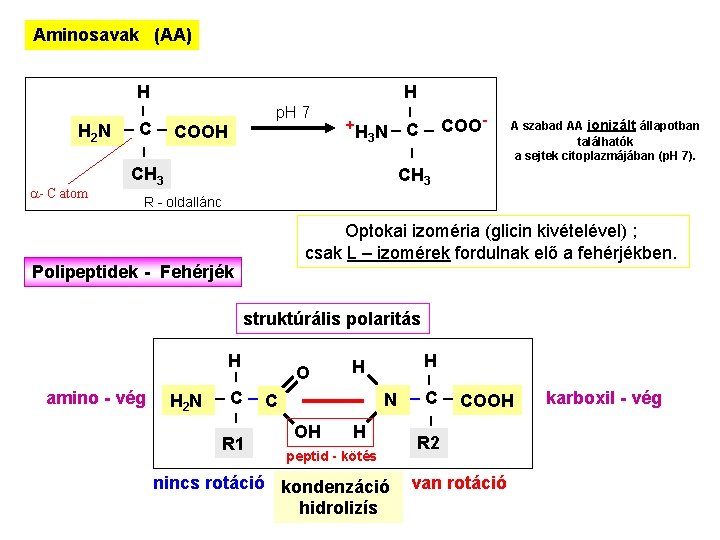
Aminosavak (AA) H – p. H 7 – a- C atom +H N – COO 3 – H 2 N – COOH – H CH 3 A szabad AA ionizált állapotban találhatók a sejtek citoplazmájában (p. H 7). R - oldallánc Optokai izoméria (glicin kivételével) ; csak L – izomérek fordulnak elő a fehérjékben. Polipeptidek - Fehérjék struktúrális polaritás R 1 H – H N – COOH H 2 N – C – amino - vég O OH H peptid - kötés nincs rotáció kondenzáció hidrolizís – – H R 2 van rotáció karboxil - vég

Tömeg % Molekul a típus H 2 O 70 1 Szervetlen ionok 1 20 Monoszacharidok és prekurzoraik 1 250 Aminosavak és prekurzoraik 0, 4 100 Nukleotidák és prekurzoraik 0, 4 100 1 50 más kis molekulák 0, 2 ~300 Makromolekulák (fehérjék, nukleinsavak, poliszacharidok) 26 ~ 3000 BAKTÉRIUM Zsírsavak és prekurzoraik Ribulóz – bifoszfát – karboxiláz (kloroplasztis), a legfontosabb enzim A makromolekulákban talalálható monomérek szekvenciája nem véletlenszerű. 200 AA-t tartalmazó fehérje : 20200 1000 nukleotidát tartalmazó DNS-ben 41000 A celluláris makromolekulák képződése a monomérek kondenzációja révén történik.

1 x kovalens kötések nagyfokú flexibilitást eredményeznek non – kovalens kötések 1 (instabil konformáció). makromolekulák TÉRBELI KONFORMÁCIÓját Ionos kötések : kötési energiája alacsony vízes közegben Az enzimek negatív töltésű oldallánca meghatározó szerepet játszik a pozitív töltésű szubsztrát pontos illeszkedésében. 2 H – hídak tarják össze a DNS két szálát. 3 Van der Waals – hídak : elektromos vonzáson alapuló kölcsönhatás. Két atom kölcsönesen vonza egymást eladdig amig a magjaik közötti távolság megegyezik a van der Waals sugaraik összegével. van der Waals radius H C N 0, 12 nm 0, 15 nm O 0, 14 nm C C 0, 4 nm van der Waals híd C C 0, 15 nm C-C C C 0, 13 nm C=C Komplementer molekulák közös konformációjának kialakítása.

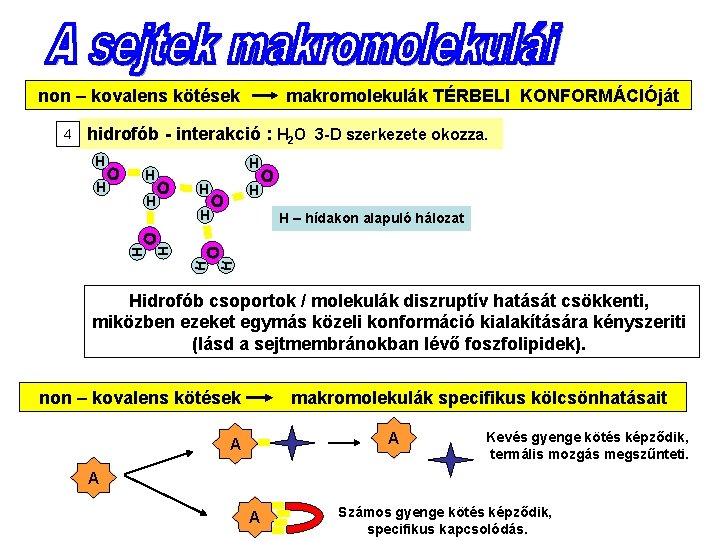
non – kovalens kötések 4 makromolekulák TÉRBELI KONFORMÁCIÓját hidrofób - interakció : H 2 O 3 -D szerkezete okozza. H H O H H H O O H – hídakon alapuló hálozat O H H O Hidrofób csoportok / molekulák diszruptív hatását csökkenti, miközben ezeket egymás közeli konformáció kialakítására kényszeriti (lásd a sejtmembránokban lévő foszfolipidek). non – kovalens kötések makromolekulák specifikus kölcsönhatásait A A Kevés gyenge kötés képződik, termális mozgás megszűnteti. A A Számos gyenge kötés képződik, specifikus kapcsolódás.

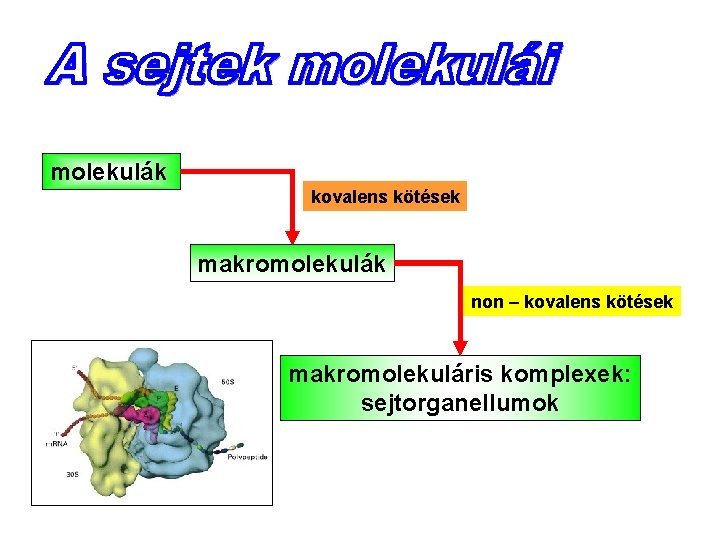
molekulák kovalens kötések makromolekulák non – kovalens kötések makromolekuláris komplexek: sejtorganellumok