BRIM 3 tude de phase III vemurafenib versus
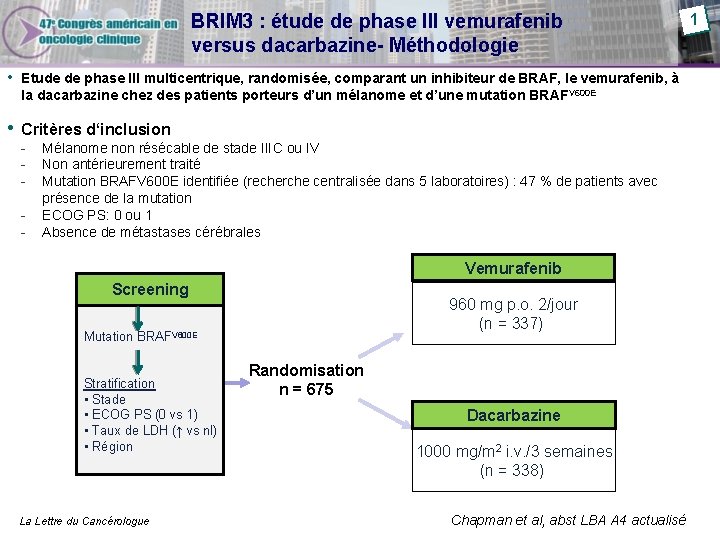
BRIM 3 : étude de phase III vemurafenib versus dacarbazine- Méthodologie • Etude de phase III multicentrique, randomisée, comparant un inhibiteur de BRAF, le vemurafenib, à la dacarbazine chez des patients porteurs d’un mélanome et d’une mutation BRAF V 600 E • Critères d‘inclusion - Mélanome non résécable de stade IIIC ou IV Non antérieurement traité Mutation BRAFV 600 E identifiée (recherche centralisée dans 5 laboratoires) : 47 % de patients avec présence de la mutation ECOG PS: 0 ou 1 Absence de métastases cérébrales Vemurafenib Screening 960 mg p. o. 2/jour (n = 337) Mutation BRAFV 600 E Stratification • Stade • ECOG PS (0 vs 1) • Taux de LDH (↑ vs nl) • Région La Lettre du Cancérologue Randomisation n = 675 Dacarbazine 1000 mg/m 2 i. v. /3 semaines (n = 338) Chapman et al, abst LBA A 4 actualisé 1
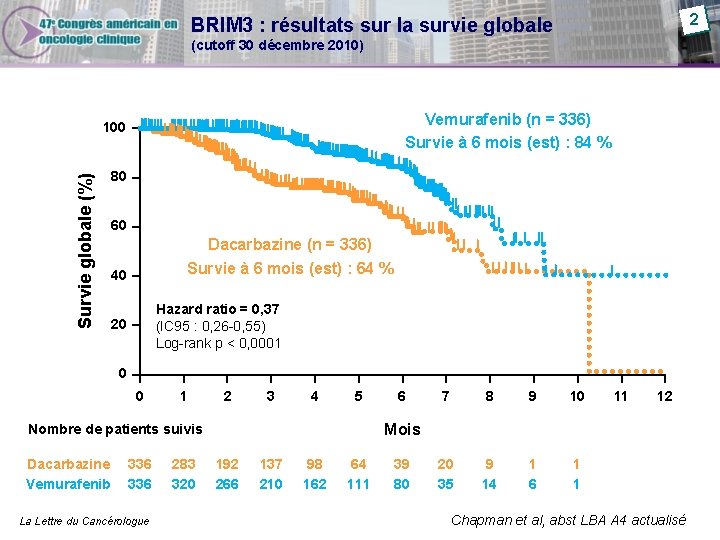
2 BRIM 3 : résultats sur la survie globale (cutoff 30 décembre 2010) Vemurafenib (n = 336) Survie à 6 mois (est) : 84 % Survie globale (%) 100 80 60 Dacarbazine (n = 336) Survie à 6 mois (est) : 64 % 40 Hazard ratio = 0, 37 (IC 95 : 0, 26 -0, 55) Log-rank p < 0, 0001 20 0 0 1 2 3 4 5 336 La Lettre du Cancérologue 283 320 7 8 9 10 20 35 9 14 1 6 1 1 11 12 Mois Nombre de patients suivis Dacarbazine Vemurafenib 6 192 266 137 210 98 162 64 111 39 80 Chapman et al, abst LBA A 4 actualisé
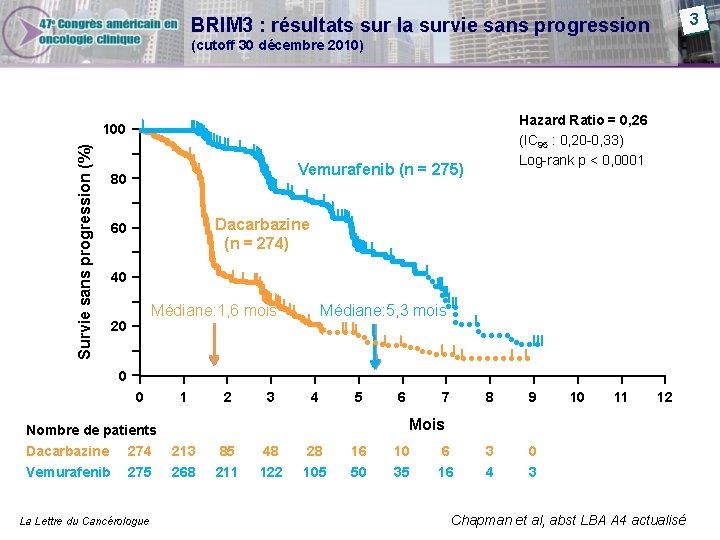
3 BRIM 3 : résultats sur la survie sans progression (cutoff 30 décembre 2010) Hazard Ratio = 0, 26 (IC 95 : 0, 20 -0, 33) Log-rank p < 0, 0001 Survie sans progression (%) 100 Vemurafenib (n = 275) 80 Dacarbazine (n = 274) 60 40 Médiane: 5, 3 mois Médiane: 1, 6 mois 20 0 0 1 2 3 4 5 274 275 La Lettre du Cancérologue 7 8 9 3 4 0 3 10 11 12 Mois Nombre de patients Dacarbazine Vemurafenib 6 213 268 85 211 48 122 28 105 16 50 10 35 6 16 Chapman et al, abst LBA A 4 actualisé
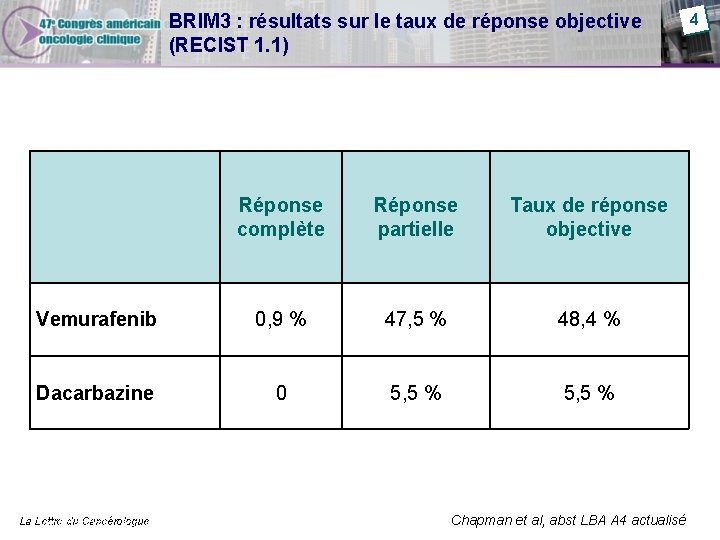
BRIM 3 : résultats sur le taux de réponse objective (RECIST 1. 1) Réponse complète Réponse partielle Taux de réponse objective Vemurafenib 0, 9 % 47, 5 % 48, 4 % Dacarbazine 0 5, 5 % La Confidential Lettre du Cancérologue – for internal use only Chapman et al, abst LBA A 4 actualisé 4
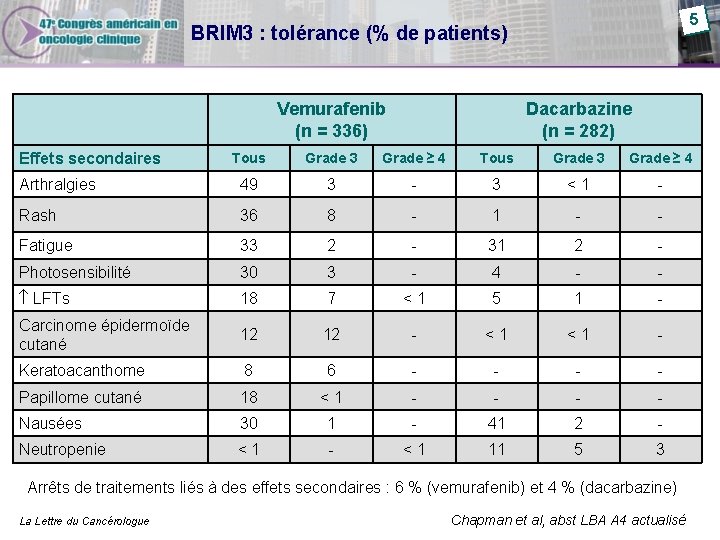
5 BRIM 3 : tolérance (% de patients) Vemurafenib (n = 336) Effets secondaires Dacarbazine (n = 282) Tous Grade 3 Grade ≥ 4 Arthralgies 49 3 - 3 <1 - Rash 36 8 - 1 - - Fatigue 33 2 - 31 2 - Photosensibilité 30 3 - 4 - - LFTs 18 7 <1 5 1 - Carcinome épidermoïde cutané 12 12 - <1 <1 - Keratoacanthome 8 6 - - Papillome cutané 18 <1 - - Nausées 30 1 - 41 2 - Neutropenie <1 - <1 11 5 3 Arrêts de traitements liés à des effets secondaires : 6 % (vemurafenib) et 4 % (dacarbazine) La Lettre du Cancérologue Chapman et al, abst LBA A 4 actualisé
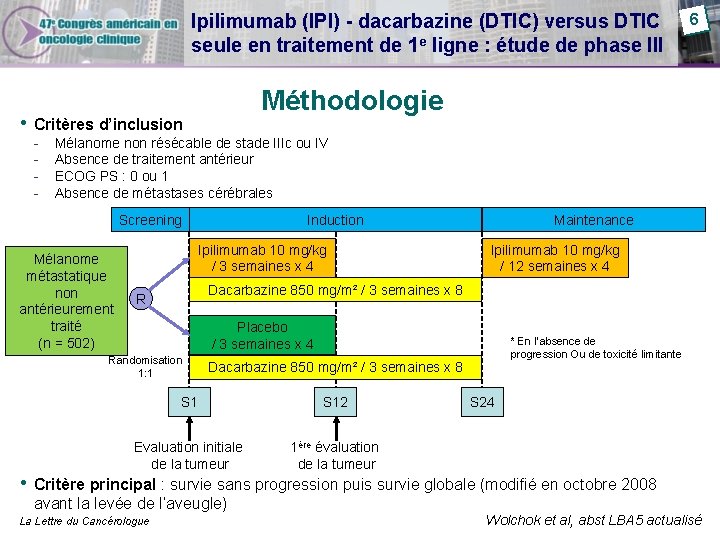
Ipilimumab (IPI) - dacarbazine (DTIC) versus DTIC seule en traitement de 1 e ligne : étude de phase III Méthodologie • Critères d’inclusion - 6 Mélanome non résécable de stade IIIc ou IV Absence de traitement antérieur ECOG PS : 0 ou 1 Absence de métastases cérébrales Screening Mélanome métastatique non antérieurement traité (n = 502) Induction Ipilimumab 10 mg/kg / 3 semaines x 4 Maintenance Ipilimumab 10 mg/kg / 12 semaines x 4 Dacarbazine 850 mg/m² / 3 semaines x 8 R Placebo / 3 semaines x 4 Randomisation 1: 1 * En l’absence de progression Ou de toxicité limitante Dacarbazine 850 mg/m² / 3 semaines x 8 S 12 Evaluation initiale de la tumeur 1ère évaluation de la tumeur S 24 • Critère principal : survie sans progression puis survie globale (modifié en octobre 2008 avant la levée de l’aveugle) La Lettre du Cancérologue Wolchok et al, abst LBA 5 actualisé
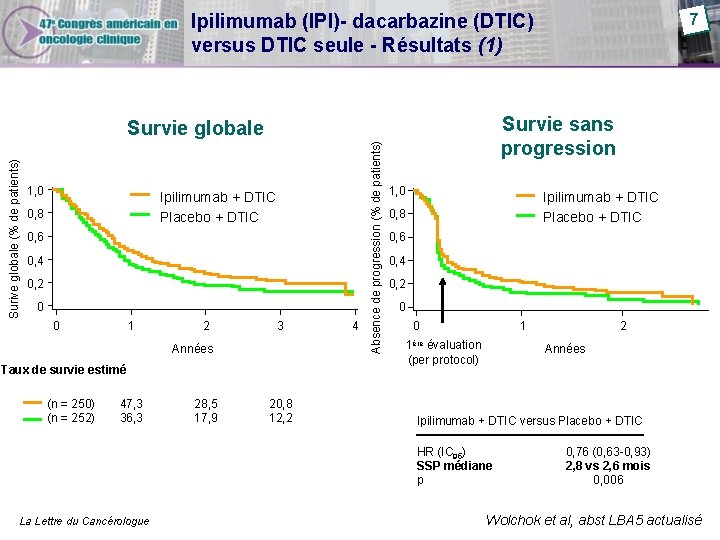
7 Ipilimumab (IPI)- dacarbazine (DTIC) versus DTIC seule - Résultats (1) Survie sans progression 1, 0 Ipilimumab + DTIC Placebo + DTIC 0, 8 0, 6 0, 4 0, 2 0 0 1 2 3 Années Taux de survie estimé (n = 250) (n = 252) 47, 3 36, 3 28, 5 17, 9 20, 8 12, 2 4 Absence de progression (% de patients) Surive globale (% de patients) Survie globale 1, 0 Ipilimumab + DTIC Placebo + DTIC 0, 8 0, 6 0, 4 0, 2 0 0 1 1ère évaluation (per protocol) Années Ipilimumab + DTIC versus Placebo + DTIC HR (IC 95) SSP médiane p La Lettre du Cancérologue 2 0, 76 (0, 63 -0, 93) 2, 8 vs 2, 6 mois 0, 006 Wolchok et al, abst LBA 5 actualisé
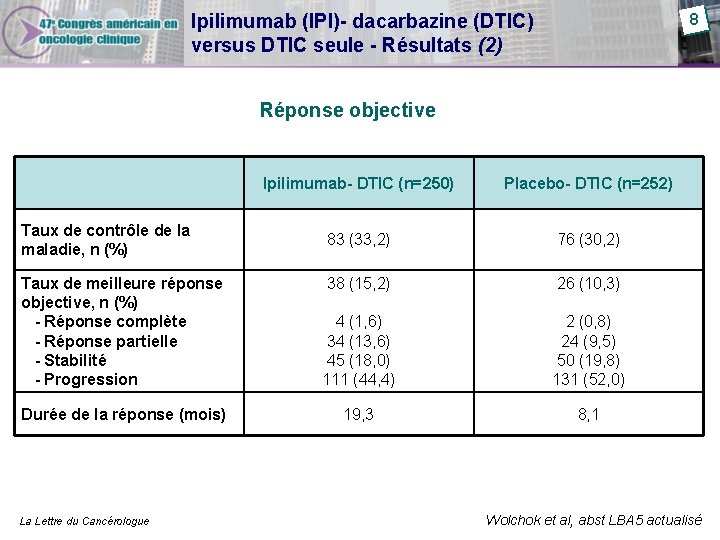
8 Ipilimumab (IPI)- dacarbazine (DTIC) versus DTIC seule - Résultats (2) Réponse objective Taux de contrôle de la maladie, n (%) Ipilimumab- DTIC (n=250) Placebo- DTIC (n=252) 83 (33, 2) 76 (30, 2) Taux de meilleure réponse objective, n (%) - Réponse complète - Réponse partielle - Stabilité - Progression 38 (15, 2) 26 (10, 3) 4 (1, 6) 34 (13, 6) 45 (18, 0) 111 (44, 4) 2 (0, 8) 24 (9, 5) 50 (19, 8) 131 (52, 0) Durée de la réponse (mois) 19, 3 8, 1 La Lettre du Cancérologue Wolchok et al, abst LBA 5 actualisé
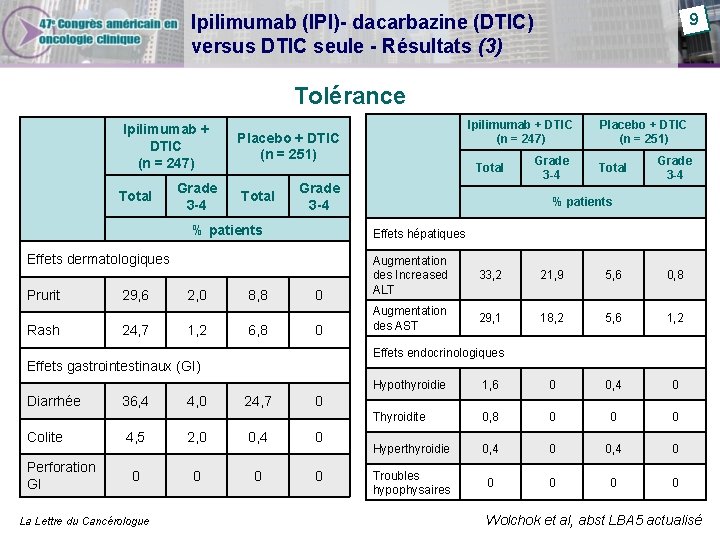
9 Ipilimumab (IPI)- dacarbazine (DTIC) versus DTIC seule - Résultats (3) Tolérance Ipilimumab + DTIC (n = 247) Total Grade 3 -4 Total Rash 24, 7 2, 0 1, 2 8, 8 6, 8 0 0 Colite Perforation GI 36, 4 4, 0 24, 7 Grade 3 -4 % patients Augmentation des Increased ALT 33, 2 21, 9 5, 6 0, 8 Augmentation des AST 29, 1 18, 2 5, 6 1, 2 Hypothyroidie 1, 6 0 0, 4 0 Thyroidite 0, 8 0 0 0 Hyperthyroidie 0, 4 0 Troubles hypophysaires 0 0 0 4, 5 2, 0 0, 4 0 0 0 La Lettre du Cancérologue Total Effets endocrinologiques Effets gastrointestinaux (GI) Diarrhée Grade 3 -4 Placebo + DTIC (n = 251) Effets hépatiques Effets dermatologiques 29, 6 Total Grade 3 -4 % patients Prurit Ipilimumab + DTIC (n = 247) Placebo + DTIC (n = 251) Wolchok et al, abst LBA 5 actualisé
- Slides: 9