Bindingstypen en eigenschappen van stoffen De chemische binding

Bindingstypen en eigenschappen van stoffen De chemische binding: krachten tussen atomen, moleculen en ionen

Moleculaire stoffen • Opgebouwd uit niet-metalen (NM + NM) • Atoombinding IN het molecuul TUSSEN de atomen • Atoombinding = gemeenschappelijke elektronenparen (g. e. p. ) • Atoombinding is sterk, moeilijk te verbreken. • Verbreekt bij ontleding van het molecuul. • Verbreekt NIET bij verdampen van een stof. • Verbreekt bij chemische reacties. • Hierbij ontstaan dus andere moleculen.

Moleculaire stoffen • Atoombinding tussen ongelijke atomen: polaire binding • Sterk polaire binding bij ‒O‒H, =N‒H, (H-F, C‒O, C‒F, etc. ) • Polaire binding: g. e. p. niet symmetrisch gedeeld, daardoor is het ene atoom elektronenrijk : , het andere elektronenarm: • Grootste elektronegativiteit (BINAS 40 A) bepaalt welk atoom δ‒ wordt. • Dipoolmoleculen (= polaire stoffen) als lading ongelijk verdeeld is over het hele molecuul. δ+ δ‒

Moleculaire stoffen • Moleculen trekken elkaar zwak aan: de vanderwaalsbinding (of: molecuulbinding). • Ongeladen kleine moleculen hebben zeer kleine vanderwaalskrachten; meestal gasvormig bij kamertemperatuur. • Grotere dipoolmoleculen hebben sterkere molecuulbinding

Moleculaire stoffen Vanderwaalsbinding verdwijnt bij • verdampen/koken • oplossen
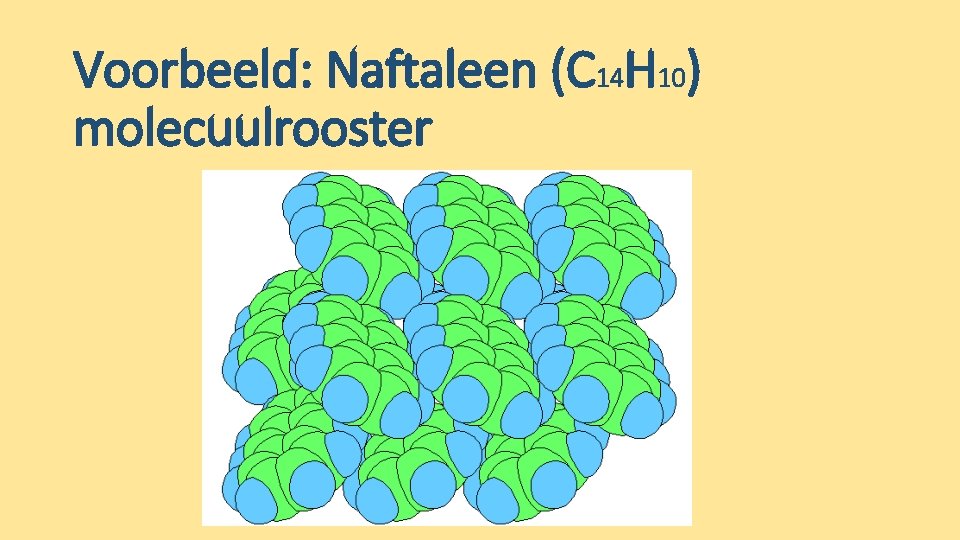
Voorbeeld: Naftaleen (C 14 H 10) molecuulrooster

Moleculaire stoffen • Vooral bij O‒H en N‒H groepen sterkere molecuulbinding: • H-bruggen! • Gevolg 1: relatief hoge kookpunten • Gevolg 2: mengen onderling goed • Gevolg 3: trekken water aan: hydrofiel
Moleculaire stoffen H-bruggen tekenen:
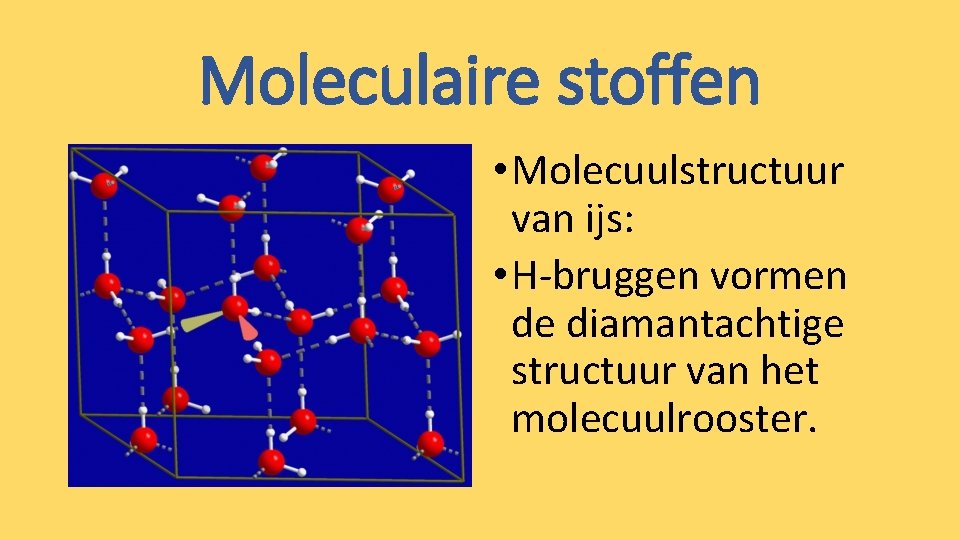
Moleculaire stoffen • Molecuulstructuur van ijs: • H-bruggen vormen de diamantachtige structuur van het molecuulrooster.

Ionaire stoffen • Opgebouwd uit metalen en niet-metalen (M+NM): zouten • Positieve metaalionen. • Negatieve ionen van niet-metalen. • Sterke ionbinding, dus: • Hoge smeltpunten. • Voorbeeld: ionrooster KCl. O 3 > >

Ionaire stoffen • Ionrooster hard en bros • Breekt bij vervorming:

Ionaire stoffen • Zouten vormen soms (zout)hydraten. • Bijvoorbeeld: Ca. Cl 2(s) + 6 H 2 O(l) → Ca. Cl 2. 6 H 2 O(s) • Zouten lossen soms op in water (BINAS 45), de ionen worden gehydrateerd: • Modellen van een gehydrateerd • kation (+) en anion (‒)

Ionaire stoffen • Oplossen van een zout (natriumchloride) • Hydratatie: dipoolmoleculen vormen ‘watermantels’. • https: //www. youtube. com/watch? v=xdedxfhcp. Wo

Ionaire stoffen • Uitkristalleren van zouten • Indampen • Na+ + Cl‒ → Na. Cl

Ionaire stoffen • Zoutoplossingen geleiden stroom: • Vrije ionen • Zoutoplossingen nooit als hele verhoudingsformule noteren in reactievergelijkingen! • Bijvoorbeeld: natriumcarbonaatoplossing =

Metaalbinding • Alleen bij metalen en legeringen. • Sterk type binding. • Metaalrooster: • regelmatige bolstapelingen
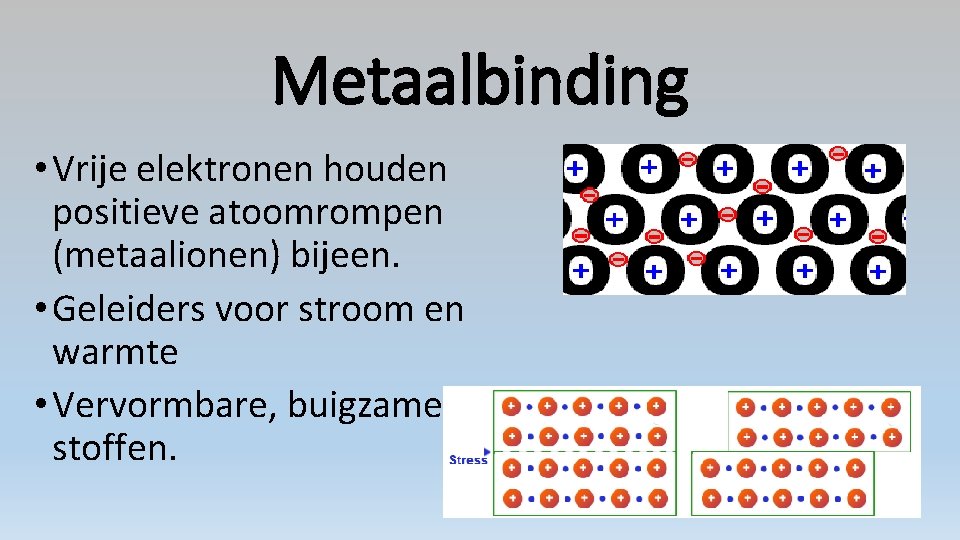
Metaalbinding • Vrije elektronen houden positieve atoomrompen (metaalionen) bijeen. • Geleiders voor stroom en warmte • Vervormbare, buigzame stoffen.

Atoomroosters • Elementen B, C, Si en P (groep 13/14): speciaal! • Atomen vormen onderling sterke covalente bindingen in een atoomrooster. • Geen afzonderlijke moleculen, alle atomen aan elkaar. • Harde stoffen met zeer hoge smeltpunten. • Lossen nergens in op.
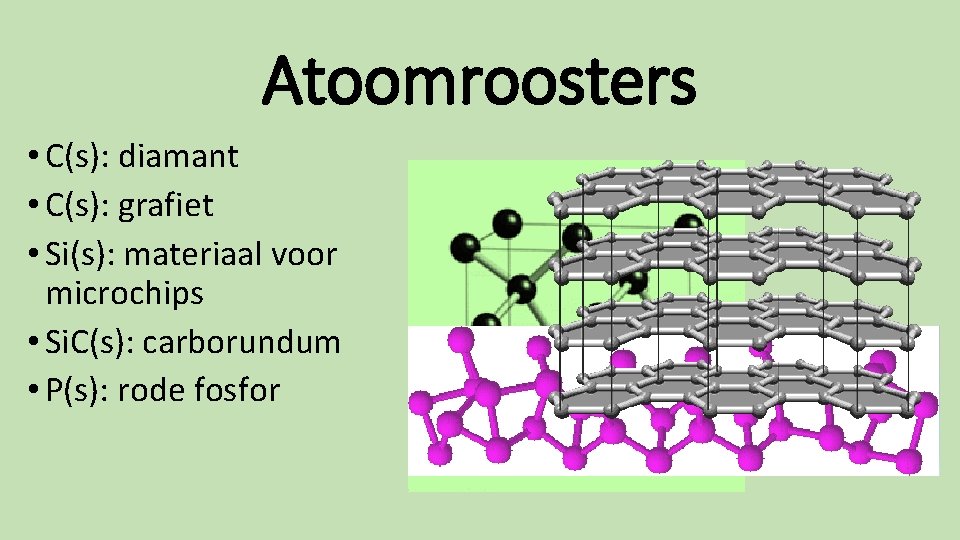
Atoomroosters • C(s): diamant • C(s): grafiet • Si(s): materiaal voor microchips • Si. C(s): carborundum • P(s): rode fosfor
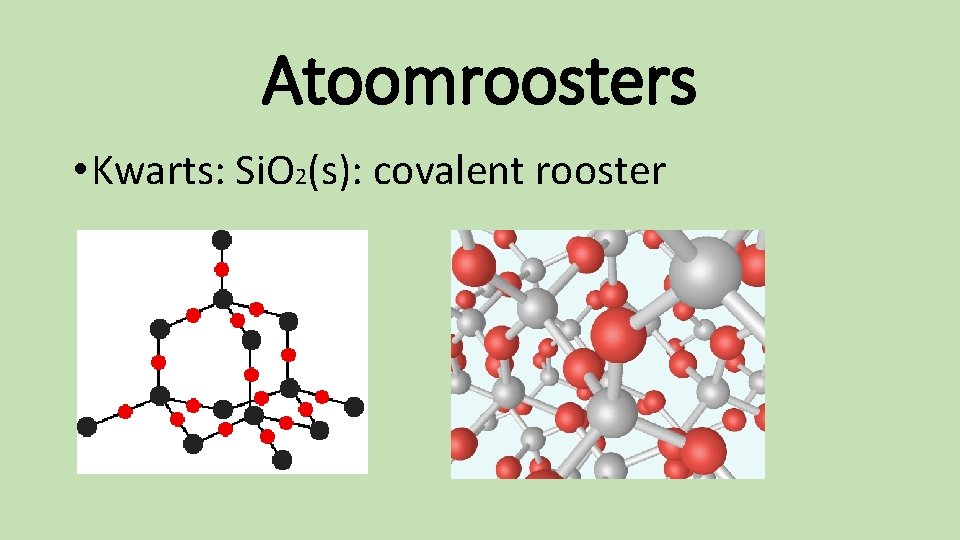
Atoomroosters • Kwarts: Si. O 2(s): covalent rooster

Atoomroosters • Silicaten: losse of verbonden Si. O 4 -tetraëders • Si: formele lading 4+; O: formele lading 2‒ • Metaalionen maken lading neutraal. Voorbeeld: Ca 2 Al 2 Si 4 O 13 (soort cement). • Toepassing: bouwmaterialen, zeolieten (katalysatoren, wasmiddelen, etc. )

Andere vormen van koolstof • Fullerenen (“Buckyballs”) • Grafeen • Grafaan (CH!) • Nanobuisjes grafeen
- Slides: 22