Bilansowanie rwna REDOKS zwizkw nieorganicznych Na czym to

Bilansowanie równań REDOKS związków nieorganicznych.

Na czym to polega? Cała metoda polega na poprawnym dobraniu współczynników stechiometrycznych na podstawie bilansu elektronowego utleniacza i reduktora. Sęk w tym aby liczba elektronów oddanych przez reduktor zgadzała się z liczbą elektronów przyjętych przez utleniacz.

W jaki sposób ustalić współczynniki stechiometryczne reakcji syntezy siarczku magnezu metodą bilansu elektronowego? 1. Napisz równanie reakcji chemicznej i ustal stopnie utlenienia pierwiastków 2. Napisz równania połówkowe 3. Ułóż bilans elektronowy 4. Wpisz ustalone liczby jaki współczynniki stechiometryczne do równania reakcji 5. Sprawdź poprawność doboru współczynników.

1. Napisz równanie reakcji chemicznej i ustal stopnie utlenienia pierwiastków 0 0 II -II Mg + S Mg. S Przypominam (temat nr 1 z tego działu) pierwiastki chemiczne w stanie wolnym mają zawsze stopień utlenienia równy 0.

2. Napisz równania połówkowe • Magnez zwiększa swój stopień utlenienia z 0 do II czyli oddaje 2 elektrony. 0 II Mg 2+ + 2 e • Siarka zmniejsza swój stopień utlenienia z 0 do –II czyli przyjmuje 2 elektrony. 0 -II S + 2 e- S 2 -

3. Ułóż bilans elektronowy • Procesy utleniania i redukcji zachodzą jednocześnie, a elektrony przepływają płynnie miedzy utleniaczem a reduktorem. W tym przypadku jedna strona przyjęła 2 elektrony a druga oddała więc bilans jest równy. Zapisujemy w tym momencie równanie zbudowane z dwóch równań połówkowych. 0 0 II -II Mg + S + 2 e- Mg. S + 2 e 0 0 II -II Mg + S Mg. S
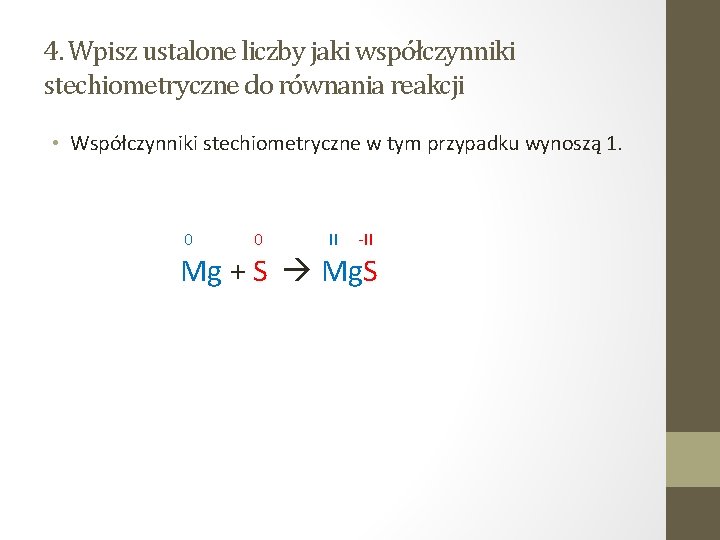
4. Wpisz ustalone liczby jaki współczynniki stechiometryczne do równania reakcji • Współczynniki stechiometryczne w tym przypadku wynoszą 1. 0 0 II -II Mg + S Mg. S

5. Sprawdź poprawność doboru współczynników. • Sprawdzamy liczbę jonów lub atomów pierwiastka chemicznego po obu stronach reakcji musi być równa. Mówiąc krócej „strona prawa równania reakcji musi się równać lewej” czyli produkty=substraty 0 0 II -II Mg + S Mg. S Strzałka pokazuje że siarka przekazała 2 elektrony magnezowi.
- Slides: 8