Bestimmung der Elementarladung In der Chemie Michael Faraday

Bestimmung der Elementarladung In der Chemie: Michael Faraday In der Physik: Robert Millikan www. rudolf-web. de j. rudolf@web. de

Chemie (Faraday): Vorbemerkung (1) 1. ) Avogadrokonstante (Loschmidtsche Zahl): Anzahl der Moleküle pro Mol: (Bestimmung: z. B. Ölfleckversuch) 2. ) Das Molvolumen idealer Gase: 3. ) Wasserstoffgas hat die chemische Formel H 2, besteht also aus zwei Wasserstoffatomen. Zahl der Atome in ein Mol Wasserstoffgas: 4. ) Wasser hat die chemische Formel H 2 O, besteht also aus zwei Atomen Wasserstoff, einem Atom Sauerstoff.

Chemie (Faraday): Vorbemerkung (2) n n 5. ) Elektrolyse: Positive und negative Ionen wandern zu den Elektroden und nehmen Elektronen auf bzw. geben überschüssige Elektronen ab. 6. ) Knallgaszelle: Fließt Strom durch eine Knallgaszelle, so wird Wasser in 1/3 (doppelt) negative Sauerstoffionen und 2/3 (einfach) positive Wasserstoffionen (also Protonen) zersetzt. Es bildet sich daraus Sauerstoffgas (O 2) und Wasserstoffgas (H 2 ).
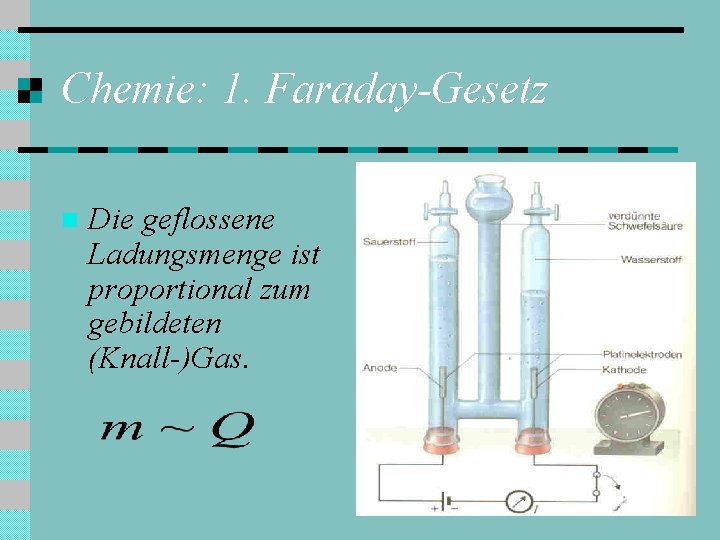
Chemie: 1. Faraday-Gesetz n Die geflossene Ladungsmenge ist proportional zum gebildeten (Knall-)Gas.

Chemie: Durchführung: 1. 2. Fließt ein Strom von 1 A eine Sekunde lang, also die Ladung 1 C, durch eine Knallgaszelle, so entsteht 0, 174 cm 3 Knallgas, 2/3 davon Wasserstoff, also 0, 116 cm 3 Wasserstoff H 2. Fließen 193 000 C, so werden 22, 414 dm 3 Wasserstoff (H 2), also ein Mol, erzeugt (22414 / 0, 116 = 193 000). Daraus folgt: Somit hat ein Atom die Ladung:

Chemie: Ergebnis n n Da ein Wasserstoffatom elektrisch neutral ist und aus einem Proton und einem Elektron besteht, so besitzen Elektron und Proton die Ladung Wir nennen diese Größe die Elementarladung e

Physik (Millikan) n Ziel: Unklar bleibt, ob die chemische Bestimmung nur einen Mittelwert liefert, ob es also Elektronen bzw. Protonen z. B. mit 0, 5 e und 1, 5 e gibt. n Ergebnis: Der amerikanische. Physiker R. A. Millikan veröffentlichte 1911 eine Messmethode, die nachwies, dass ein Elektron die Ladung e hat und dass es nur ganzzahlige Vielfache der Elementarladung gibt, z. B. hat ein Alpha. Teilchen die Ladung 2 e.

Physik: Millikan-Versuch n n n Millikan untersuchte das Verhalten von fein zerstäubten Öltröpfchen Beim Zerstäuben erhalten die Tröpfchen positive oder negative Überschussladungen Die Öltröpfchen bewegen sich in einem luftgefüllten Kondensator
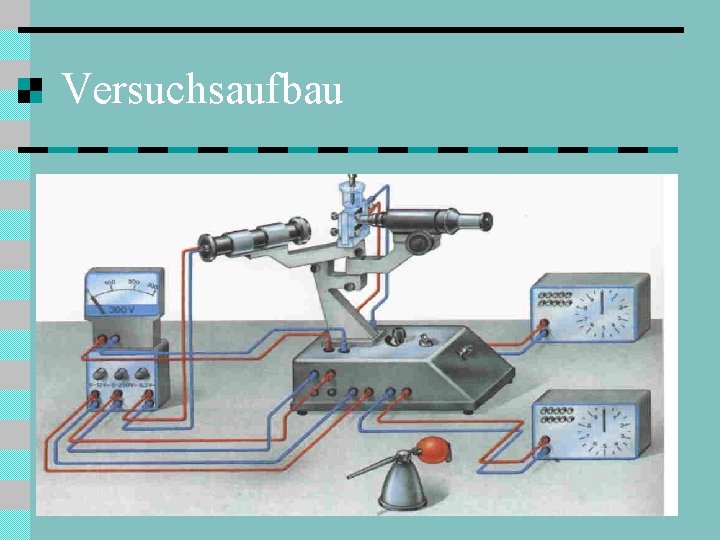
Versuchsaufbau
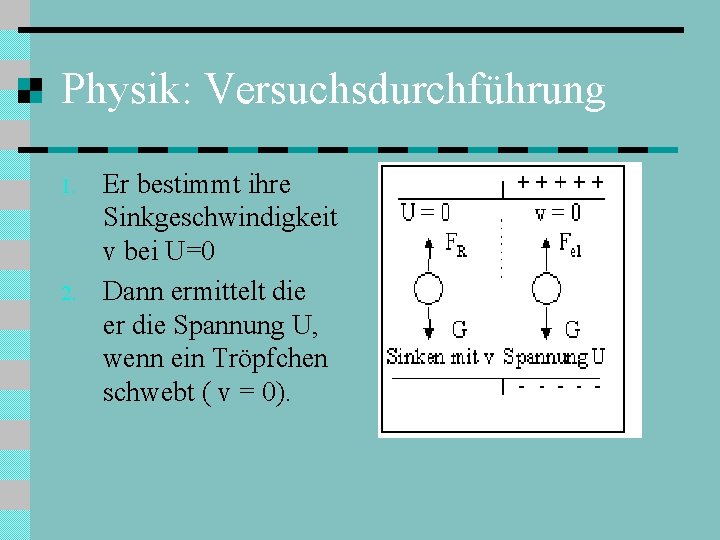
Physik: Versuchsdurchführung 1. 2. Er bestimmt ihre Sinkgeschwindigkeit v bei U=0 Dann ermittelt die er die Spannung U, wenn ein Tröpfchen schwebt ( v = 0).

Theorie zum Versuch: 1. ) Ein leichtes Teilchen erfährt in Luft eine Reibungskraft proportional zur Sinkgeschwindigkeit v (Stokessches Gesetz): (mit Eta: Zähigkeit der Luft; r: Radius). Somit sinkt ein Öltröpfchen mit konstanter Geschwindigkeit in Luft. 2. ) Idealisierung: Kugelförmige Öltröpfchen: 3. ) Mit der Dichte von Öl ergibt sich ein Zusammenhang zwischen Gewichtskraft und Radius:

Berechnung: 1. ) U = 0: Das Öltröpfchen sinkt gleichförmig mit v. Es gilt: FR = G Daraus lässt sich r und damit auch G bestimmen. 2. ) v = 0: Mit richtig eingeregelter Spannung U kommt das Tröpfchen zur Ruhe. Es gilt: Fel = G Damit lässt sich die Ladung des Öltröpfchens bestimmen.

Versuchsergebnis: Millikan erhielt als Ergebnis nur q = 1 e, 2 e, 3 e, 4 e. . . Die Ladung der Öltröpfchen ist stets ein Vielfaches der Elementarladung e. n => Es gibt also eine kleinste Ladung, die Elementarladung e n Jede Ladung ist gequantelt, d. h. n alle Ladungen sind Vielfache der Elementarladung e = 1, 602. 10 -19 C. n

Originalveröffentlichung:

Physik-Nobelpreis 1923 An Robert A. Millikan für die Bestimmung der Elementarladung e = 1, 602. 10 -19 C.

Ausblick: Teilchenphysik Mit der Entdeckung der Quarks, aus denen z. B. ein Proton aufgebaut ist, mit den Ladungen 1/3 e bzw. 2/3 e muss die Entdeckung Millikans leicht modifiziert werden.
- Slides: 16