Bab 1 Bab 2 Bab 3 Bab 4

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 LARUTAN ELEKTROLIT DAN REAKSI REDOKS Bab V 5 Larutan Elektrolit dan Reaksi Redoks
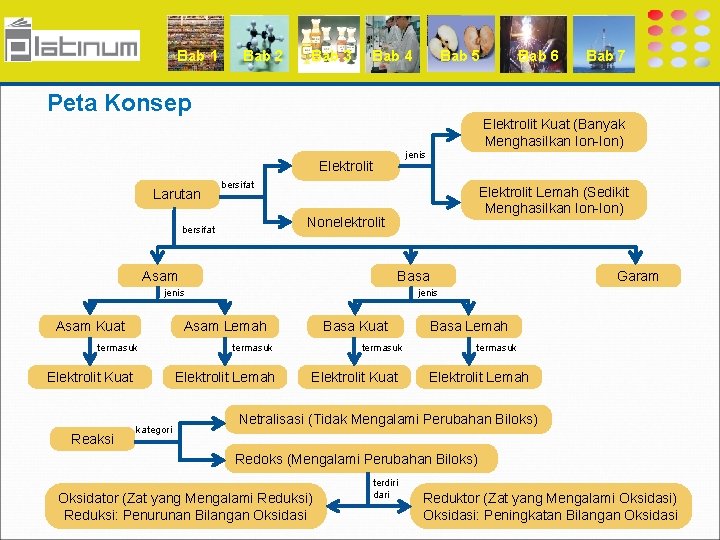
Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Peta Konsep jenis bersifat Elektrolit Lemah (Sedikit Menghasilkan Ion-Ion) Nonelektrolit bersifat Asam Basa jenis Asam Kuat Elektrolit Kuat Reaksi Basa Kuat termasuk Elektrolit Lemah kategori Garam jenis Asam Lemah termasuk Bab 7 Elektrolit Kuat (Banyak Menghasilkan Ion-Ion) Elektrolit Larutan Bab 6 termasuk Elektrolit Kuat Basa Lemah termasuk Elektrolit Lemah Netralisasi (Tidak Mengalami Perubahan Biloks) Redoks (Mengalami Perubahan Biloks) Oksidator (Zat yang Mengalami Reduksi) Reduksi: Penurunan Bilangan Oksidasi terdiri dari Reduktor (Zat yang Mengalami Oksidasi) Oksidasi: Peningkatan Bilangan Oksidasi

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 A. Larutan Elektrolit dan Nonelektrolit Ø Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Ø Larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Ø Untuk mengetahui suatu larutan bersifat elektrolit atau nonelektrolit, dapat diuji dengan alat penguji elektrolit. Alat penguji elektrolit

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 2. Elektrolit Kuat dan Lemah ü Elektrolit kuat adalah elektrolit yang dapat menguraikan semua zat terlarut (100%) menjadi ion-ionnya. ü Perbandingan antara zat yang terionisasi dengan zat mula-mula disebut sebagai derajat ionisasi yang diberi lambang . ü Elektrolit kuat mempunyai harga = 1. Contohnya larutan Na. Cl dan larutan HCl. ü Nonelektrolit = 0, contohnya larutan glukosa dan larutan urea. ü Harga elektrolit lemah mendekati 0, misalnya asam asetat (CH 3 COOH) dan amonium hidroksida (NH 4 OH).
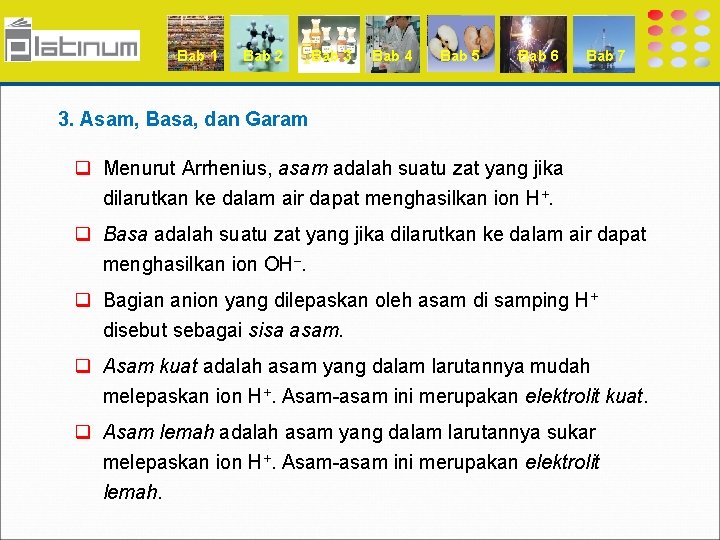
Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 3. Asam, Basa, dan Garam q Menurut Arrhenius, asam adalah suatu zat yang jika dilarutkan ke dalam air dapat menghasilkan ion H+. q Basa adalah suatu zat yang jika dilarutkan ke dalam air dapat menghasilkan ion OH–. q Bagian anion yang dilepaskan oleh asam di samping H+ disebut sebagai sisa asam. q Asam kuat adalah asam yang dalam larutannya mudah melepaskan ion H+. Asam-asam ini merupakan elektrolit kuat. q Asam lemah adalah asam yang dalam larutannya sukar melepaskan ion H+. Asam-asam ini merupakan elektrolit lemah.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 q Basa kuat adalah basa yang mudah melepaskan ion OH– dalam larutannya. Basa-basa ini merupakan elektrolit kuat. q Basa lemah adalah basa yang sukar melepaskan ion OH– dalam larutannya. Basa-basa ini merupakan elektrolit lemah. q Garam adalah persenyawaan yang terbentuk antara ion logam atau ion amonium (NH 4+) dengan sisa asam. q Larutan garam yang mudah larut dalam air juga merupakan elektrolit kuat.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 4. Reaksi Asam, Basa, dan Pembentukan Garam ü Reaksi-reaksi yang melibatkan asam, basa, dan garam dapat ditulis sebagai persamaan reaksi molekuler maupun reaksi ion. ü Reaksi antara ion H+dan ion OH– membentuk H 2 O disebut reaksi penetralan. ü Pada saat ion H+ tepat habis bereaksi dengan ion OH– disebut titik ekuivalen.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 a. Reaksi antara Logam dan Asam Reaksi antara besi (Fe) dengan larutan asam klorida. Reaksi molekuler: Fe(s) + 2 HCl(aq) → Fe. Cl 2(aq) + H 2(g) Reaksi ion: Fe(s) + 2 H+(aq) + 2 Cl–(aq) → Fe 2+(aq) + 2 Cl–(aq) + H 2(g) Fe(s) + 2 H+(aq) → Fe 2+(aq) + H 2(g) b. Reaksi antara Logam dan Garam (Reaksi Penggantian Logam oleh Logam Lain dari Suatu Garam) Reaksi antara logam Zn dengan larutan Cu. SO 4(aq). Reaksi molekuler: Zn(s) + Cu. SO 4(aq) → Cu(s) + Zn. SO 4(aq) Reaksi ion: Zn(s) + Cu 2+(aq) → Cu(s) + Zn 2+(aq)

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 c. Reaksi antara Oksida Asam dan Basa Reaksi antara gas SO 3 dengan larutan KOH. Reaksi molekuler: SO 3(g) + 2 KOH(aq) → K 2 SO 4(aq) + H 2 O(l) Reaksi ion: SO 3(g) + 2 OH–(aq) → SO 42–(aq) + H 2 O(l) d. Reaksi antara Oksida Basa dan Asam Reaksi antara Ca. O dan larutan HCl. Reaksi molekuler: Ca. O(s) + 2 HCl(aq) → Ca. Cl 2(aq) + H 2 O(l) Reaksi ion: Ca. O(s) + 2 H+(aq) → Ca 2+(aq) + H 2 O(l) Bab 7

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 e. Reaksi antara Oksida Basa dan Oksida Asam Oksida basa + oksida asam → garam Contoh, reaksi antara Ca. O dengan gas CO 2. Reaksi molekuler: Ca. O(s) + CO 2(g) → Ca. CO 3(s) Reaksi ion: tidak ada (sama dengan reaksi molekuler karena spesi-spesi yang terlibat dalam reaksi tidak terionisasi). f. Reaksi antara Logam dan Nonlogam Logam + nonlogam → garam Contoh, reaksi pembakaran magnesium oleh oksigen. Reaksi molekuler: 2 Mg(s) + O 2(g) → 2 Mg. O(s) Reaksi ion: tidak ada

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 g. Reaksi Pengendapan Reaksi pengendapan adalah reaksi yang menghasilkan endapan. Contoh, reaksi antara perak nitrat dan natrium kromat Reaksi molekuler: 2 Ag. NO 3(aq) + Na 2 Cr. O 4(aq) → Ag 2 Cr. O 4(s) + 2 Na. NO 3(aq) Reaksi ion: 2 Ag+(aq) + Cr. O 42–(aq) → Ag 2 Cr. O 4(s) h. Reaksi yang menghasilkan gas Contoh, reaksi antara natrium karbonat dan asam oksalat menghasilkan gas CO 2. Reaksi molekuler: Na. HCO 3(aq) + H 2 C 2 O 4(aq) → Na 2 C 2 O 4(aq) + H 2 O(l) + CO 2(g) Reaksi ion: CO 32–(aq) + 2 H+(aq) → H 2 O(l) + CO 2(g)

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 Contoh: Sebanyak 1, 12 liter gas karbon dioksida (0 o. C, 1 atm) dialirkan ke dalam larutan kalsium hidroksida jenuh. Berapa gram endapan kalsium karbonat yang dapat dihasilkan (Ar : Ca = 40, C = 12, O =16)? Jawab: Gas CO 2 yang ada = 1, 12 L = Ca(OH)2(aq) mula-mula : yang bereaksi : setelah reaksi : + CO 2(g) 0, 05 mol 0 mol = 0, 05 mol → Ca. CO 3(s) + H 2 O(l) 0 mol – 0, 05 mol Ca. CO 3 yang dihasilkan = 0, 05 mol = 0, 05 x Mr (Ca. CO 3) g = 0, 05 x 100 g = 5 g.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 B. Reaksi Oksidasi dan Reduksi 1. Perkembangan Konsep Reaksi Oksidasi Reduksi a. Konsep oksidasi reduksi ditinjau dari penggabungan dan pelepasan oksigen Oksidasi : reaksi antara suatu zat dan oksigen. Contoh: 2 Mg(s) + O 2 (g) → 2 Mg. O(s) Reduksi : reaksi pelepasan oksigen dari suatu zat. Contoh: Cu. O(s) + H 2 (g) → Cu(s) + H 2 O(g)

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 b. Konsep oksidasi reduksi ditinjau dari pelepasan dan penerimaan elektron Oksidasi : melepaskan elektron Reduksi : menerima elektron Contoh: 2 K(s) + Cl 2(g) → 2 K+Cl–(s) Satu atom K melepaskan 1 elektron. K → K+ + e– (oksidasi) Satu atom Cl menerima 1 elektron. Cl + e– → Cl– (reduksi)

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 c. Konsep oksidasi reduksi ditinjau dari perubahan bilangan oksidasi Oksidasi : peningkatan bilangan oksidasi Reduksi : pengurangan bilangan oksidasi Ø Bilangan oksidasi (biloks) : muatan yang dimiliki oleh suatu atom dalam suatu ikatannya dengan atom lain. Ø Biloks positif ditunjukkan oleh banyaknya elektron yang dilepas oleh satu atom unsur Ø Biloks negatif ditunjukkan oleh banyaknya elektron yang diterima oleh satu atom unsur. Ø Atom yang lebih kuat menarik elektron (elektronegativitasnya lebih besar) mempunyai bilangan oksidasi negatif. Ø Atom yang kurang kuat menarik elektron (elektronegativitasnya kecil) bilangan oksidasinya positif.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 Aturan penentuan biloks: 1. Biloks unsur bebas (unsur tidak membentuk senyawa dengan unsur lain, misalnya Mg, K, Fe, Cl 2, dan O 2 ) = 0. 2. Biloks ion sesuai dengan muatan ionnya (misalnya, biloks Cl– = – 1, SO 42– = – 2, PO 43– = – 3). 3. Jumlah biloks unsur-unsur dalam suatu molekul atau ion sama dengan muatan molekul (0) atau muatan ionnya. 4. Dalam senyawanya: a. Biloks O = – 2 (kecuali dalam F 2 O, biloks O = +2 dan dalam peroksida seperti H 2 O 2 dan Ba. O 2, biloks O = – 1). b. Biloks H = +1 (kecuali dalam hidrida seperti Na. H dan KH, biloks H = – 1). c. Unsur yang elektronegativitasnya lebih besar ditandai berbiloks negatif, sedangkan unsur yang elektronegativitasnya lebih kecil ditandai berbiloks positif.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 d. Biloks golongan alkali (golongan IA), Li, Na, K, Rb, dan Cs = +1. e. Biloks golongan alkali tanah (golongan IIA), Mg, Ca, Sr, dan Ba = +2. f. Senyawa biner (senyawa yang hanya terdiri atas dua unsur), biloks unsur-unsur golongan VIIA (F, Cl, Br, dan I) = – 1, dan golongan VIA (O dan S) = – 2. 5. Unsur nonlogam dapat memiliki beberapa biloks bergantung pada atom lain yang diikatnya. Contoh, belerang (S) dapat menerima dua elektron (misalnya, Na 2 S), tetapi mungkin juga belerang membentuk senyawa dengan unsur yang lebih elektronegatif sehingga pasangan elektronnya lebih tertarik ke arah unsur yang lain. Misalnya, dalam SO 2 biloks S = +4 dan dalam SO 3 biloks S = +6. Dengan demikian, biloks S = – 2, +4, dan +6.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 Contoh: Tentukan bilangan oksidasi masing-masing unsur dalam senyawa: A. Na 2 O; B. K 2 Cr 2 O 7. Jawab: A. Na 2 O biloks O = – 2 (aturan 4 a), biloks Na = +1 (aturan 4 d), (1 atom O) x (– 2) = – 2 (2 atom Na) x (+1) = +2 Jumlah biloks = 0 (aturan 3) B. K 2 Cr 2 O 7 biloks K = +1 (aturan 4 d), biloks O = – 2, biloks Cr = x, (2 atom K) x (+1) = +2 (7 atom O) x (– 2) = – 14 (2 atom Cr) x (x) = 2 x Jumlah biloks = 0 +2 – 14 + 2 x = 0 maka x = +6. Jadi, biloks Cr = +6.
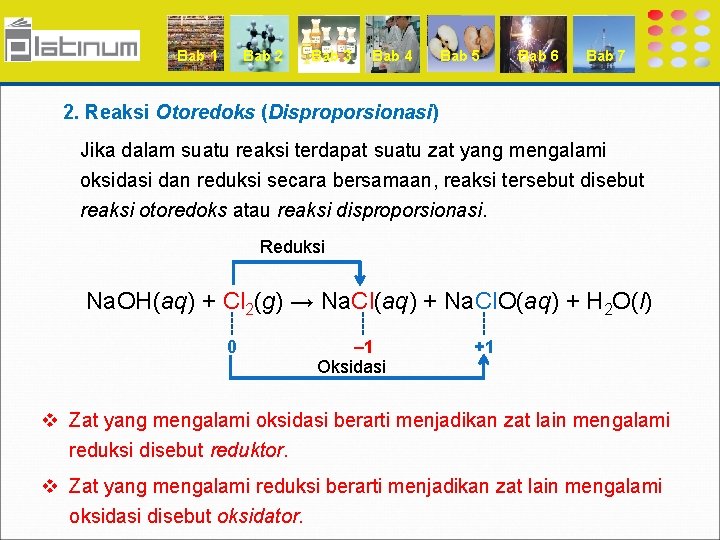
Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 2. Reaksi Otoredoks (Disproporsionasi) Jika dalam suatu reaksi terdapat suatu zat yang mengalami oksidasi dan reduksi secara bersamaan, reaksi tersebut disebut reaksi otoredoks atau reaksi disproporsionasi. Reduksi Na. OH(aq) + Cl 2(g) → Na. Cl(aq) + Na. Cl. O(aq) + H 2 O(l) 0 – 1 Oksidasi +1 v Zat yang mengalami oksidasi berarti menjadikan zat lain mengalami reduksi disebut reduktor. v Zat yang mengalami reduksi berarti menjadikan zat lain mengalami oksidasi disebut oksidator.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 3. Hubungan Reaksi Redoks dengan Tata Nama Senyawa Untuk unsur-unsur logam yang hanya mengalami satu jenis perubahan redoks, penamaannya langsung disebutkan nama logam diikuti nama sisa asam. Contoh: Na. Cl : Natrium klorida Ca. SO 4 : Kalsium sulfat Untuk unsur-unsur logam yang mengalami beberapa macam redoks, ada dua cara penamaannya. 1. Cara lama Disebutkan nama Latin logam dengan akhiran: -o untuk logam berbilangan oksidasi rendah -i untuk logam berbilangan oksidasi tinggi diikuti nama sisa asamnya.

Bab 1 Bab 2 Contoh: Fe. Cl 2 : fero klorida Fe. Cl 3 : feri klorida Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 Co. Cl 2 : kobalto klorida Co. Cl 3 : kobalti klorida 2. Cara baru disebut sistem Stock. Disebut nama logam diikuti tanpa jarak bilangan oksidasi unsur dengan angka Romawi dalam tanda kurung (angka Romawi), kemudian disebutkan nama sisa asamnya. Contoh: Fe. Cl 2 : besi(II) klorida Fe. Cl 3 : besi(III) klorida Co. Cl 2 : kobalt(II) klorida Co. Cl 3 : kobalt(III) klorida
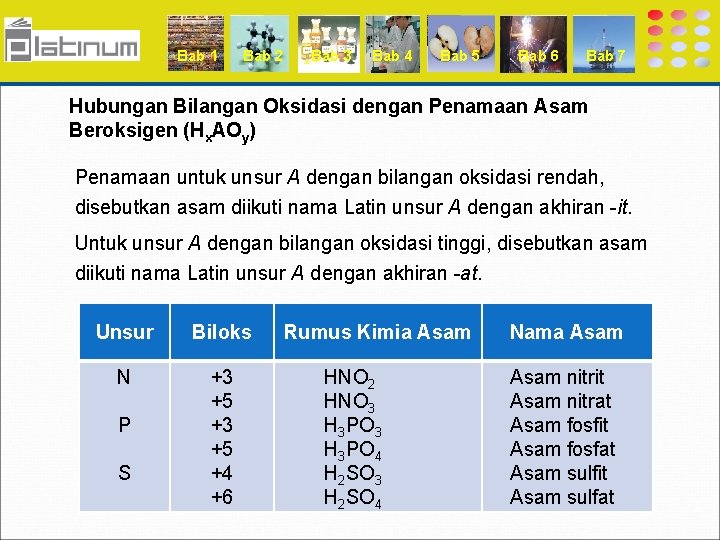
Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 Hubungan Bilangan Oksidasi dengan Penamaan Asam Beroksigen (Hx. AOy) Penamaan untuk unsur A dengan bilangan oksidasi rendah, disebutkan asam diikuti nama Latin unsur A dengan akhiran -it. Untuk unsur A dengan bilangan oksidasi tinggi, disebutkan asam diikuti nama Latin unsur A dengan akhiran -at. Unsur Biloks N +3 +5 +4 +6 P S Rumus Kimia Asam HNO 2 HNO 3 H 3 PO 4 H 2 SO 3 H 2 SO 4 Nama Asam nitrit Asam nitrat Asam fosfit Asam fosfat Asam sulfit Asam sulfat

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 C. Konsep Reaksi Redoks dalam Lingkungan 1. Peruraian Zat oleh Bakteri Ø Zat-zat yang ada di alam ini pada umumnya dapat diuraikan oleh bakteri aerob (perlu udara) maupun bakteri anaerob (tidak memerlukan udara). Ø Pada saat bakteri aerob bekerja >> terjadi reaksi oksidasi Ø Pada saat bakteri anaerob bekerja >> terjadi reaksi reduksi Ø Bakteri anaerob menghasilkan zat-zat yang berbau sekaligus gas metana (CH 4) yang dapat digunakan sebagai bahan bakar. Ø Bakteri anaerob untuk mereduksi senyawa-senyawa organik dimanfaatkan untuk pembuatan biogas.

Bab 1 Bab 2 Bab 3 Bab 4 Bab 5 Bab 6 Bab 7 2. Pembakaran Hidrokarbon Ø Pembakaran batu bara, bahan bakar minyak (BBM), dan kayu (hutan) juga merupakan reaksi redoks. Ø Pembakaran sempurna akan menghasilkan gas karbon dioksida (CO 2) dan air (H 2 O). Ø Pembakaran tidak sempurna akan menghasilkan gas karbon monoksida (CO). Ø Gas karbon monoksida bersifat racun dan merugikan bagi manusia karena mengganggu kerja hemoglobin. Oksidasi CH 4(g) + 2 O 2(g) → CO 2(g) + 2 H 2 O(g) Reduksi
- Slides: 24