B The development of Chemical Elements Periodical System

B. The development of Chemical Elements Periodical System B. Perkembangan Sistem Periodik Unsur Kimia

Teaching Learning Objectivers The student can explain Lavoisier elements classification. The student can explain Dobereiner elements classification. The student can explain Newlands elements classification. The student can explain formation Mendeleyev and Meyer able. The student can explain formation the modern periodic table. The student can explain correlation of electron configuration with period and group.

1. Lavoisier Elements Classification Pengelompokan unsur-unsur menjadi logam dan non logam. Antoine Laurent Lavoisier mencatat 16 unsur logam dan 7 bukan logam

2. Dobereiner Element Classification Dobereiner made groups of every three chemical elements with similar properties (triad) base on its atomic weight rising. The classification of chemical element according to Dobereiner is known as Dobereiner triad law
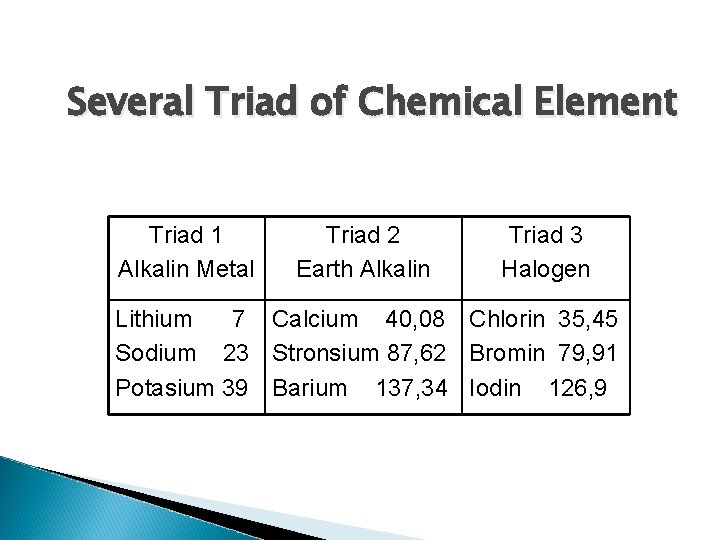
Several Triad of Chemical Element Triad 1 Alkalin Metal Triad 2 Earth Alkalin Triad 3 Halogen Lithium 7 Calcium 40, 08 Chlorin 35, 45 Sodium 23 Stronsium 87, 62 Bromin 79, 91 Potasium 39 Barium 137, 34 Iodin 126, 9

3. Newlands Element Classication (Octave Law) Newlands classified chemical elements based on its atomic weight rising. Element properties will be repeated after every eight elements (Octave Law), it means that the 8 th element will have similar properties with the 1 st element.
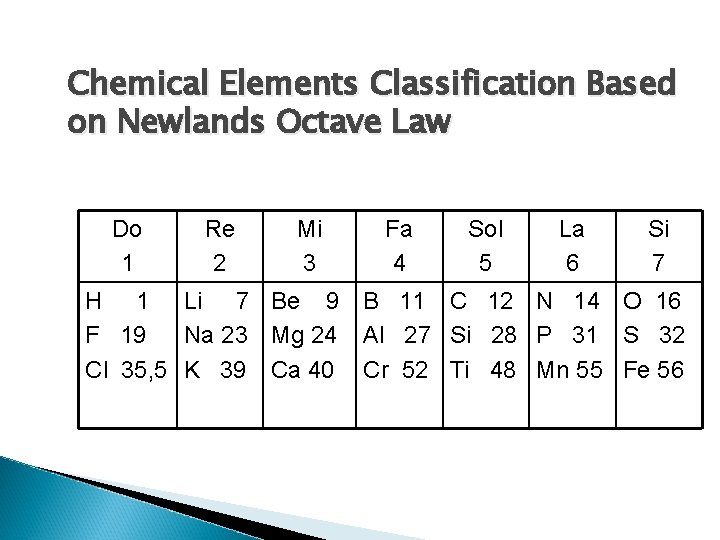
Chemical Elements Classification Based on Newlands Octave Law Do 1 Re 2 Mi 3 Fa 4 Sol 5 La 6 Si 7 H 1 Li 7 Be 9 B 11 C 12 N 14 O 16 F 19 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35, 5 K 39 Ca 40 Cr 52 Ti 48 Mn 55 Fe 56

4. Mendeleyev and Meyer Periodic Table Pada saat yang bersamaan di dua tempat yang berbeda tanpa kerja sama dan komunikasi dua orang ilmuwan, yaitu Julius Lothar Meyer (1869) dari jerman dan Dmitri Ivanoich Mendeleyev (1871) dari Rusia, melakukan penyusunan dan pengklasifikasian unsur-unsur berdasarkan kenaikan massa atomnya. Mereka menyimpulakan tentang adanya keperiodikan sifat-sifat unsur yang hampir sama

Lothar Meyer dalam pengkajiannya tentang fenomena keperiodikan unsur lebih condong pada sifat-sifat fisis unsur. Mendeleyev mengamati keperiodikan dalam sifat-sifat kimia unsur, baru dikenal 65 unsur dengan menggunakan sistem kartu yang masing-masing dilengkapi dengan sifat-sifat unsur, unsur-unsur yang sifatnya sama dikelompokkan ke dalam golongan-golongan unsur.
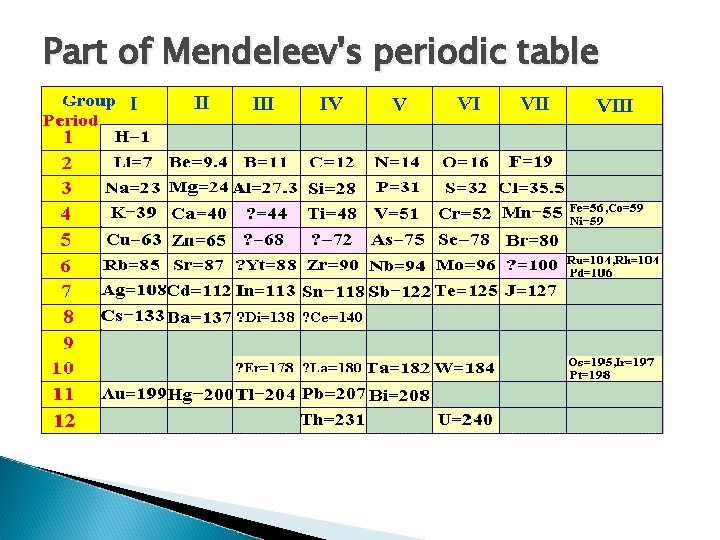
Part of Mendeleev's periodic table

Prediction of Germanium’s Properties Property Mendeleev’s Prediction Observed Properties Atomic Weight 72 72. 59 Density 5. 5 5. 35 Specific Heat 0. 305 0. 309 Melting point High 947 C Color Dark gray Grayish white Formula of oxide XO 2 Ge. O 2 Density of oxide 4. 70 Formula of Chloride XCl 4 Ge. Cl 4 Boiling point of chloride A little under 100 84 C

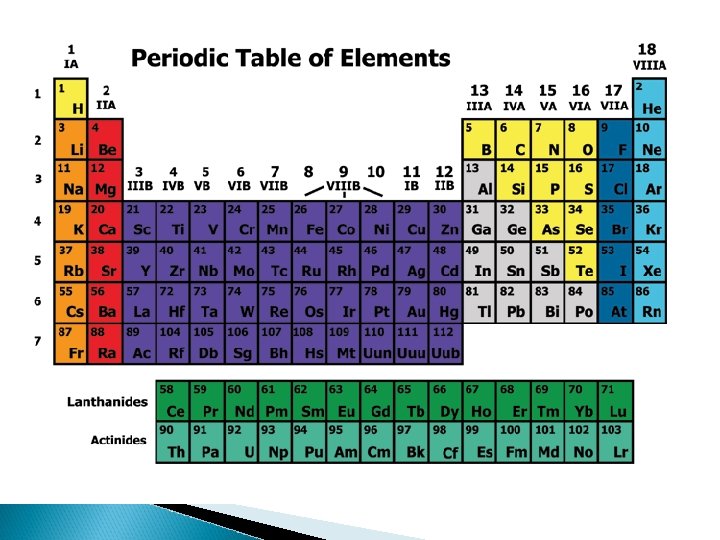
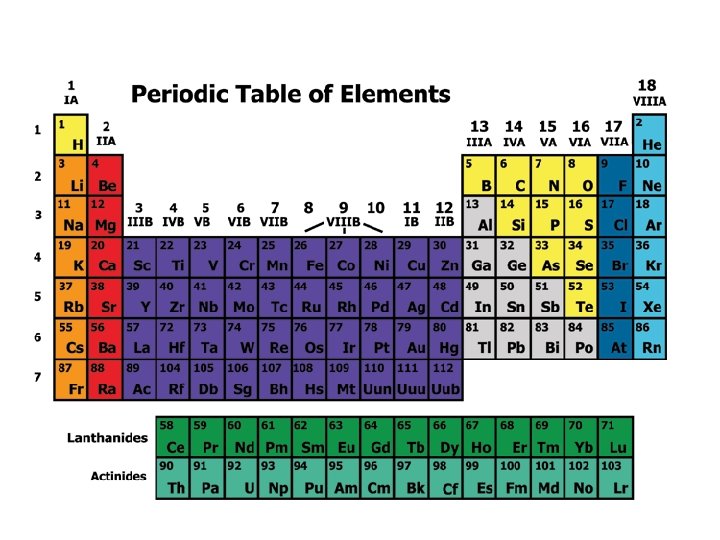
5. The Modern Periodic Table Merupakan penyempurnaan sistem periodik Mendeleyev Dikemukakan oleh Henry G Moseley Disusun menurut kenaikan nomor atom Terdiri dari lajur vertikal yang disebut golongan dan lajur horisontal disebut periode. Dalam satu golongan mempunyai elektron valensi yang sama dan memiliki sifat-sifat kimia dan fisika yang hampir mirip.
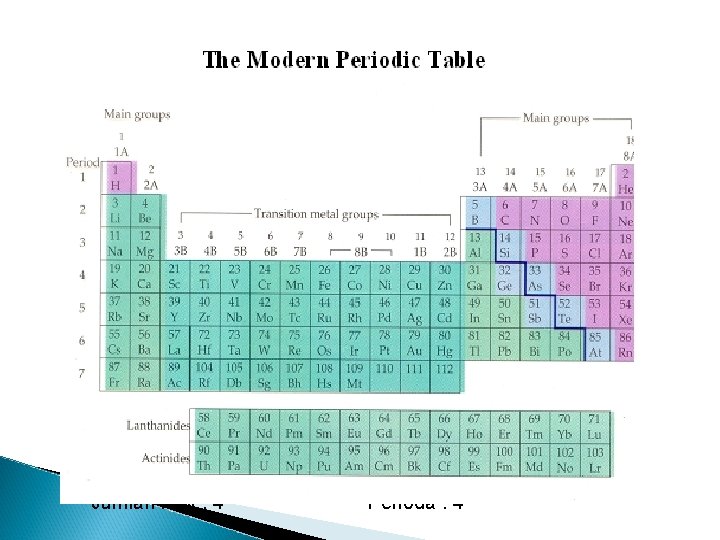
Correlation of Electron Configuration with Period and Group The electron Group number = valence configuration of atom electron can be used to Period number = number determine an atom of shell filled with position in periodic table. electron Example : 35 Br Konfigurasi elektronnya 2 18 8 7 Elektron valensinya : 7 Golongan VIIA Jumlah kulit : 4 Perioda : 4
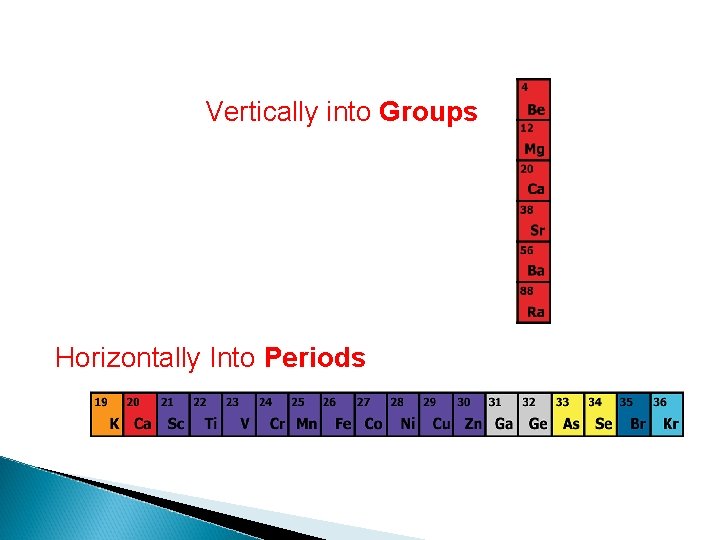
Vertically into Groups Horizontally Into Periods

Golongan adalah kolom vertikal dalam SPU terdiri atas: v Golongan utama (A): IA sampai dengan VIIIA Golongan Nama Golongan IA IIIA IVA Alkali Tanah Aluminium Karbon Golongan Nama. Golongan VA VIIA VIIIA Nitrogen Oksigen Halogen Gas Mulia
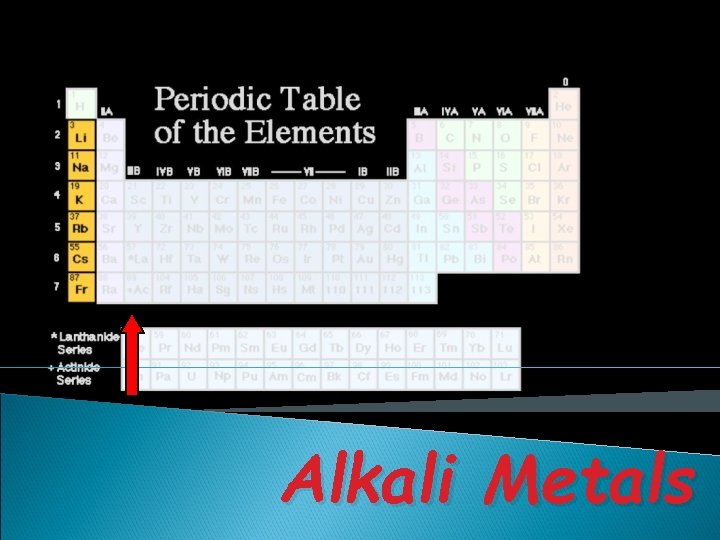
Alkali Metals

Alkaline Earth Metals

Halogens
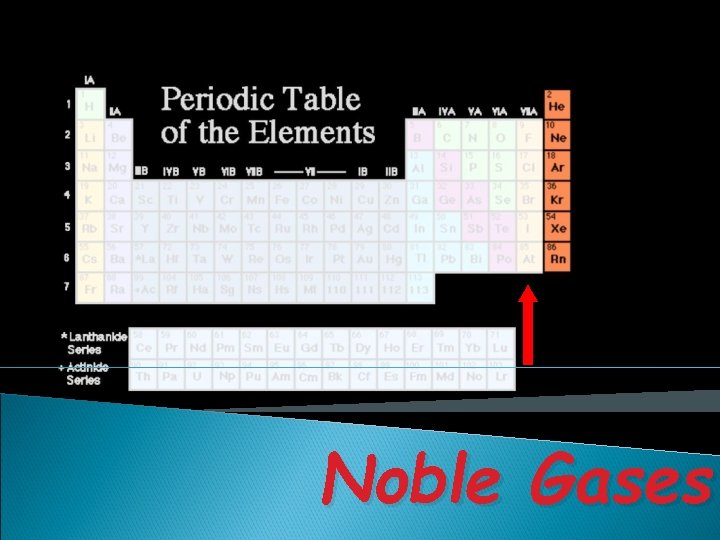
Noble Gases

v • Golongan transisi (B) : IB sampai dengan VIIIB. Semua unsur transisi adalah logam Terdapat deret lantanida dan deret aktinida Perioda adalah baris horisontal dalam SPU, ada 7 perioda, dalam satu perioda memiliki jumlah kulit yang sama
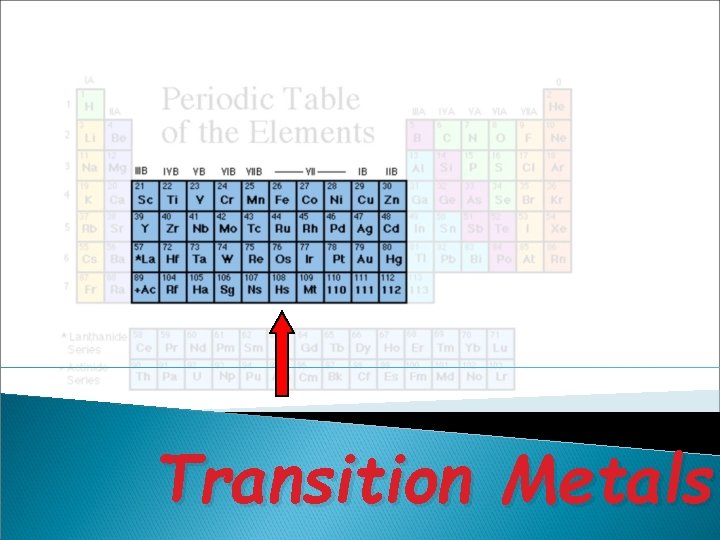
Transition Metals
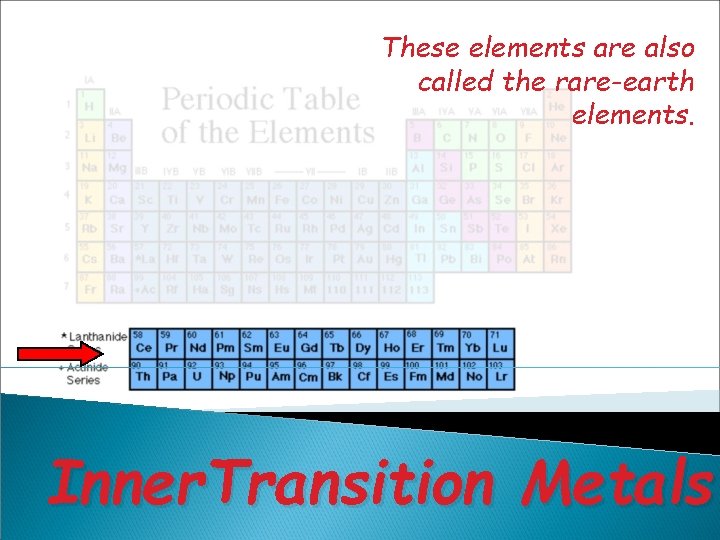
These elements are also called the rare-earth elements. Inner. Transition Metals

Correlation of Electron Configuration with Period and Group The electron configuration of atom can be used to determine an atom position in periodic table. Group number = valence electron Period number = number of shell filled with electron Example : 35 Br Konfigurasi elektronnya 2 18 8 7 Elektron valensinya : 7 Jumlah kulit : 4 Golongan VIIA Perioda : 4
- Slides: 25