B lectrons et tableau priodique Les lectrons sont

B. Électrons et tableau périodique Les électrons sont disposés sur des niveaux d’énergie numérotés de ______. Le niveau ayant la plus 1à 7 faible énergie est n=1 et est situé le plus _______ près du noyau. 2 (n) 2 Chaque niveau peut contenir un maximum de ______ électrons. 2 (1) 2 2 Le niveau 1 peut contenir ____= ___ électrons 2 (2) 2 = ___ 8 Le niveau 2 peut contenir ____ électrons 2 (3) 2 = ___ 18 électrons Le niveau 3 peut contenir ____ 2 (4) 2 = ___ 32 électrons Le niveau 4 peut contenir ____


En théorie, les niveaux 5, 6 et 7 pourraient contenir 2 2 (5) _____ = 50 électrons (mais 32 électrons seulement) _____ = 72 électrons 2 (6) 2 (mais 32 électrons seulement) _____ = 98 électrons 2 (7) 2 (mais 32 électrons seulement)

Mais selon les informations connues aujourd’hui, les niveaux 5, 6 et 7 contiennent aussi un maximum de ___ 32 électrons. Les niveaux d’énergie sont divisés en sous-niveaux s p f d’énergie identifiés par les lettres __, d_ et __. D’autres divisions énergétiques de ces sousniveaux existent. On les appelle _____. On orbitales 2 électrons peut avoir un maximum de _______ par orbitale. bas niveau doivent être remplies Les orbitales de _____ haut avant de remplir les orbitales de plus ______ s doit être rempli avant de commencer niveau. ( __ p __ d ou __) f à placer des électrons dans __,
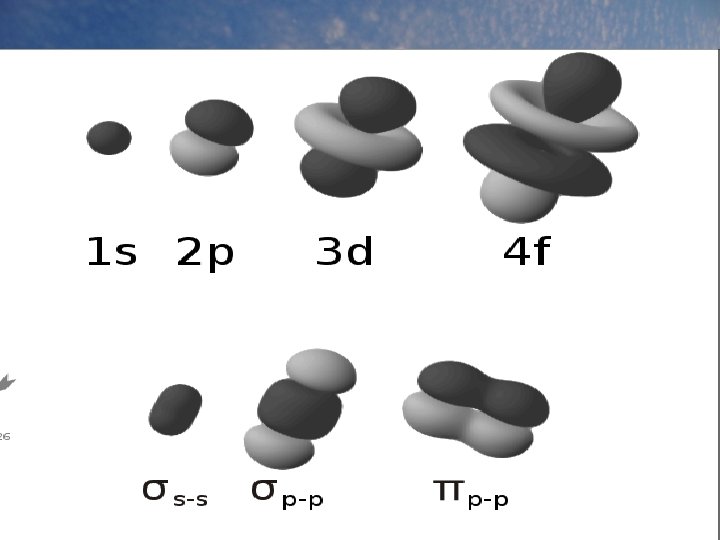



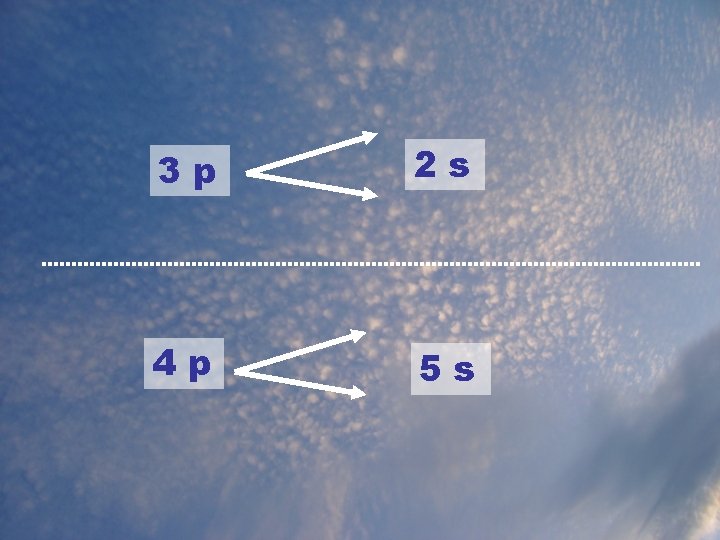
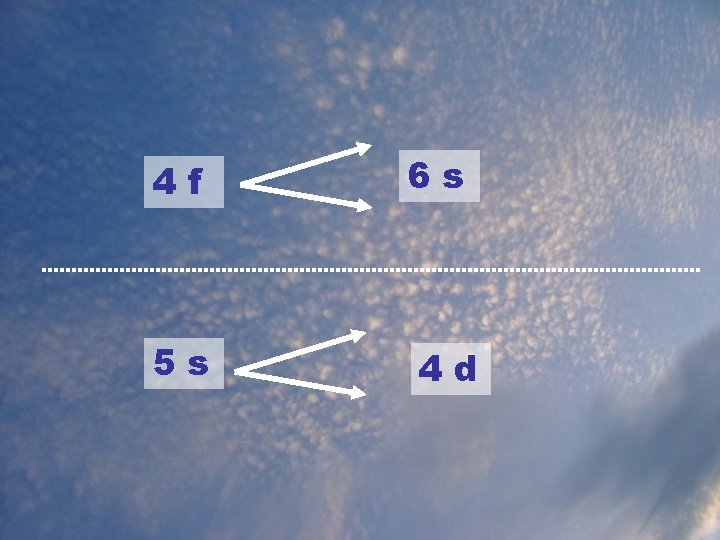
L’ordre de remplissage des orbitales Lorsqu’on a des électrons de bas niveau (ex : 3) et de haut sous-niveau (ex : d), il peut arriver qu’il soit plus énergétique qu’un 4 électron de niveau plus élevé (ex : ___) mais de sous-niveau plus bas (ex : ___). s Il existe une façon de déterminer l’ordre dans lequel les orbitales sont remplies (de l’énergie la plus basse à la plus haute)
3 p 2 s 4 p 5 s
4 f 5 s 6 s 4 d

1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 5 s 5 p 5 d 5 f 6 s 6 p 6 d 6 f 7 s 7 p 7 d 7 f

Indique l’ordre dans lequel les niveaux et sous-niveaux sont remplis : 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d 7 p

Indique l’ordre dans lequel les niveaux et sous-niveaux sont remplis : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 6

• Écrire la configuration électronique des éléments suivants : Néon 1 s 2 2 p 6 Sodium 1 s 2 2 p 6 3 s 1 Argent 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 29 Zirconium Hélium 1 s 2 Oxygène 1 s 2 2 p 4 Uranium Soufre 1 s 2 2 p 6 3 s 2 3 p 4

• Les orbitales « s » ont un maximum de ___ 2 électrons (___ 1 orbitale) • Les orbitales « p » ont un maximum de ___ 6 électrons (___ 3 orbitales) • Les orbitales « d » ont un maximum de ___ électrons (___ 10 5 orbitales) • Les orbitales « f » ont un maximum de 14 ___ électrons (___ 7 orbitales)

• Le nombre d’électrons dans un atome est égal au ___________. Les Numéro atomique orbitales doivent être remplies de façon à ce que la somme des électrons totalise __________. le nombre de protons ( #_______ = #________ protons électrons = #_________) atomique

On peut aussi identifier un élément d’après sa configuration électronique en _______________ comptant le nombre d’électrons dans chaque sous-niveau. électrons Cela donne le nombre d’ _____, donc le ________ numéro atomique qui permet d’identifier l’élément.

La configuration électronique s’exprime par une série d’éléments composés de 3 parties : Exprime le niveau d’énergie Exprime le nombre d’électrons 2 1 s Exprime le sous-niveau

Dans les sous-niveaux comportant plus d’une orbitale (p, d et f), les électrons éparpillent dans toutes les orbitales s’______ avant de ____ remplir à ____ deux (2) électrons la même orbitale.
- Slides: 19