AZ SMEZ ELEMEI S VEGYLETEIK Elektronszerkezetk ns 1



















- Slides: 25

AZ S-MEZŐ ELEMEI ÉS VEGYÜLETEIK Elektronszerkezetük ns 1 ns 2 Elektronegativitás 1, 0 -0, 7 1, 5 -0, 9 Ionizációs energia 520 -376 899 -509 (k. J/mol) 1757 -979 Sűrűség 0, 54 -1, 90 1, 85 -5, 5 Jellemző oxidációs áll. +1 +2 Olvadáspont 181 -27 1278 -700 Forráspont 1547 -677 2970 -1140 Standard el. potenciál -3, 03, -2, 71 -1, 85, -2, 92

AZ S-MEZŐ ELEMEI ÉS VEGYÜLETEIK Ion r+(pm) n(H 2 O) ΔHhidrat. k. J/mol Li 76 340 25 519 Na 102 276 17 406 K 138 232 11 322 Rb 152 228 ? 293 Cs 167 228 10 264 Be Mg Ca Sr Ba Ion r 2+(pm) ΔHhidr. k. J/mol 45 2494 72 1921 100 1577 118 1443 135 1305 A Li, illetve a Be és a Mg sajátságai kissé eltérnek a csoport többi tagjáétól: -kicsiny méret → nagy felületi töltéssűrűség → erős polarizálóképesség → kovalens kötési hajlam (pl. rendkívül erősen kötött hidrátburok). A Li és a Mg; illetve a Be és az Al hasonlósága: átlós rokonság (hasonló méret, illetve még hasonlóbb felületi töltés-sűrűség.

AZ ALKÁLIFÉMEK JELLEMZÉSE Elem Li Na K Rb Cs Fr H Cl r(atom) (pm) 152 186 227 248 265 >30 99 I 1 I 2 (k. J/mol) 520 7296 4563 419 3069 403 2640 376 2260 375 1310 1255 Op, °C Fp, °C ε, (V) EN 181 88 64 39 29 1347 881 766 688 705 -3, 02 -2, 71 -2, 92 -2, 99 -3, 02 1, 0 0, 9 0, 8 0, 7 -259 -101 -253 -35 0, 0 +1, 36 2, 1 3, 0 A fizikai és a kémiai tulajdonságok a csoportban lefelé túlnyomórészt monoton változnak.

AZ ALKÁLIFÉMEK JELLEMZÉSE Fizikai tulajdonságok: -Kis sűrűségűek, puhák, vághatóak, alacsony op. és fp. , jó hő –és elektromos vezetőképesség, nagy atom-és ionsugár; -Gőzeik egyatomosak; -Külső héjon levő elektronjuk könnyen gerjeszthető → jellemző színűre festik a lángot: Li – vörös Rb – sötétvörös Na – sárga Cs – kék K – fakóibolya (nem ugyanazon átmenetre vonatkoznak) -Más fémekkel ötvözhetők, higanynyal amalgámot képeznek; -Cseppfolyós ammóniában (amminokban) jól oldódnak

AZ ALKÁLIFÉMEK OLDÓDÁSA CSEPPF. NH 3 -BAN Oldható fémek: alkáli fémek és Ca, Sr, Ba, Eu, Yb Híg oldat M + (x+y)NH 3 = [M(NH 3)y]+ + e(NH 3)x. Kék színű, vezeti az elektromos áramot, paramágneses ↔ szolvatált elektron Töményebb oldat 2 e(NH 3)x- = e 2(NH 3)z 2 - + (2 x-z)NH 3 Narancssárga oldat, a szolvatált elektron párosodása → a paramágnesség csökken Tömény oldat 2 M(s) = [M(NH 3)y]+ + [Me 2(NH 3)z]A szolvatált kation stabilizálása alkidok: (Msolv+)(Msolv-) elektridek: (Msolv+)(esolv-) Amid-képződés: 2 Na + 2 NH 3 = 2 Na. NH 2 + H 2 Fény vagy átmenetifém-ionok (pl. Fe 3+) katalizálják.

AZ ALKÁLIFÉMEK KÉMIAI TULAJDONSÁGAI Igen reakcióképes elemek, a reakcióképesség a csoportban lefelé nő. Erős redukálószerek Reakció Megjegyzés M + H 2 O → MOH + H 2 Hidroxidjaik a legerősebb ismert bázisok Li + O 2 → Li 2 O Monoxid képződik Li esetében (és kismértékben Na-nál) Na + O 2 → Na 2 O 2 Peroxid képződik Na esetében (és kismértékben Li-nál) K + O 2 → KO 2 Szuperoxid képződik K, Rb, Cs esetében M + H 2 → MH Sószerű hidridek Li + N 2 → Li 3 N Nitridet csak a Li képez M + NH 3 → MNH 2 Mindegyikük képez amidokat M + X → M 3 X Mindegyikük képez foszfidokat/arzenideket/antimonidokat M + X → M 2 X Mindegyikük képez szulfidokat/szelenideket/telluridokat M + X → MX Mindegyikük képez halogenideket M + C → M 2 C 2 csak a Li és Na, a többi intersticiális karbidokat képez

AZ ALKÁLIFÉMEK ELŐFORDULÁSA, ELŐÁLLÍTÁSA Előfordulás: csak vegyületeikben, +1 oxidációs állapotban Na. Cl-kősó, Na. NO 3 -chilei salétrom, Na 2 SO 4∙ 10 H 2 O-glaubersó, Na 2 CO 3∙ 10 H 2 O-szóda, Na. HCO 3, Na 2[B 4 O 5(OH)4]∙ 8 H 2 O-bórax KCl-szilvin, KCl∙Mg. Cl 2∙ 6 H 2 O-karnallit K 2 CO 3 -hamuzsír, Szilikátok (tengervíz) Li, Rb, Cs, : ritka elemek Na, K: élővilágbeli előfordulásuk (a K szélesebb körben) Előállítás: Halogenidjeik olvadék-elektrolízise (grafit anód, acél katód) K, Rb, Cs: olvadék halogenidek redukciója Na-mal

AZ ALKÁLIFÉMEK FELHASZNÁLÁSA Redukálószer, víztelenítőszer, hűtőfolyadék (nukleáris reaktorokban), galvánelemek (Li-anód, polivinil-piridin-I 2 -katód, Li. I elektrolit), ötvözőanyag (14%Li, 1%Al, 85%Mg; repülőgépipar) Na 2 CO 3: üveggyártás alapanyaga, Li 2 CO 3, K 2 CO 3: porcelán- és üveggyártás adalékanyaga, Na. Cl: Na. OH gyártás alapanyaga, utak sózása (környezetvédelem!) Na. OCl, Na 2 O 2: fehérítés: textil- és papíripar KMn. O 4: fertőtlenítőszer, oxidálószer KO 2: kisegítő oxigénforrás Li-sztearát: kenőcsök adalékanyaga

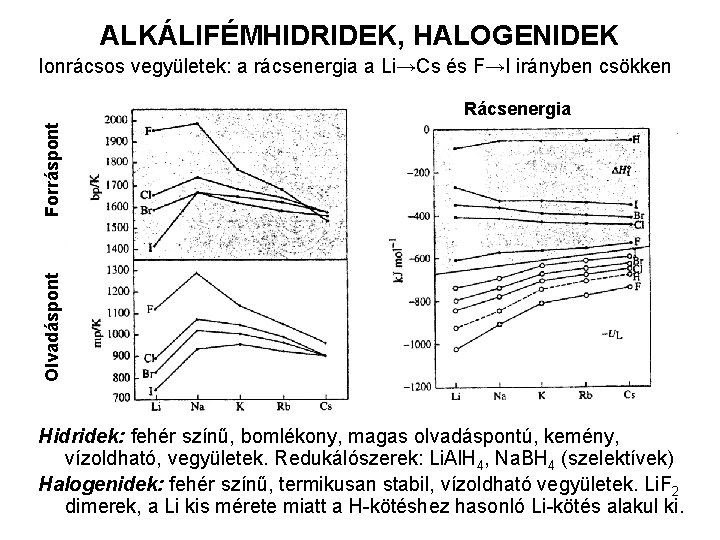
ALKÁLIFÉMHIDRIDEK, HALOGENIDEK Ionrácsos vegyületek: a rácsenergia a Li→Cs és F→I irányben csökken Olvadáspont Forráspont Rácsenergia Hidridek: fehér színű, bomlékony, magas olvadáspontú, kemény, vízoldható, vegyületek. Redukálószerek: Li. Al. H 4, Na. BH 4 (szelektívek) Halogenidek: fehér színű, termikusan stabil, vízoldható vegyületek. Li. F 2 dimerek, a Li kis mérete miatt a H-kötéshez hasonló Li-kötés alakul ki.

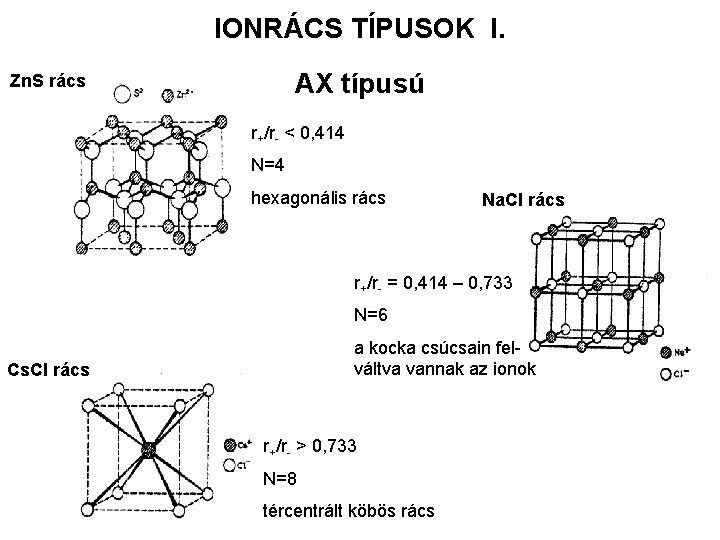
IONRÁCS TÍPUSOK I. AX típusú Zn. S rács r+/r- < 0, 414 N=4 hexagonális rács Na. Cl rács r+/r- = 0, 414 – 0, 733 N=6 a kocka csúcsain felváltva vannak az ionok Cs. Cl rács r+/r- > 0, 733 N=8 tércentrált köbös rács

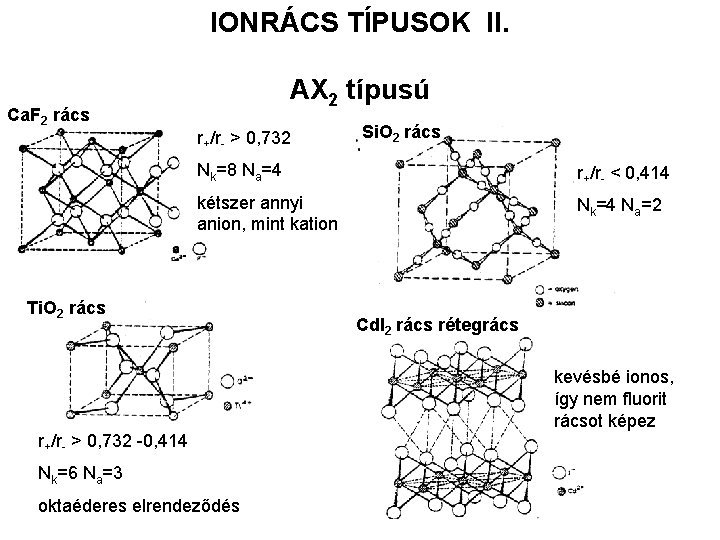
IONRÁCS TÍPUSOK II. Ca. F 2 rács AX 2 típusú r+/r- > 0, 732 Si. O 2 rács Nk=8 Na=4 r+/r- < 0, 414 kétszer annyi anion, mint kation Nk=4 Na=2 Ti. O 2 rács Cd. I 2 rács rétegrács kevésbé ionos, így nem fluorit rácsot képez r+/r- > 0, 732 -0, 414 Nk=6 Na=3 oktaéderes elrendeződés

ALKÁLIFÉM VEGYÜLETEK Oxidok, hidroxidok M 2 O, M 2 O 2, MO 2 és MO 3 összetételűek, oxigénnel reagálva: Li 2 O, Na 2 O 2, KO 2, szuboxidok (Cs, Rb) a fém oxidációs állapota 1 alatt van (fém-fém kötés: pl. Cs 7 O (bronz), Cs 4 O 2 (ibolyásvörös), Cs 11 O 3 (ibolya) Vízzel bázisokat képeznek: Li 2 O + H 2 O = 2 Li. OH Na 2 O 2 + 2 H 2 O = 2 Na. OH + H 2 O 2 2 KO 2 + 2 H 2 O = 2 KOH +H 2 O 2 + O 2 Na. OH előállítása: Na. Cl oldat elektrolízise: (1) Pt (vagy grafit) elektródos, (2) Hg katódos (környezetszennyezés), (3) membráncellás eljárások

ALKÁLIFÉM VEGYÜLETEK Szulfidok, poliszulfidok M 2 S, illetve M 2 Sn (n=2, 3, 4, 5, 6) összetételűek, Li/S, Na/S akkumulátorok Oxosavak sói Karbonátok, hidrogénkarbonátok (karbonát dimer) Solvay féle szódagyártás: Na. Cl, + H 2 O + CO 2 + NH 3 = Na. HCO 3 + NH 4 Cl Na. HCO 3 = Na 2 CO 3 + H 2 O + CO 2 (hevítés) üvegipar, füstgázok kénmentesítése nitrátok, nitritek: robbanószeripar foszfátok: trisó (vízlágyítás) Na. OCl (hipó) Na. OH oldatba Cl 2 gázt vezetnek Na 2 S 2 O 3 (fixirsó) fényképezés

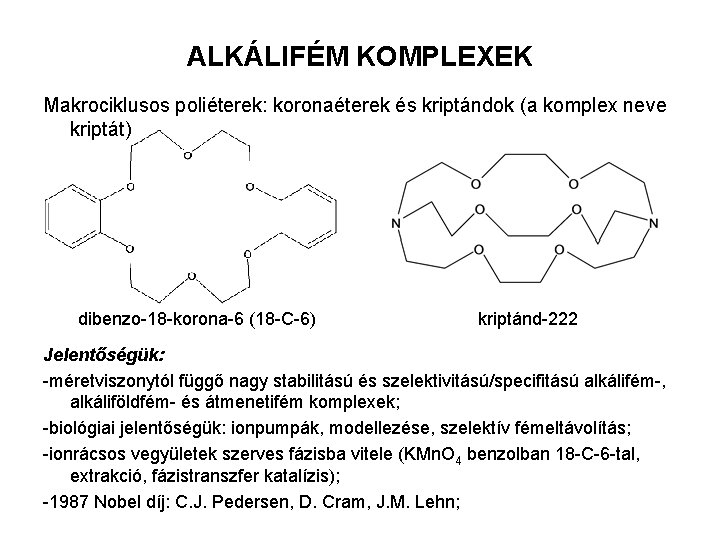
ALKÁLIFÉM KOMPLEXEK Makrociklusos poliéterek: koronaéterek és kriptándok (a komplex neve kriptát) dibenzo-18 -korona-6 (18 -C-6) kriptánd-222 Jelentőségük: -méretviszonytól függő nagy stabilitású és szelektivitású/specifitású alkálifém-, alkáliföldfém- és átmenetifém komplexek; -biológiai jelentőségük: ionpumpák, modellezése, szelektív fémeltávolítás; -ionrácsos vegyületek szerves fázisba vitele (KMn. O 4 benzolban 18 -C-6 -tal, extrakció, fázistranszfer katalízis); -1987 Nobel díj: C. J. Pedersen, D. Cram, J. M. Lehn;

SPECIÁLIS ALKÁLIFÉM VEGYÜLETEK Fémorganikus vegyületek Elsősorban a Li képez ilyen vegyületeket (kis ionméret, kovalens kötés képzési hajlam) R-X + 2 Li →R-Li + Li. Cl (éterben) termikusan és hidrolitikusan instabilis vegyületek; szerves szintézisekben lehetnek fontosak, pl. : (A vitamin gyártásban) Li. Ar + CO 2 → Ar. CO 2 Li → Ar. COOH + Li. OH 4 Li. Bu + CH 3 -C≡CH →Li 3 C-C≡CLi + 4 Bu. H (→ A vitamin) Vízben rosszul oldódó alkálifém vegyületek Li: Li 3 PO 4, Li 2 CO 3, Li. F; Na: Na[Sb(OH)6], Na. Zn(UO 2)3(CH 3 COO)9∙ 6, 5 H 2 O; K: KCl. O 4, KH-tartarát, K 2[Pt. Cl 6], K 3[Co(NO 2)6], K[B(C 6 H 5)4)]; Rb, Cs: M+[(CN)B(C 6 H 5)3];

AZ ALKÁLIFÖLDFÉMEK JELLEMZÉSE Elem Be Mg Ca Sr Ba Ra r(atom) r(ion) I 1 I 2 (pm) (k. J/mol) 112 45 899 1757 160 72 738 1451 197 100 590 1145 215 118 550 1064 222 135 503 965 148 509 979 Op, °C Fp, °C ε, (V) 1289 650 842 769 729 700 2472 1090 1494 1382 1805 1700 -197 -2, 36 -2, 84 -2, 89 -2, 92 EN 1, 5 1, 2 1, 0 0, 9 Kis ionizációs energiájuk és elektronegativitásuk révén a +2 oxidációs állapot elérésére törekednek →az ionméret kicsi→ nagy felületi töltéssűrűség; Be, Mg: kiugróan kicsiny ionméret, nagy polarizálóképesség → kovalens molekulák; Ca-Ra: inkább ionos vegyületeket képeznek.

AZ ALKÁLIFÖLDFÉMEK JELLEMZÉSE Fizikai tulajdonságok: -Az alkálifémekhez képest szorosabb illeszkedésű fémes rács és több delokalizált elektron → nagyobb sűrűségűek, keményebbek, magasabb op. és fp. , jó hő –és elektromos vezetőképesség, -Gőzeik egyatomosak; -Külső héjon levő elektronjuk könnyen gerjeszthető → jellemző színűre festik a lángot: Be, Mg – Sr – bíborvörös Ca – téglavörös Ba – fakózöld -Cseppfolyós ammóniában (amminokban) jól oldódnak; az NH 3 elpárolgásával hexammin komplex marad vissza, ezek lassan amiddá alakulnak: M(NH 3)6 →M(NH 2)2 + 4 NH 3 + H 2 Vö. az alkálifémek esetén a fém marad vissza.

AZ ALKÁLIFÖLDFÉMEK KÉMIAI TULAJDONSÁGAI A reakcióképesség a csoportban lefelé nő. A Be és a Mg felületét összefüggő oxidréteg védi. Reakció Megjegyzés M + 2 HCl → MCl 2 + H 2 mindegyikük H 2 fejlődésével oldódik savakban M + 2 H 2 O → M(OH)2 + H 2 Be vízgőzzel, Mg forró vízzel, a többi hideg vízzel Be + Na. OH→ Na 2[Be(OH)4] + H 2 a Be amfoter 2 M + O 2 → 2 MO szabályos oxidoat képeznek Ba + O 2 → Ba. O 2 peroxid képződik Ba esetében O 2 feleslegben M + H 2 → MH 2 Sószerű hidrideket képeznek magas T-n (Ca, Sr, Ba) 3 M + N 2 → M 3 N 2 Nitrideket képeznek magas hőmérsékleten 3 M + 2 NH 3 → 2 M(NH 2)2 Mindegyikük képez amidokat 3 M + 2 P → M 3 P 2 Mindegyikük képez foszfidokat M + X → MX Mindegyikük képez szulfidokat/szelenideket/telluridokat M + X 2 → MX 2 Mindegyikük képez halogenideket Oxidjaik képződéshője nagy; égésükkel nagy lánghőmérséklet érhető el (Mg égése levegőn és CO 2 -ban); Mg+KCl. O 3: villanópor

AZ ALKÁLIFÖLDFÉMEK ELŐFORDULÁSA ÉS ELŐÁLLÍTÁSA Előfordulás: csak vegyületeikben, +2 oxidációs állapotban, a földkéreg leggyakoribb elemei közé tartoznak Be. O∙Al 2 O 3 -krizoberill, Be 3 Al 2 Si 6 O 12 -berill, (Cr 2 O 3 szennyezés: smaragd) Mg. CO 3 -magnezit, Ca. CO 3 -mészkö, Ca. Mg(CO 3)2 -dolomit Ca. SO 4∙ 2 H 2 O-gipsz, Ca 3(PO 4)2 -foszforit, apatit; szilikátok; Sr a Ca kísérője, Sr. SO 4 – celesztit, Ba. CO 3 -witherit, Ba. SO 4 -barit Ra: csak radioaktív izotópjai vannak (226 Ra(α), t½=1600 év Li, Rb, Cs, : ritka elemek Mg, Ca: élővilágbeli előfordulásuk (a Mg szélesebb körben) Előállítás: Halogenidjeik olvadék-elektrolízise (grafit anód, acél katód) Be. O, Be. F 2 redukciója Mg-mal

AZ ALKÁLIFÖLDFÉMEK ELŐÁLLÍTÁSA ÉS FELHASZNÁLÁSA Előállítás Mg, Ca vegyületek redukciója Si. mal vagy Al-mal; szilikotermiás eljárás: 1. hevítés: Ca. CO 3, Mg. CO 3 → Ca. O, Mg. O 2. +Fe. Si: Ca. O, Mg. O + Fe. Si →Mg + Ca 2 Si. O 4 + Fe Sr, Ba vegyületek redukciója Al-mal Felhasználás Be: szerkezeti anyag (könnyű, kemény, ellenálló); ötvözetei: Al, Ti, V, Cu (repülőgépipar, rakétatechnika, csapágygyártás, szerszámgépek); Mg-Al ötvözetek: reülőgépipar Ca-Al ötvözetek (keményíti a fémet) Ca, Mg: redukálószer Sr vegyületek: képcsövek üvege, pirotechnika

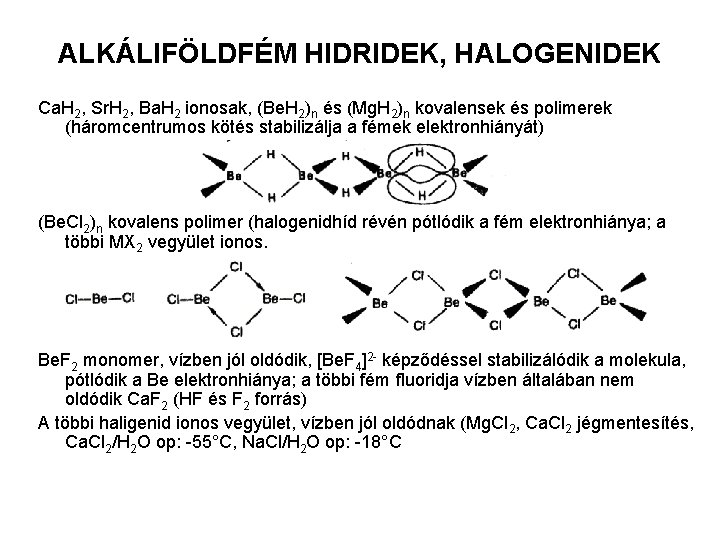
ALKÁLIFÖLDFÉM HIDRIDEK, HALOGENIDEK Ca. H 2, Sr. H 2, Ba. H 2 ionosak, (Be. H 2)n és (Mg. H 2)n kovalensek és polimerek (háromcentrumos kötés stabilizálja a fémek elektronhiányát) (Be. Cl 2)n kovalens polimer (halogenidhíd révén pótlódik a fém elektronhiánya; a többi MX 2 vegyület ionos. Be. F 2 monomer, vízben jól oldódik, [Be. F 4]2 - képződéssel stabilizálódik a molekula, pótlódik a Be elektronhiánya; a többi fém fluoridja vízben általában nem oldódik Ca. F 2 (HF és F 2 forrás) A többi haligenid ionos vegyület, vízben jól oldódnak (Mg. Cl 2, Ca. Cl 2 jégmentesítés, Ca. Cl 2/H 2 O op: -55°C, Na. Cl/H 2 O op: -18°C

ALKÁLIFÖLDFÉM VEGYÜLETEK Oxidok, hidroxidok MO → M(OH)2 bázisképző oxidok, báziserősség és oldhatóság a csoportban lefelé nő. Be(OH)2 +2 OH- = [Be(OH)4]2 - hasonlóság az Al- és Zn-hez) MO oxidjaik ionosak, legfontosabb a Ca. O (égetett mész) Ca. CO 3 (900 °C) → Ca. O (H 2 O) → Ca(OH)2 (oltott mész) habarcs: Ca(OH)2 + Si. O 2 (homok) kötése során CO 2 -ot vesz fel →Ca. CO 3 + Ca. Si. O 3 MO 2 peroxidok (stabilitásuk a kation méretével nő) (pl. Ba. O 2) 2 Ba. O + O 2 ↔ 2 Ba. O 2 (H 2 O 2 előállítása) Összetett sóik nitrátok: vízoldhatóak valamennyi fémnél karbonátok, szulfátok vízoldhatósága a csoportban lefelé csökken hidrogénkarbonátok (Ca, Mg): változó keménység, cseppkőképződés, vízkőlerakódás gipsz: 150 °C 200 °C 1100°C Ca. SO 4∙ 2 H 2 O——→Ca. SO 4∙ 1/2 H 2 O ——→ Ca. SO 4 ——→ Ca. O + SO 3 foszfátok: foszforit, apatitok (lásd foszfor kémiája)

ALKÁLIFÖLDFÉM KOMPLEXEK ÉS FÉMORGANIKUS VEGYÜLETEK Komplexek Kiemelkedő fontosságúak a koronaéterekkel, kriptándokkal (méretspecificitás), illetve a Be és a Mg tetrapirrol vázú vegyületekkel képezett komplexei Fémorganikus vegyületek A Be és a Mg sok ilyen vegyületet képez, de néhány Ca, Sr és Ba vegyület is ismert Grignard reagens (1901 Lyon, 1912 Nobel díj) Mg + RX ——→ R-Mg-X (R = alkil vagy aril) (X = Br-, I- esetleg Cl-) apoláris oldószerben (pl éterben); poláris oldószerekben elhidrolizálnak: 2 RMg. X + 2 H 2 O = RH + Mg(OH)2 „ Mg. X 2 Felhasználása: szerves szintézisekben: oxo vegyületek, amidok, alkánok előállítása

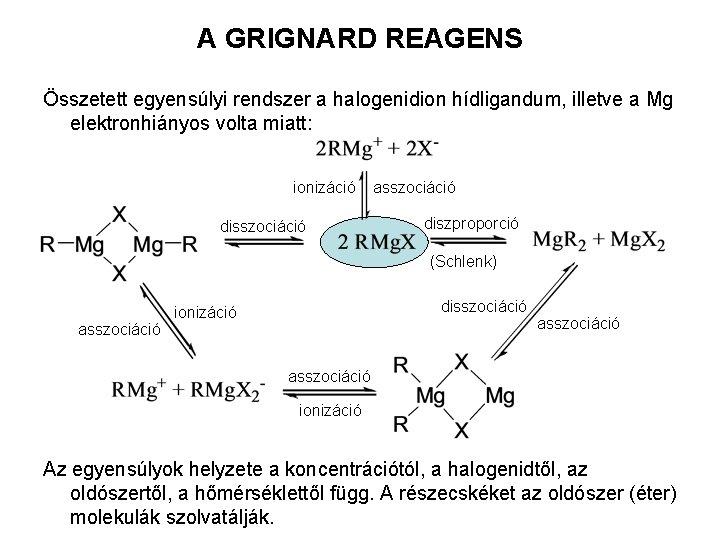
A GRIGNARD REAGENS Összetett egyensúlyi rendszer a halogenidion hídligandum, illetve a Mg elektronhiányos volta miatt: ionizáció disszociáció asszociáció diszproporció (Schlenk) asszociáció disszociáció ionizáció asszociáció ionizáció Az egyensúlyok helyzete a koncentrációtól, a halogenidtől, az oldószertől, a hőmérséklettől függ. A részecskéket az oldószer (éter) molekulák szolvatálják.

BIOLÓGIAI JELENTŐSÉGÜK Biológiai fontosságuak: Na, K, Mg, Ca, Li. CO 3: mániás depresszióban gyógyszer Be- mérgező (Mg helyettesítés), 90 Sr- radioaktív, Ba- idegméreg (de Ba. SO 4 röntgen kontrasztanyag) Biológiai hatásuk egyenetlen eloszlás sejten belül: K+, Mg 2+ sejten kívül: Na+, Ca 2+ ionpumpák révén valósul meg (szelektív kötőhelyű fehérjék) sav-bázis egyensúly, ozmótikus egyensúly fenntartása (K+, Na+) fiziológiai folyamatok szabályzása (pl. Ca 2+ izomösszehúzódásban) enzimek aktiválása (Mg 2+), foszfatázok, ATPáz, klorofill alkotórésze (Mg 2+), fotoszintézis vázanyag (csont, fog) 3 Ca 3(PO 4)2∙Ca. F 2; (tojáshéj) Ca. CO 3, kőképződés pl. Ca(COO)2
 A metafora származékai
A metafora származékai Belső kontrollrendszer elemei
Belső kontrollrendszer elemei Adótényállás elemei
Adótényállás elemei Porter féle értéklánc
Porter féle értéklánc Egy reflexív elemei
Egy reflexív elemei Definicik
Definicik önéletrajz tartalmi elemei
önéletrajz tartalmi elemei Myeloblast
Myeloblast Adótényállás elemei
Adótényállás elemei értéklánc elemei
értéklánc elemei Játszma szerkezeti elemei
Játszma szerkezeti elemei Belső kontrollrendszer elemei
Belső kontrollrendszer elemei Alhéjak
Alhéjak Adójogalkotás
Adójogalkotás értéklánc modell
értéklánc modell Piacpotenciál
Piacpotenciál A szóképek stiláris szerepe
A szóképek stiláris szerepe Kommunikációs folyamat elemei
Kommunikációs folyamat elemei Adótényállás elemei
Adótényállás elemei