Aula de enzimologia Tema Extrao de protenas e














- Slides: 26

Aula de enzimologia Tema Extração de proteínas e identificação de enzimas em géis de eletroforese Prof. Adriane M. F. Milagres Departamento de Biotecnologia - Escola de Engenharia de Lorena Universidade de São Paulo – USP adriane@debiq. eel. usp. br

ELETROFORESE A eletroforese consiste na migração de moléculas ionizadas de acordo com suas cargas elétricas e massa molar, submetidas a um campo elétrico Proteínas e ácidos nucleicos Tampões apropriados Mobilidade é função : tamanho, porosidade do gel, diferença entre o p. H do meio e o p. I da proteína F – Vq/d (v- voltagem, q-carga líquida, d-distancia entre os eletrodos f – 6πrnv (r – raio, n – viscosidade, v – velocidade de migração) • F= f v= Vq/ 6πrnd • V=Ri (V= voltagem; R= resistência; i – amperagem) f F ●

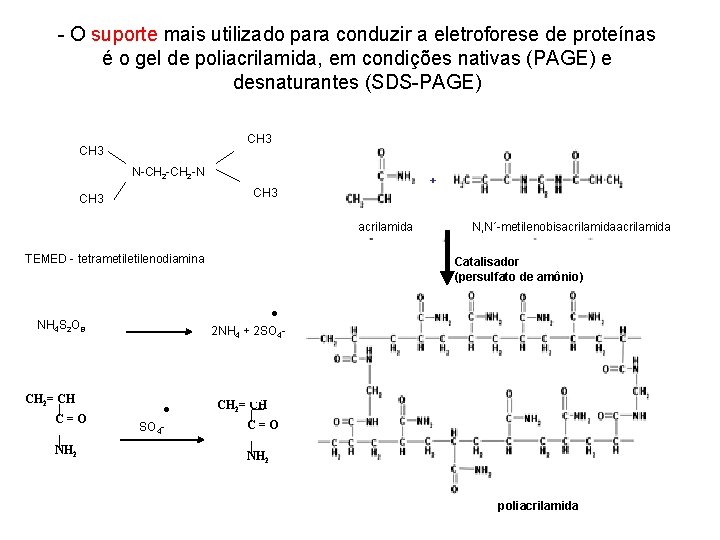
- O suporte mais utilizado para conduzir a eletroforese de proteínas é o gel de poliacrilamida, em condições nativas (PAGE) e desnaturantes (SDS-PAGE) CH 3 N-CH 2 -N + CH 3 acrilamida TEMED - tetrametilenodiamina | NH 2 Catalisador (persulfato de amônio) ● 2 NH 4 + 2 SO 4 - NH 4 S 2 O 8 CH 2= CH | C=O N, N´-metilenobisacrilamida ● SO 4 - CH 2= CH | C=O | NH 2 poliacrilamida

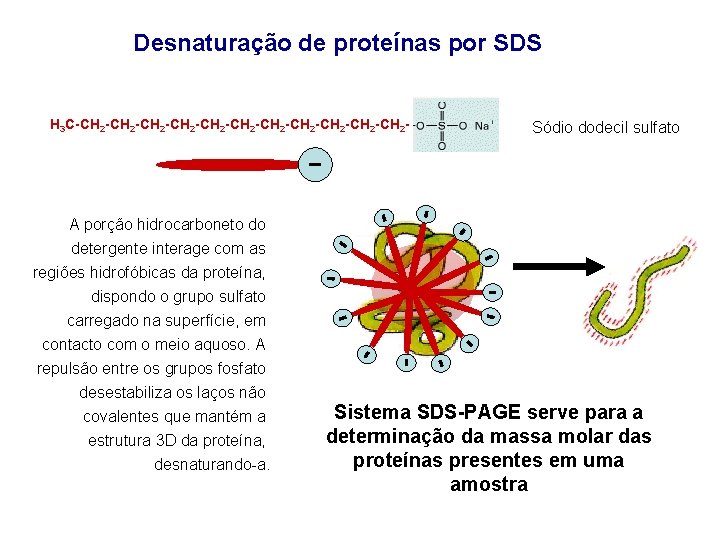
Desnaturação de proteínas por SDS H 3 C-CH 2 -CH 2 -CH 2 -CH 2 - Sódio dodecil sulfato A porção hidrocarboneto do detergente interage com as regiões hidrofóbicas da proteína, dispondo o grupo sulfato carregado na superfície, em contacto com o meio aquoso. A repulsão entre os grupos fosfato desestabiliza os laços não covalentes que mantém a estrutura 3 D da proteína, desnaturando-a. Sistema SDS-PAGE serve para a determinação da massa molar das proteínas presentes em uma amostra

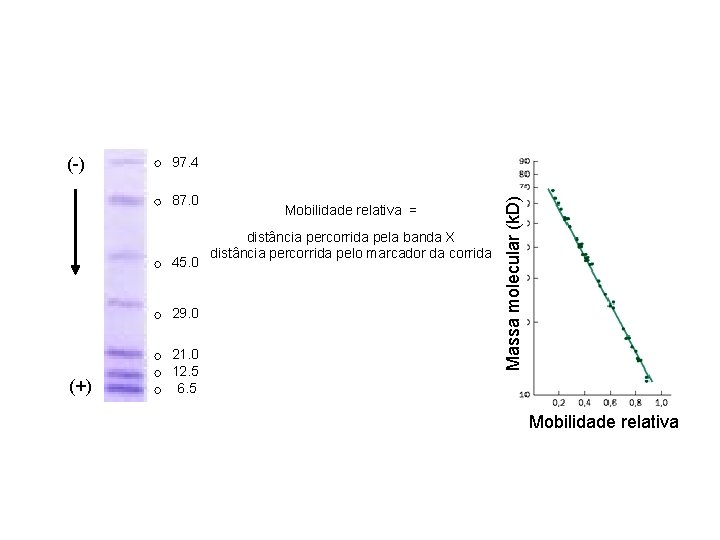
97. 4 87. 0 45. 0 29. 0 (+) 21. 0 12. 5 6. 5 Mobilidade relativa = distância percorrida pela banda X distância percorrida pelo marcador da corrida Massa molecular (k. D) (-) Mobilidade relativa

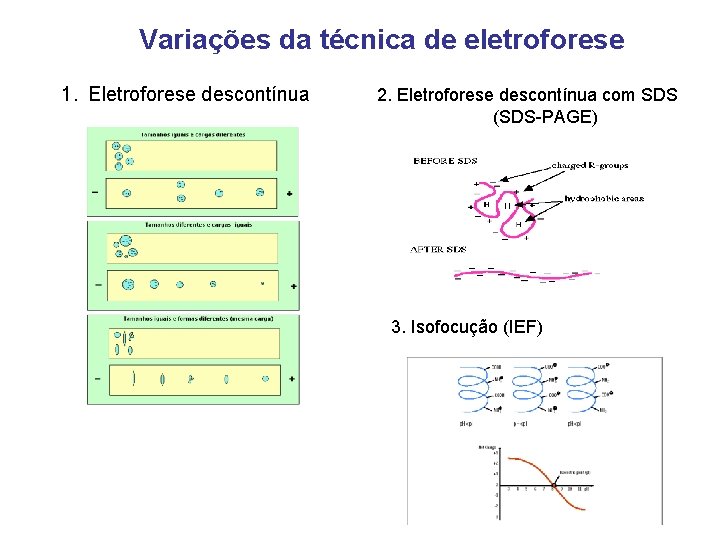
Variações da técnica de eletroforese 1. Eletroforese descontínua 2. Eletroforese descontínua com SDS (SDS-PAGE) 3. Isofocução (IEF)

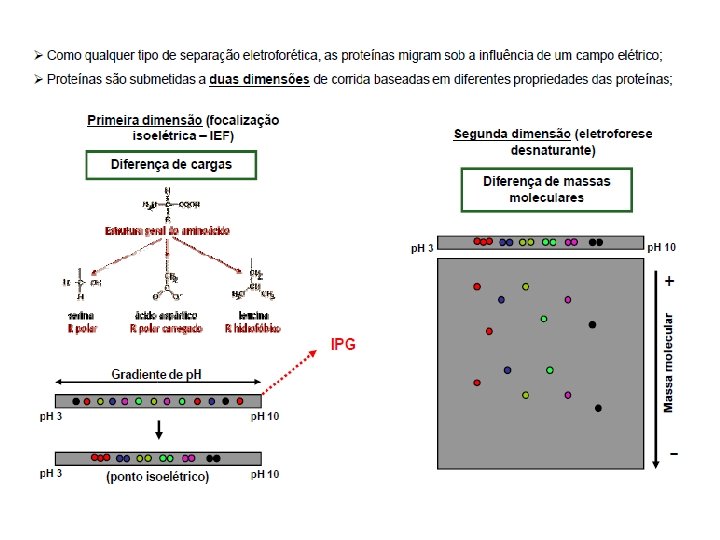
Eletroforese Bidimensional (2 D-PAGE) 2 D-PAGE: etapas principais • • • Preparação da amostra Focalização Isoelétrica SDS-PAGE Detecção Digitalização e análise de imagem • A focalização isoelétrica é realizada em géis de poliacrilamida contendo um gradiente de p. H que pode ser de dois tipos: – Tampões anfotéricos (“free carrier ampholytes”) – Gradientes imobilizados de p. H (IPG)

Preparação da amostra Rompimentos de interação não covalentes da proteina Detergentes: Agentes redutores: – Rompem interações hidrofóbicas, • – Para a focalização isoelétrica, não podem ter carga líquida. Devem ser não-iônicos ou zwitteriônicos, 2 -mercaptoetanol era usado nos primórdios. Sua ação tamponante destrói o gradiente de p. H na região básica. • DTT é o mais utilizado. Obs: proteínas com muita cisteína não são totalmente reduzidas com DTT, • Tributilfosfina (TBP) é o mais potente agente redutor disponível. Obs: é volátil, tóxico e requer solvente orgânico para dissolver em água, • Tris(carboxietil) fosfine é uma fosfina hidrossolúvel. – SDS deve ser evitado!! – Os mais compatíveis com as necessidades são o Triton X-100 e o CHAPS

Remoção de sais • Interferem no processo eletroforético. Eles migram através do gradiente de p. H produzindo calor e acumulamse nas duas extremidades. Zonas de alta condutividade - queda de voltagem e diminuição do campo elétrico. Proteínas não focalizam e aparecem como faixas. Os géis de focalização isoelétrica incham nessas zonas de alta condutividade devido ao acúmulo de água. • Remoção por precipitação ou diálise.

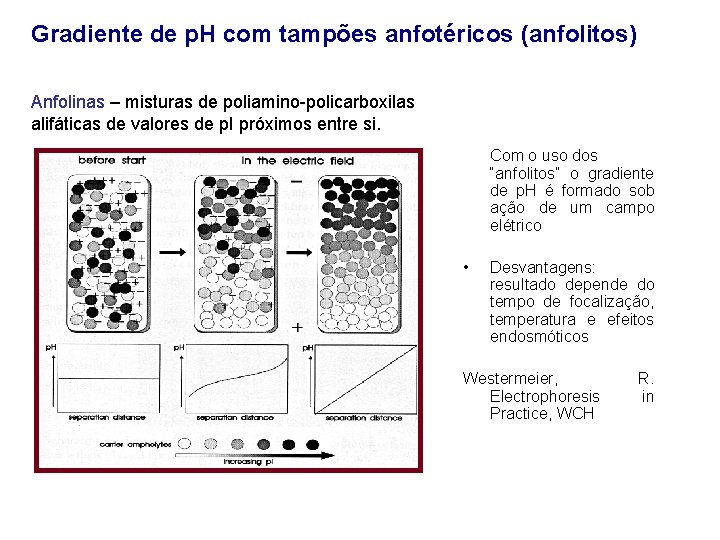
Gradiente de p. H com tampões anfotéricos (anfolitos) Anfolinas – misturas de poliamino-policarboxilas alifáticas de valores de p. I próximos entre si. Com o uso dos “anfolitos” o gradiente de p. H é formado sob ação de um campo elétrico • Desvantagens: resultado depende do tempo de focalização, temperatura e efeitos endosmóticos Westermeier, Electrophoresis Practice, WCH R. in

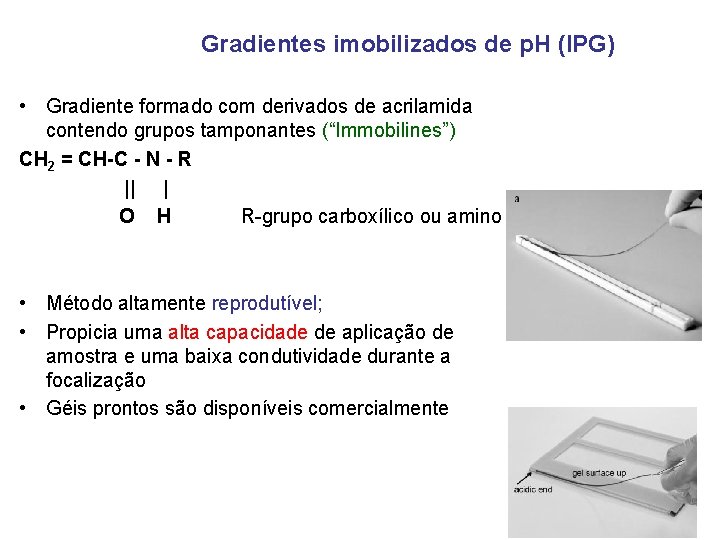
Gradientes imobilizados de p. H (IPG) • Gradiente formado com derivados de acrilamida contendo grupos tamponantes (“Immobilines”) CH 2 = CH-C - N - R || | O H R-grupo carboxílico ou amino • Método altamente reprodutível; • Propicia uma alta capacidade de aplicação de amostra e uma baixa condutividade durante a focalização • Géis prontos são disponíveis comercialmente


Métodos de revelação Ä 1 µg de Proteína Revelação por Coomassie Revelação pela Prata (Lópes, 2007)

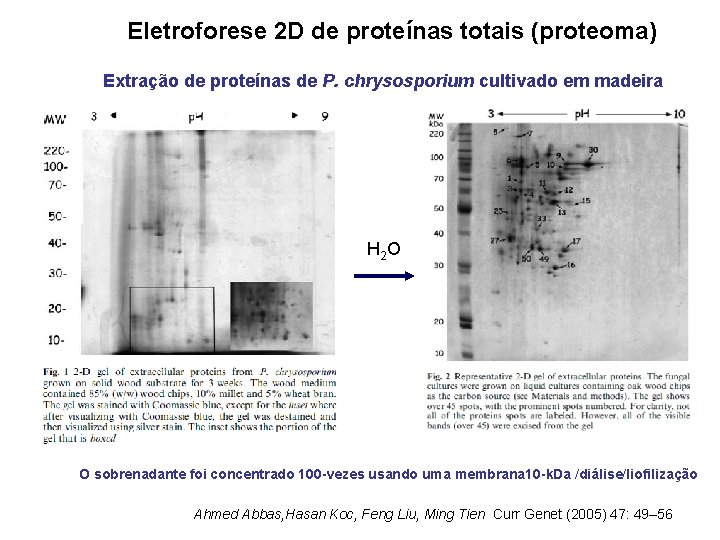
Eletroforese 2 D de proteínas totais (proteoma) Extração de proteínas de P. chrysosporium cultivado em madeira H 2 O O sobrenadante foi concentrado 100 -vezes usando uma membrana 10 -k. Da /diálise/liofilização Ahmed Abbas, Hasan Koc, Feng Liu, Ming Tien Curr Genet (2005) 47: 49– 56

Identificação de enzimas em géis de eletroforese

Aplicação de polissacarídeos covalentemente ligados para detecção de enzimas nos géis • Polissacarídeos covalentemente ligado a um corante são substratos específicos para enzimas que tem uma ação endo. • O corante ligado covalentemente representa uma barreira para a ação de exo-enzimas. • O corante pode ser destruído por enzimas oxidativas que degradam compostos aromáticos. • Vamos usar o corante RBB-xilana para mostrar o princípio da aplicação do polissacarídeo ligado covalentemente.

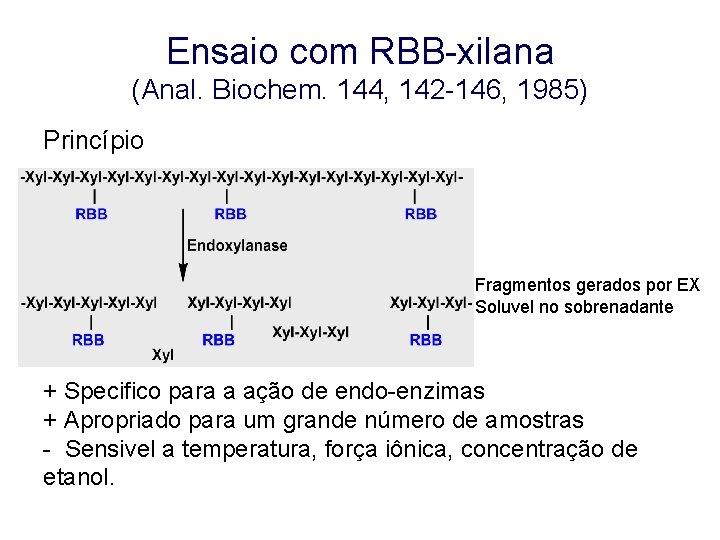
Ensaio com RBB-xilana (Anal. Biochem. 144, 142 -146, 1985) Princípio Fragmentos gerados por EX Soluvel no sobrenadante + Specifico para a ação de endo-enzimas + Apropriado para um grande número de amostras - Sensivel a temperatura, força iônica, concentração de etanol.

Exemplo de ensaio enzimático • Preparar a solução do polissacarídeo-corante (2 a 5 mg/ml, dependendo da solubilidade do substrato) em um tampão contendo 0, 02 % de azida sódica; • Incubar 0, 5 ml da enzima propriamente diluída (10 -50 l) em Eppendorf e parar a reação com dois volumes de etanol; • Deixar em repouso por 2 h, centrifugar (1 min a 14000 rpm) e medir a absorbancia do sobrenadante contra um branco: a 595 nm se o substrato for o Remazol Brilliant Blue (RBB) ou a 525 nm quando o substrato for Ostazine Brilliant Red (OBR) O ensaio é semi-quantitativo porque a solubilidade dos fragmentos é seriamente dependente da força ionica e temperatura Methods Enzymol. 160, 74 -86, 1988; Methods Enzymol. 160, 536 -541, 1988).

Vantagem de incorporar os polissacarídeos nos géis (agar) • Não difundem para o meio • Fragmentos gerados pelas enzimas difundem rapidamente e causam descoloração do gel • Pode ser usado para detecção de enzimas em meio sólido: - para screening de produtores - para detecção de enzimas em géis de eletroforese no caso da separação ser feita em condiçoes nativas ou em condições em que as enzimas foram renaturadas.

Detecção de endoglucanases em géis de eletroforese • Preparar o gel de agar entre placas da mesma forma que se faz com o gel de poliacrilamida, porem na posição horizontal e usando um tampão no p. H de atividade. Adicionar ao agar o substrato ligado ao corante. • Lavar o gel com tampão de atividade durante 30 min, trocando o tampão a cada 10 min (para trazer o p. H do gel para o p. H ótimo das enzimas). • Deitar o gel de eletroforese sobre o gel de agar com o corante a fim de evitar a formação de bolhas. Incubar na temperatura da atividade da enzima. Observe as bandas transparentes contra a luz, correspondente à difusao dos fragmentos formados pela enzima. Lavar o gel

Lavagem do gel – aumentar a sensibilidade da detecção • Lave o gel com uma mistura de 0. 05 M tampão acetato-etanol 1 : 2 (por volume) por várias horas ou overnight. As lavagens retiram os fragmentos de baixa massa molar. • Zonas sem coloração aparecem no gel. Anal Biochem. 144, 147 -151, 1985; Anal. Biochem. 172, 176 -179, 1988)

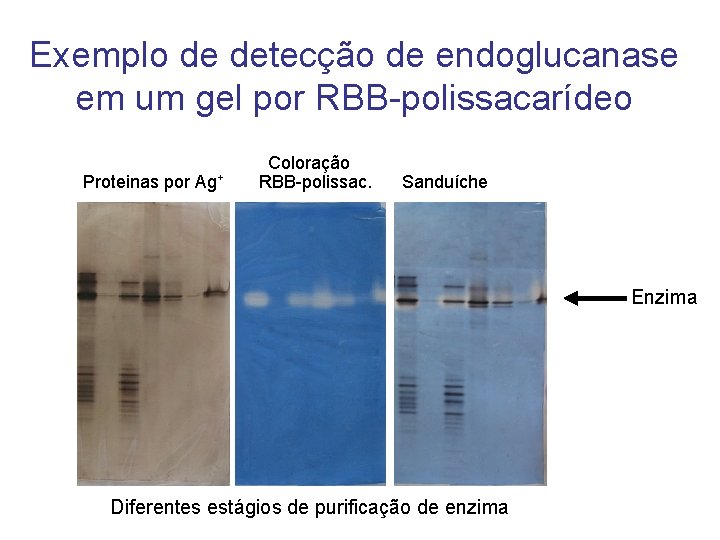
Exemplo de detecção de endoglucanase em um gel por RBB-polissacarídeo Proteinas por Ag+ Coloração RBB-polissac. Sanduíche Enzima Diferentes estágios de purificação de enzima

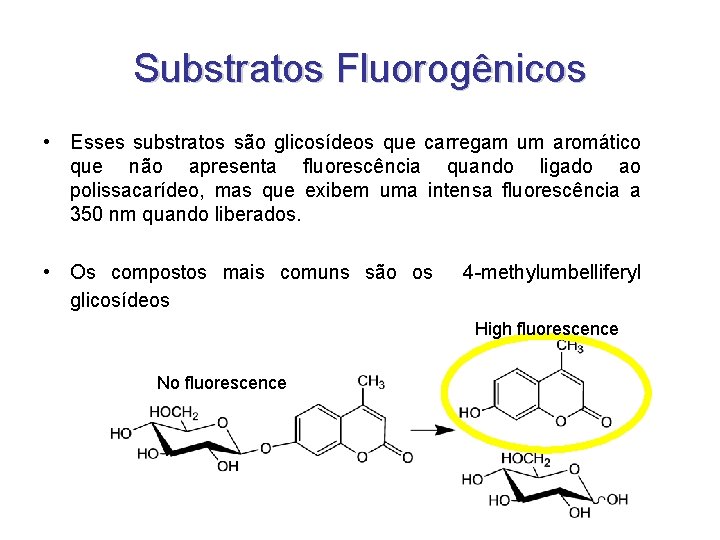
Substratos Fluorogênicos • Esses substratos são glicosídeos que carregam um aromático que não apresenta fluorescência quando ligado ao polissacarídeo, mas que exibem uma intensa fluorescência a 350 nm quando liberados. • Os compostos mais comuns são os glicosídeos 4 -methylumbelliferyl High fluorescence No fluorescence

Ensaios com -1, 4 -xilo-oligossacarídeos -xylosidase Umb-Xyl 2 usado na detecção de EXs em géis Modo de aplicação dos substratos fluorogênicos • São usados em concentrações relativamente baixas (0. 5 -2 m. M). • Os substratos podem ser incorporados em gés de agar ou agarose e usados com técnica de cobertura para detecção de atividades enzimáticas em PAGE ou IEF. • Pode ser usada para seleção de microrganismos em testes de colônias em placas. Muito sensível!

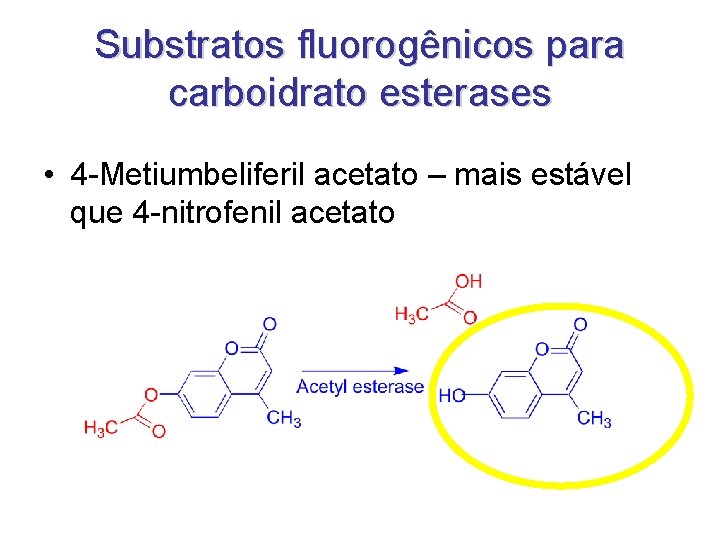
Substratos fluorogênicos para carboidrato esterases • 4 -Metiumbeliferil acetato – mais estável que 4 -nitrofenil acetato

Pontos importantes desta aula: 1) Entender os fundamentos teóricos das modalidades de eletroforese 2) Importância do preparo das amostras para eletroforese 3) Identificação de proteínas e enzimas em géis 4) Eletroforese como técnica de pureza e aplicada à análise proteômica Material para leitura: 1) Eletroforese e marcadores bioquímicos em plantas e microrganismos/Acelino Couto Alfenas (editor)2 ed. Viçosa UFV , 2006 2) Artigos citados na aula