Atomi molecole e ioni anione catione Teoria atomica


















![Gli ioni con le strutture dei gas nobili 56 Ba 9 F [Xe]6 s Gli ioni con le strutture dei gas nobili 56 Ba 9 F [Xe]6 s](https://slidetodoc.com/presentation_image_h/f866c125b793088f5555182bf65b7f03/image-37.jpg)

















- Slides: 66

Atomi, molecole e ioni anione + catione -

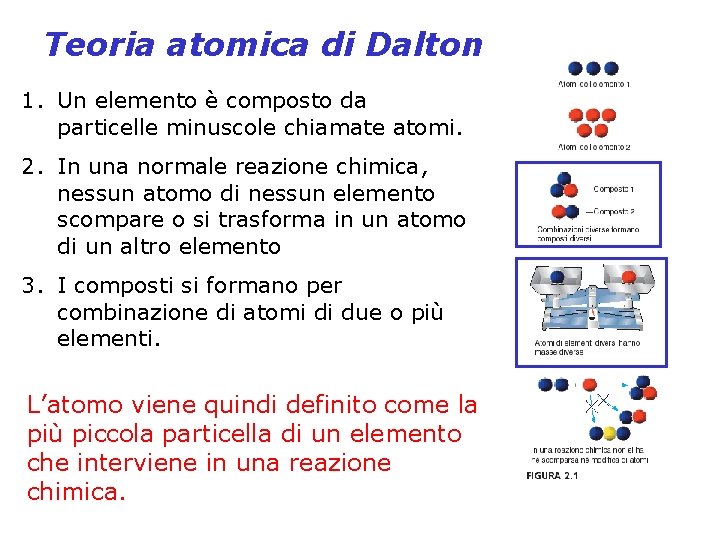
Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento scompare o si trasforma in un atomo di un altro elemento 3. I composti si formano per combinazione di atomi di due o più elementi. L’atomo viene quindi definito come la più piccola particella di un elemento che interviene in una reazione chimica.

Teoria atomica di Dalton spiegò tre leggi fondamentali della chimica: 1. La legge di conservazione della massa Non avviene alcun cambiamento rilevabile nella massa durante una reazione chimica. 2. La legge della composizione costante Un composto contiene sempre gli stessi elementi nelle stesse proporzioni in massa. 3. La legge delle proporzioni multiple Le masse di un elemento che si combinano con una massa fissa di un secondo elemento stanno tra loro in rapporti espressi da numeri interi piccoli.

Cr 2 O 3 2 Cr : 3 O Cr. O 3 1 Cr : 3 O

Legge delle proporzioni multiple (fu dedotta dalla teoria atomica di Dalton) Quando due elementi formano più di un composto, le masse di un elemento in questi composti rispetto ad una massa definita di un altro elemento sono in proporzioni espresse da numeri piccoli interi Esempio: monossido e biossido di carbonio sono entrambi costituiti da carbonio e ossigeno. Consideriamo 1, 0000 g di carbonio, il monossido di carbonio contiene 1, 3321 g di ossigeno per ogni 1, 0000 g di carbonio, mentre il biossido di carbonio contiene 2, 6642 g di ossigeno per ogni 1, 0000 g di carbonio. Quindi le masse di ossigeno nei due composti stanno fra loro nel rapporto 1: 2. 1, 3321 : 2, 6642 = 1 : 2 CO : CO 2

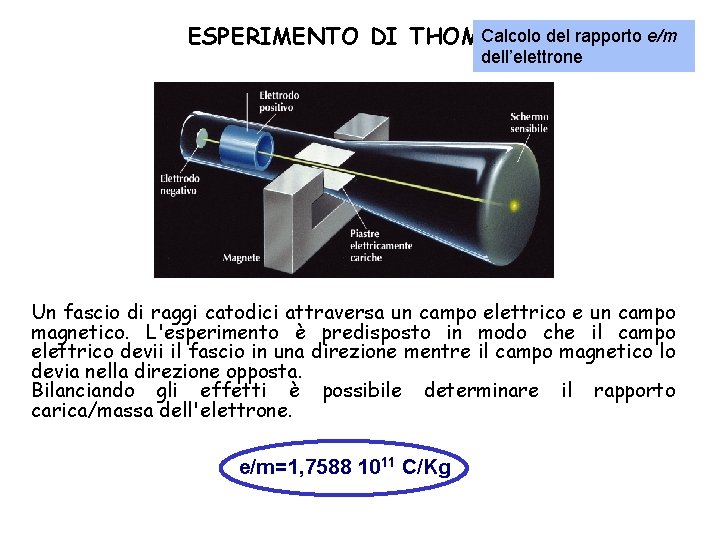
STRUTTURA DELL'ATOMO Vari esperimenti condotti all'inizio del 1900 dimostrarono che gli atomi non sono indivisibili ma costituiti da particelle più piccole (elementari). Elettrone Se a due elettrodi posti alle estremità di un tubo in cui è fatto il vuoto viene applicato un alto voltaggio, dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici. Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente chiamò elettroni.

Calcolo del rapporto e/m ESPERIMENTO DI THOMSON dell’elettrone Un fascio di raggi catodici attraversa un campo elettrico e un campo magnetico. L'esperimento è predisposto in modo che il campo elettrico devii il fascio in una direzione mentre il campo magnetico lo devia nella direzione opposta. Bilanciando gli effetti è possibile determinare il rapporto carica/massa dell'elettrone. e/m=1, 7588 1011 C/Kg

Quantizzazione della carica elettrica: esperimento di Millikan Gocce di olio cariche elettricamente vengono fatte cadere in presenza di un campo elettrico. Dalla massa nota delle goccioline e dal voltaggio applicato per mantenere ferme le gocce cariche si potè calcolare la carica presente sulle gocce. Fu trovato che tutte le cariche elettriche sono multiple di una carica elementare minima e assunta come carica dell'elettrone. e=1, 602 10 -19 C (coulomb)

Thomson aveva calcolato: e/m= 1, 76 1011 C/Kg Da cui si dedusse: m= 9, 11 10 -31 Kg Un valore circa 1800 volte più piccolo della massa dell'idrogeno. Quasi tutta la massa atomica è quindi associata alla carica positiva (cioè, come vedremo, è concentrata nel nucleo)

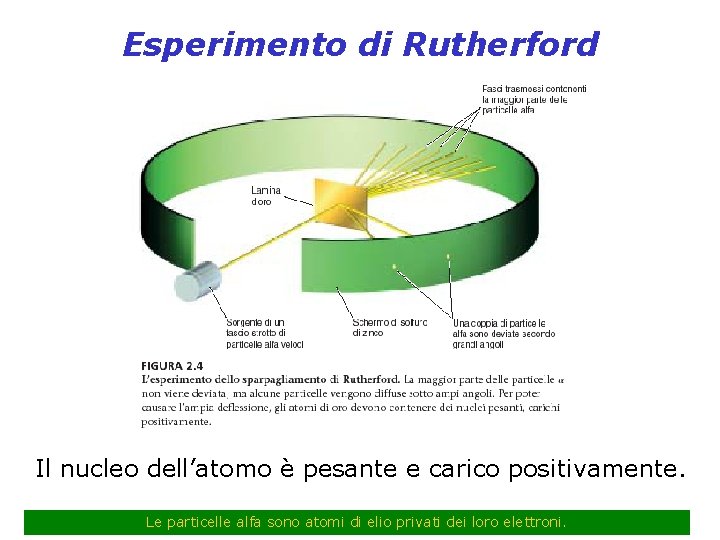
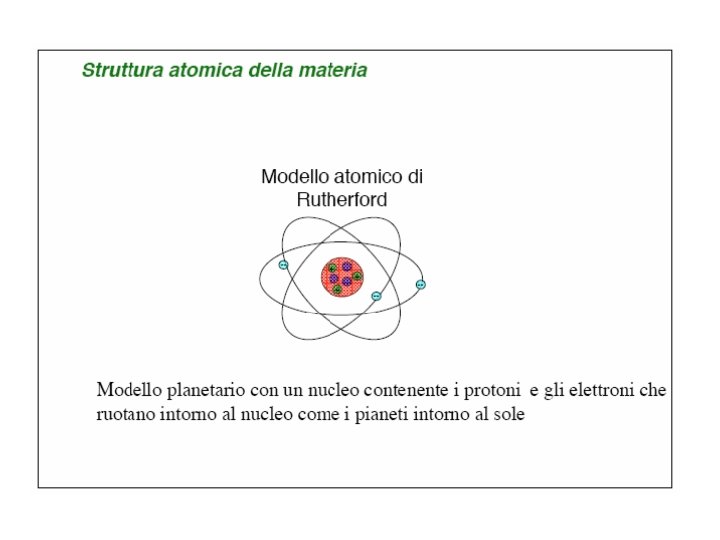
Esperimento di Rutherford Il nucleo dell’atomo è pesante e carico positivamente. Le particelle alfa sono atomi di elio privati dei loro elettroni.

Raggi : particelle positive con massa 4 volte l’idrogeno (massa dell’elio, carica +2) La maggiorparte delle particelle passavano la lamina senza subire deviazioni ma una piccola parte veniva fortemente deviata o addirittura respinta

La maggior parte della massa di un atomo (>99, 9 %) è concentrata nel nucleo, anche se il volume del nucleo è molto più piccolo di quello dell’atomo.


Modello nucleare Rutherford concluse che la maggiorparte della massa atomica è concentrata in un centro carico positivamente, nucleo, attorno al quale si muovono gli elettroni (di massa trascurabile) a distanze molto grandi La maggior parte dell'atomo è vuoto Dimensioni atomiche: circa 1 Å Dimensioni nucleari: circa 10 -5 Å

Numero atomico Tutti gli atomi di uno stesso elemento hanno lo stesso numero di protoni nel nucleo. Questo numero è definito come il numero atomico di un atomo. Z = numero di protoni In un atomo neutro il numero di protoni è uguale al numero di elettroni. Atomo di H: 1 protone, 1 elettrone, Z=1

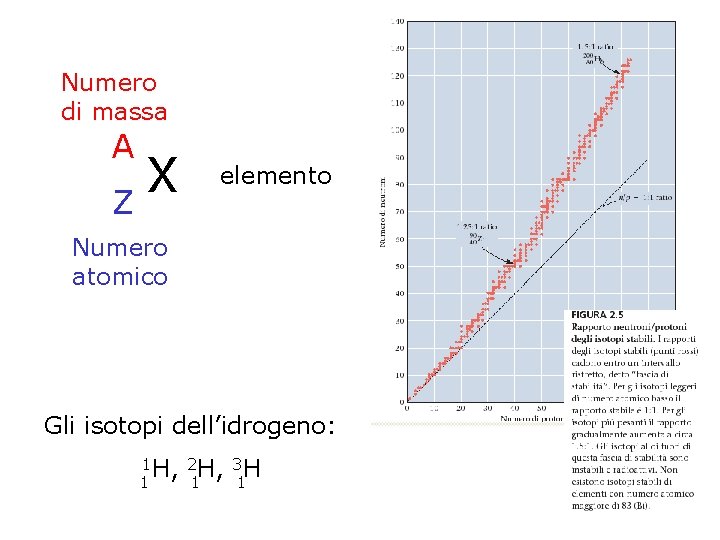
Numero di massa e Isotopi Il numero di massa (A) di un atomo è: A = numero dei protoni + numero dei neutroni. Gli atomi di un dato elemento possono differenziarsi nel numero di neutroni !!! Atomi con lo stesso numero atomico, ma diverso numero di massa si chiamano isotopi.

Numero di massa A X Z elemento Numero atomico Gli isotopi dell’idrogeno: 1 H, 2 H, 3 H 1 1 1

STRUTTURA NUCLEARE Ogni elemento è caratterizzato da una carica nucleare tipica che è un multiplo della carica elettronica e. Questo multiplo viene indicato con la lettera Z. Ad ogni Z corrisponde un elemento, nell’ordine: H Z=1 He Z=2 Li Z=3 . . Nell'atomo neutro attorno a tale nucleo si muovono Z elettroni. Un nucleo è costituito da due tipi di particelle: Protoni carica dell'elettrone +e massa 1836 volte quella Neutroni carica dell'elettrone 0 massa 1839 volte quella v v

Un nucleo è quindi caratterizzato da due numeri v Un numero atomico v Un numero di massa neutroni Z numero di protoni A numero di protoni + numero di Un nucleo particolare caratterizzato da Z e da A è anche chiamato nuclide e rappresentato con la seguente notazione: Numero di massa Numero atomico Z=11 A=23 11 protoni (definisce l'elemento Na) 23 -11= 12 neutroni

Atomi i cui nuclei hanno lo stesso numero di protoni ma diverso numero di neutroni sono detti isotopi. Ad esempio l'idrogeno ha tre isotopi: idrogeno 1 protone nessun neutrone deuterio 1 protone 1 neutrone trizio 1 protone 2 neutroni Gli elementi presenti in natura sono in genere miscele di isotopi: Cloro 75, 8 % 24, 2 % Abbondanza relativa: frazione del numero totale di atomi di un dato isotopo. Il postulato di Dalton ? Il postulato di Dalton rimane valido se si fa riferimento ad una massa media: infatti la composizione isotopica rimane costante.


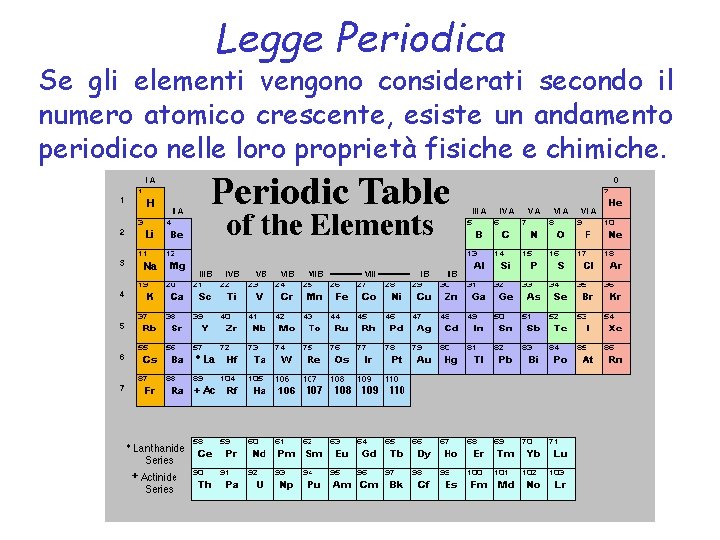
Nel 1869 Dmitri Mendeleev presentò la prima tabella periodica organizzata in modo da arrangiare gli elementi secondo i pesi atomici crescenti

Mendeleev • stabilì che se il peso atomico di un elemento lo faceva posizionare nel posto sbagliato, allora il peso atomico era errato (corresse le masse atomiche di Be, In e U). Legge Periodica Se gli elementi vengono considerati secondo il peso atomico crescente, esiste un andamento periodico nelle loro proprietà fisiche e chimiche. • era così sicuro della sua classificazione che predisse le proprietà fisiche di tre elementi che erano ancora sconosciuti.

Nel 1913 Henry Moseley, mediante il suo lavoro con i raggi X, determinò l’attuale carica nucleare degli elementi (numero atomico). Arrangiò poi gli elementi in ordine di numero atomico crescente MoseleyÍs X-ray spectra of several elements

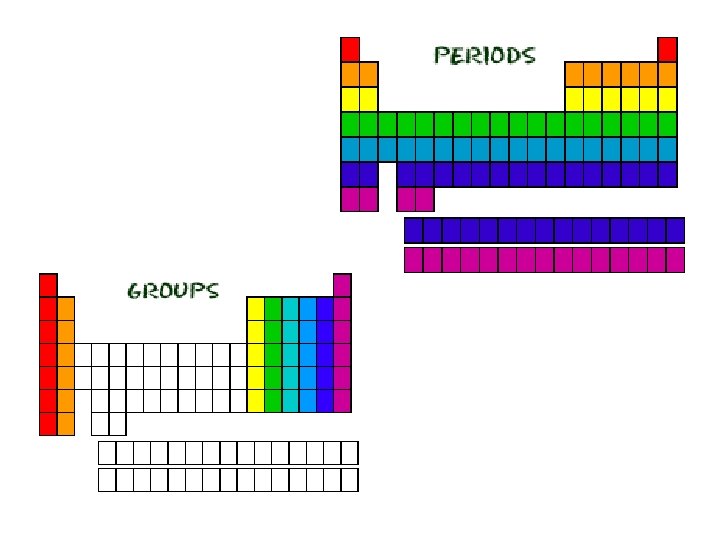
La tabella periodica

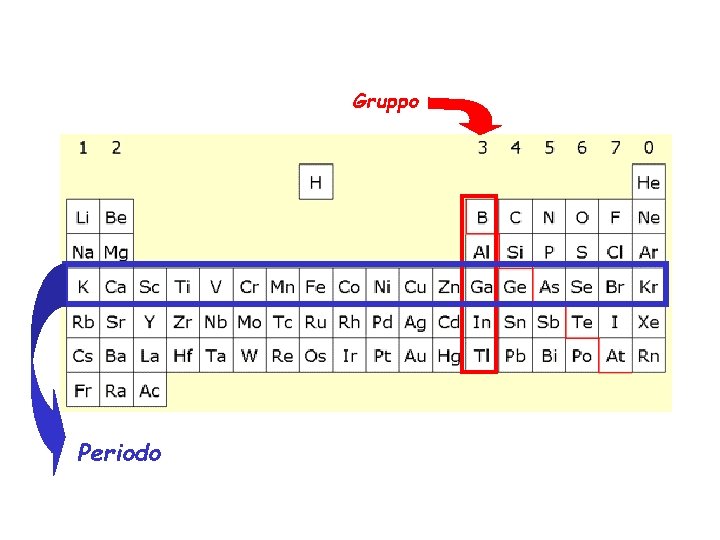
Gruppo Periodo


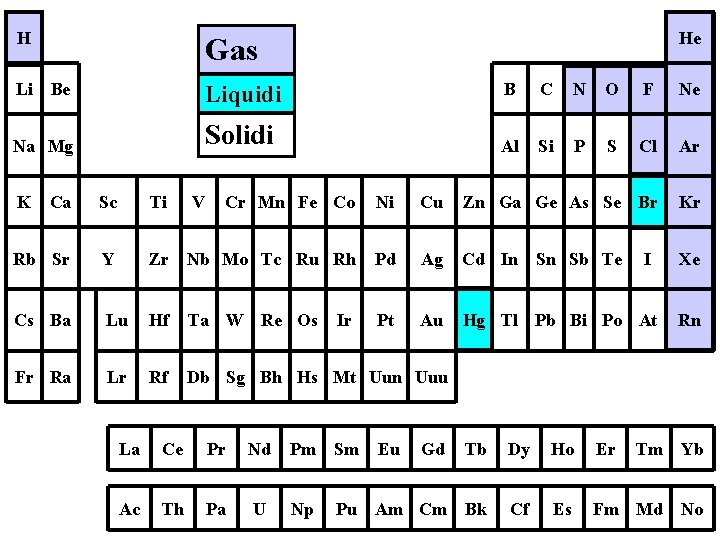
H Gas Li Be Liquidi B C N O F Ne Na Mg Solidi Al Si P S Cl Ar K He Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te Xe Cs Ba Lu Hf Ta W Re Os Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Lr Rf Db Sg Bh Hs Mt Uun Uuu Ir I La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Ac Th Pa U Np Am Cm Bk Cf Es Fm Md No Pu

H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te Xe Cs Ba Lu Hf Ta W Re Os Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Lr Rf Db Sg Bh Hs Mt Uun Uuu Ir I La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Ac Th Pa U Np Am Cm Bk Cf Es Fm Md No Pu

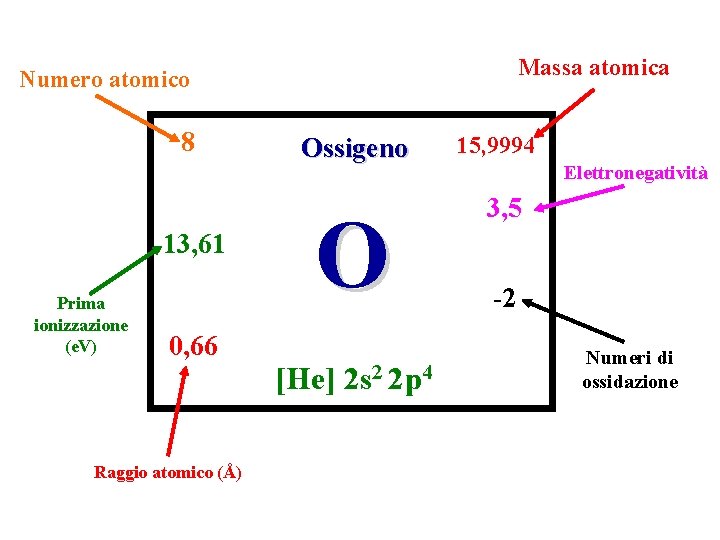
Massa atomica Numero atomico 8 13, 61 Prima ionizzazione (e. V) 0, 66 Raggio atomico (Å) Ossigeno O [He] 2 s 2 2 p 4 15, 9994 Elettronegatività 3, 5 -2 Numeri di ossidazione

Legge Periodica Se gli elementi vengono considerati secondo il numero atomico crescente, esiste un andamento periodico nelle loro proprietà fisiche e chimiche.

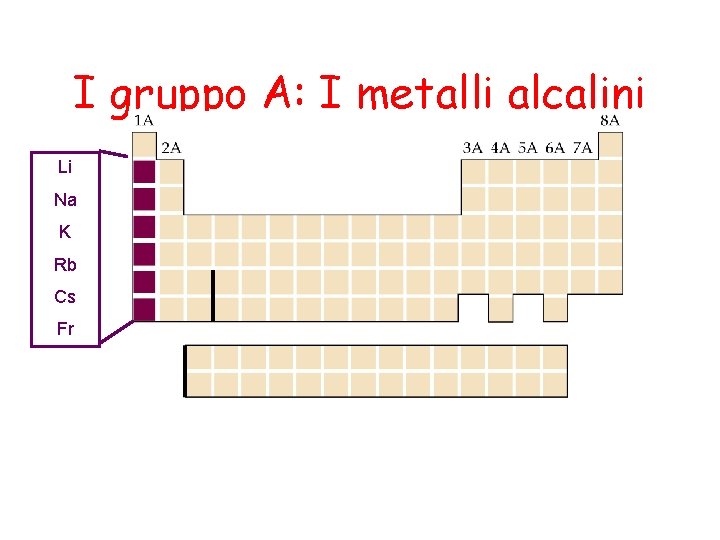
I gruppo A: I metalli alcalini Li Na K Rb Cs Fr

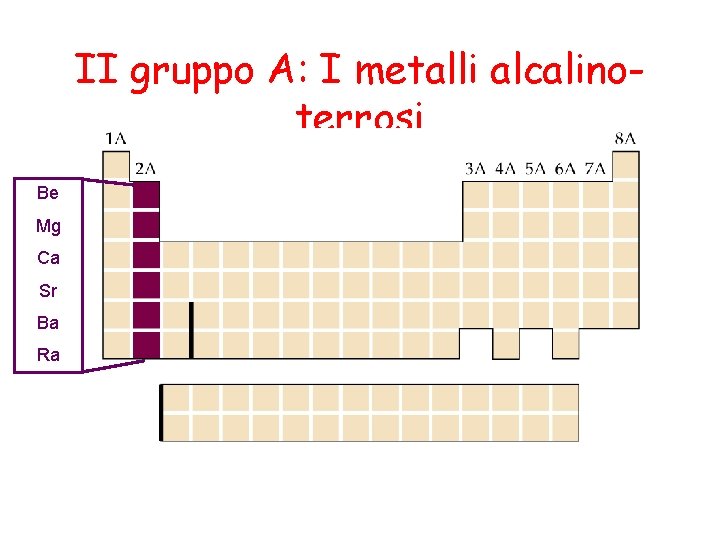
II gruppo A: I metalli alcalinoterrosi Be Mg Ca Sr Ba Ra

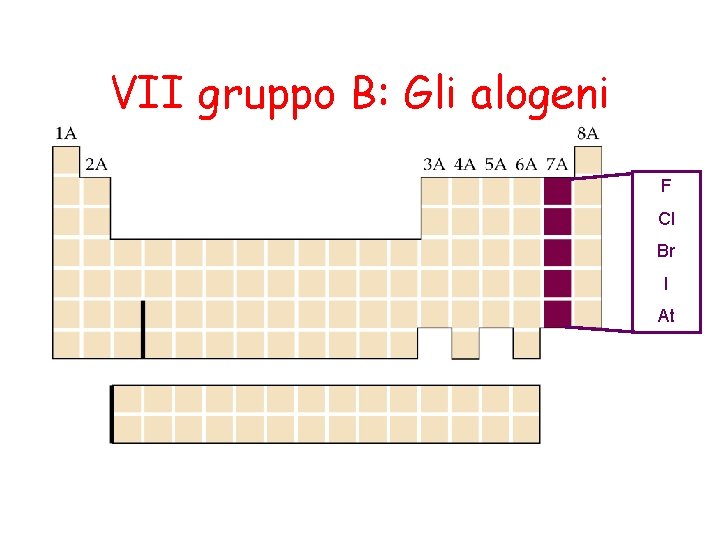
VII gruppo B: Gli alogeni F Cl Br I At

I gas nobili He Ne Ar Kr Xe Rn

I metalli di transizione Lantanidi Attinidi
![Gli ioni con le strutture dei gas nobili 56 Ba 9 F Xe6 s Gli ioni con le strutture dei gas nobili 56 Ba 9 F [Xe]6 s](https://slidetodoc.com/presentation_image_h/f866c125b793088f5555182bf65b7f03/image-37.jpg)
Gli ioni con le strutture dei gas nobili 56 Ba 9 F [Xe]6 s 2 Ba 2+ [Xe] + 2 e- [He]2 s 22 p 5 + 1 e- F- [He]2 s 22 p 6

I cationi dei gas metalli di transizione I metalli di transizione non formano ioni configurazioni dei gas nobili. Quando gli atomi dei metalli di transizione formano ioni positivi si perdono per primi gli elettroni del sottolivello s più esterno. 25 Mn [Ar]4 s 23 d 5 Mn 2+ [Ar]3 d 5

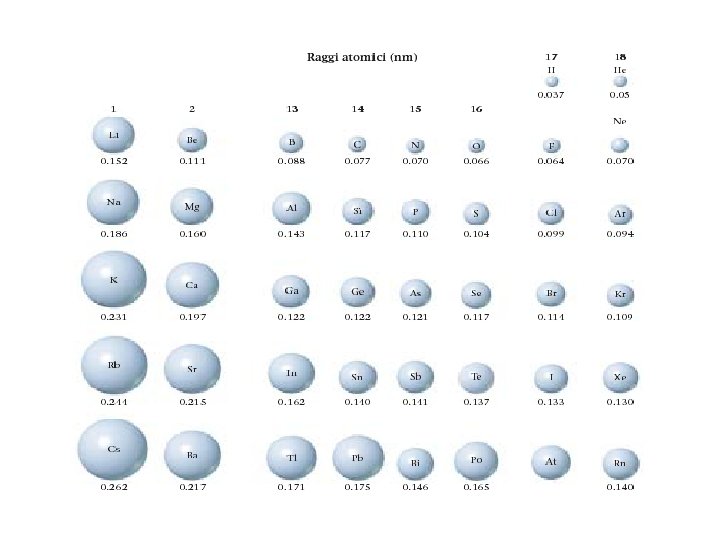
Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima di avvicinamento tra gli atomi di una sostanza elementare.



Raggi ionici (cationi) Gli ioni positivi sono più piccoli degli atomi dei metalli dai quali si formano.

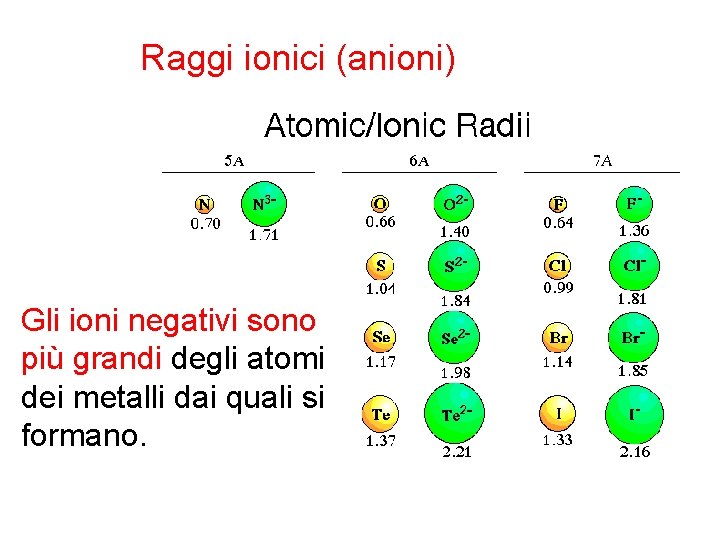
Raggi ionici (anioni) Gli ioni negativi sono più grandi degli atomi dei metalli dai quali si formano.

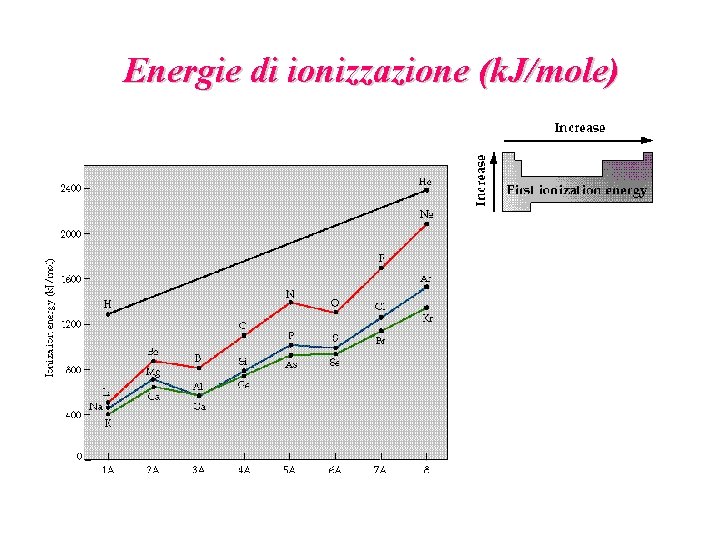
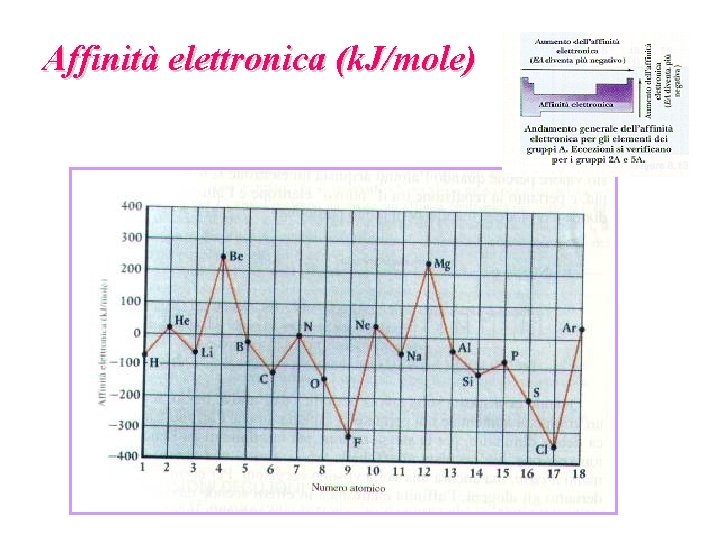
Energia di ionizzazione di un atomo (o potenziale di ionizzazione): A(g) A+(g) + e-(g) H ° = I 1 Affinità elettronica di un atomo: A-(g) A(g) + e-(g) H ° = A

Energie di ionizzazione (k. J/mole)

Affinità elettronica (k. J/mole)

Elettronegatività: tendenza di un atomo ad attrarre su di se gli elettroni di un legame. Energia di Affinità Elettronegatività + ionizzazione elettronica

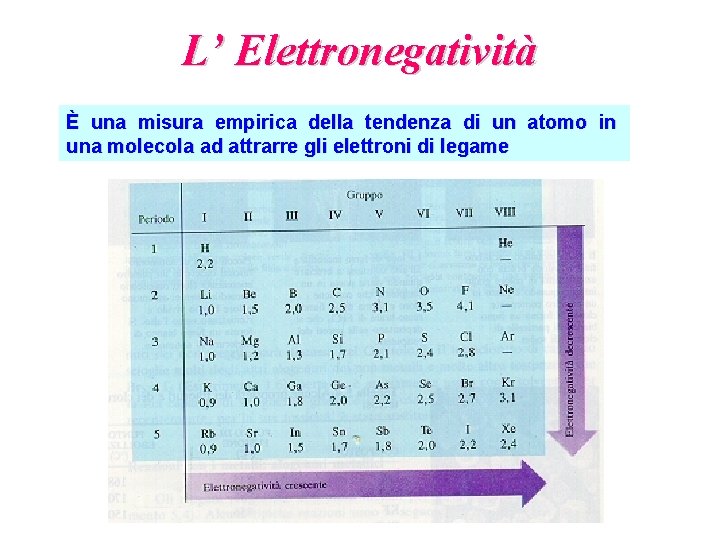
L’ Elettronegatività È una misura empirica della tendenza di un atomo in una molecola ad attrarre gli elettroni di legame

Elettronegatività secondo Pauling Se nella molecola AB il legame fosse omopolare, l'energia di legame, EAB, dovrebbe risultare pari alla media delle energie di legame della molecola A 2 e della molecola B 2: In realtà, sperimentalmente si osserva che EAB è quasi sempre maggiore della media delle energie di legame EA ed E B.

L' "extra" energia, E, è dovuta al contributo del carattere ionico presente nel legame della molecola AB. Poiché il carattere ionico del legame covalente è da mettere in relazione con la differenza di elettronegatività dei due atomi legati, Pauling definì la differenza di elettronegatività, E. N. , 0. 208 è un fattore di conversione per trasformare le kcal in e. V (1 e. V = 23. 1 kcal/mole). Dato che, il metodo suggerito da Pauling consente di valutare solo differenze di elettronegatività, Pauling pose pari a 4 l'elettronegatività del fluoro, l'elemento più elettronegativo, e a partire da esso ricavò i valori degli altri elementi.

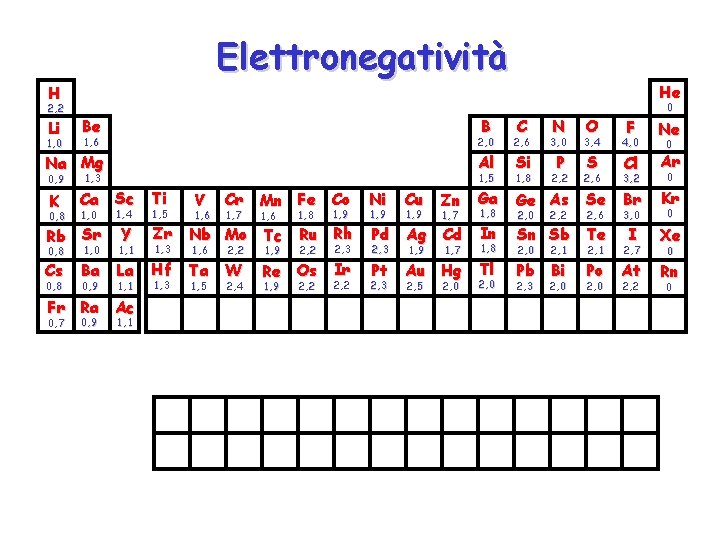
Elettronegatività H 2, 2 Li 1, 0 Be B 1, 6 Na Mg 0, 9 K 0, 8 1, 3 Ca Sc 1, 0 Rb Sr 0, 8 Cs 0, 8 1, 0 1, 4 Y 1, 1 Ba La 0, 9 1, 1 Fr Ra Ac 0, 7 0, 9 1, 1 Ti 1, 5 V 1, 6 Cr 1, 7 Mn Fe Co 1, 6 Zr Nb Mo Tc 1, 3 1, 6 2, 2 Hf Ta W 1, 3 1, 5 2, 4 1, 9 1, 8 1, 9 2, 2 2, 3 Ru Rh Re Os Ir 1, 9 2, 2 He C N O 2, 0 2, 6 3, 0 3, 4 4, 0 F Ne Al Si P S 2, 6 Cl 3, 2 Ar Se Br Kr 2, 2 1, 5 1, 8 Zn Ga Ge As Pd Ag Cd 2, 3 1, 9 In Sn Sb Te Pt Au Hg Tl Ni 1, 9 2, 3 Cu 1, 9 2, 5 1, 7 2, 0 0 1, 8 2, 0 0 2, 2 2, 0 2, 1 2, 7 I Xe Pb Bi Po At Rn 2, 0 3, 0 0 2, 3 2, 6 0 2, 2 0 0

Come atomi isolati si trovano in natura solo i gas nobili: He, Ne, Ar, … In generale, gli atomi tendono a combinarsi e a formare molecole e ioni Gli atomi sono uniti tra loro da grandi forze chiamate legami covalenti. Le forze tra molecole adiacenti sono, invece, abbastanza deboli.

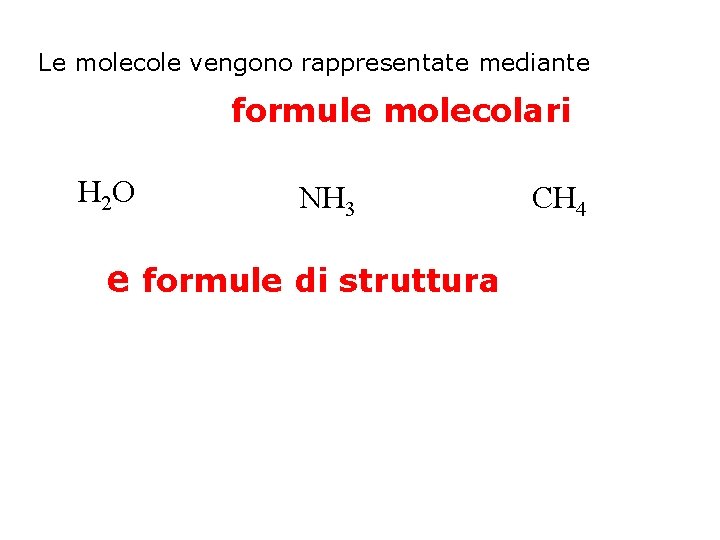
Le molecole vengono rappresentate mediante formule molecolari H 2 O NH 3 e formule di struttura CH 4

Ioni Quando un atomo perde o acquista elettroni si formano particelle cariche chiamate ioni. atomo Na ione Na+ + e- (11 p, 11 e) atomo Ca (11 p, 10 e) ione Ca 2+ + 2 e- (20 p, 20 e) (20 p, 18 e) positivamente vengono chiamati cationi. Gli atomi carichi

Gli atomi dei non metalli formano ioni negativi, che vengono chiamati anioni. atomo Cl + e- ione Cl(17 p, 17 e) (17 p, 18 e) atomo O + 2 e- ione O 2(8 p, 8 e) (8 p, 10 e) Notate che in entrambi i casi il numero dei protoni nel nucleo non cambia

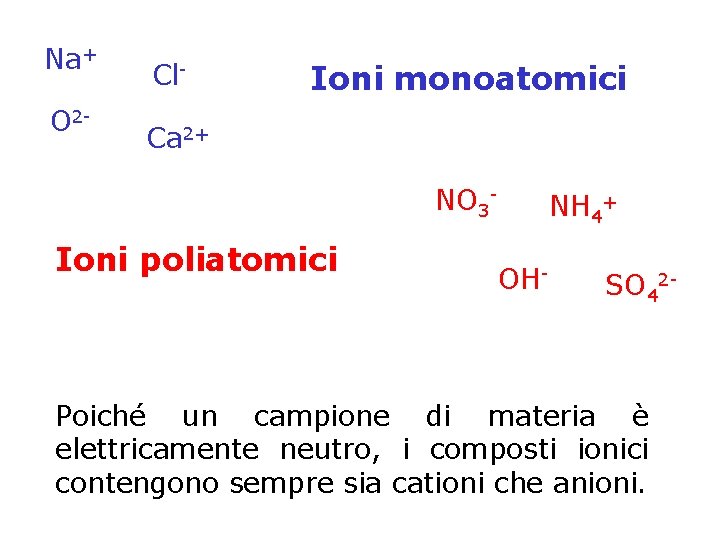
Na+ O 2 - Cl- Ioni monoatomici Ca 2+ NO 3 - Ioni poliatomici NH 4+ OH- SO 42 - Poiché un campione di materia è elettricamente neutro, i composti ionici contengono sempre sia cationi che anioni.

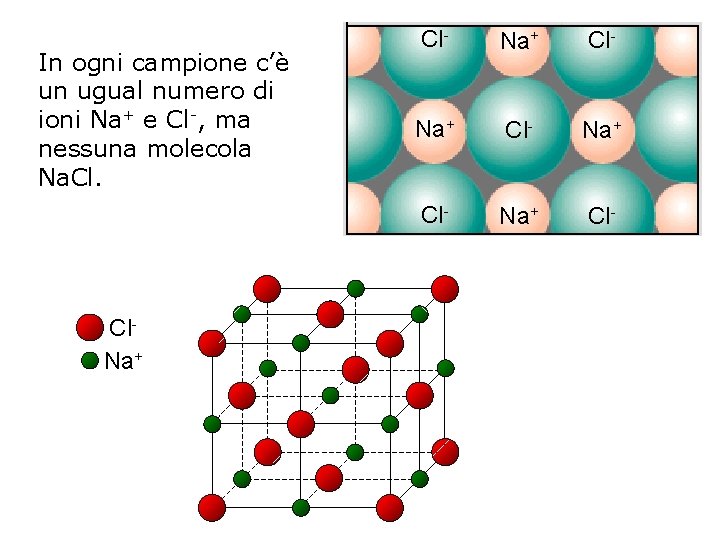
In ogni campione c’è un ugual numero di ioni Na+ e Cl-, ma nessuna molecola Na. Cl. Na+ Cl- Na+ Cl-

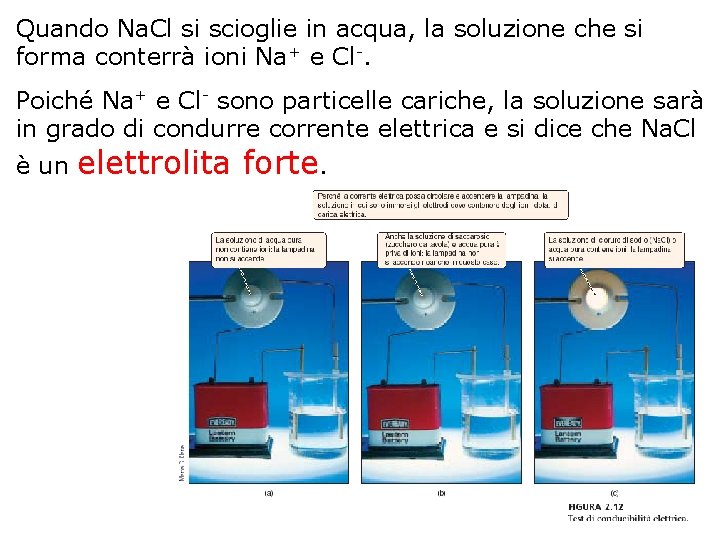
Quando Na. Cl si scioglie in acqua, la soluzione che si forma conterrà ioni Na+ e Cl-. Poiché Na+ e Cl- sono particelle cariche, la soluzione sarà in grado di condurre corrente elettrica e si dice che Na. Cl è un elettrolita forte.

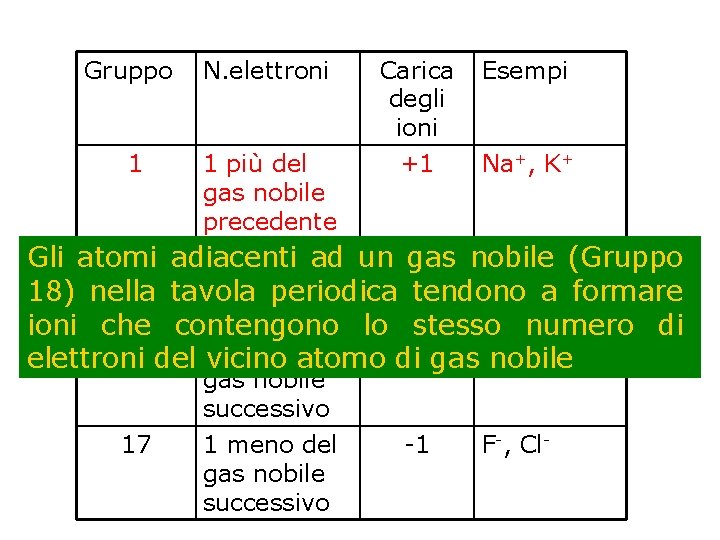
Gruppo 1 N. elettroni 1 più del gas nobile precedente Carica degli ioni +1 Esempi Na+, K+ 2+ 2 adiacenti 2 più del ad un +2 Mg 2+, Ca Gli atomi gas nobile (Gruppo gas nobile 18) nella tavola periodica tendono a formare precedente lo stesso numero di ioni che contengono 2 -, S 216 2 meno del -2 O elettroni del vicino atomo di gas nobile successivo 17 1 meno del gas nobile successivo -1 F-, Cl-

Diversi metalli che sono abbastanza distanti dai gas nobili formano ioni positivi. Molti di questi formano più di un catione. Ad es. : Fe 2+, Fe 3+ Cu+, Cu 2+

1. I cationi monoatomici prendono il nome del metallo da cui derivano. Na+ sodio K+ potassio Fe 2+ ferro (II) (-oso) Fe 3+ ferro (III) (ico) 2. Gli anioni monoatomici sono denominati aggiungendo il suffisso -uro alla radice del nome del non metallo da cui derivano. N 3 - nitruro O 2 - ossido H- idruro S 2 - solfuro F- fluoruro Se 2 - selenuro Cl- cloruro

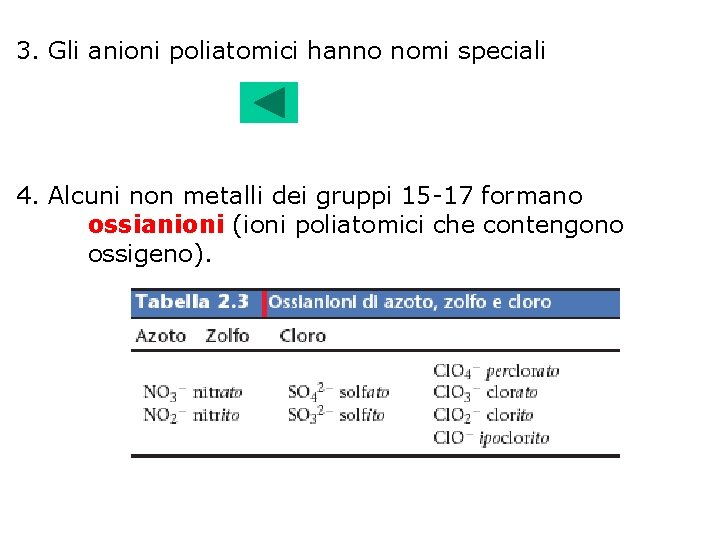
3. Gli anioni poliatomici hanno nomi speciali 4. Alcuni non metalli dei gruppi 15 -17 formano ossianioni (ioni poliatomici che contengono ossigeno).

Quando un non metallo forma due ossianioni: • il suffisso –ato viene usato per il composto che contiene più atomi di ossigeno, • il suffisso –ito per quello che ne contiene meno. NO 3 - nitrato NO 2 - nitrito Quando gli ossianioni sono più di due, vengono utilizzati i prefissi: • per- per i composti con maggior numero di atomi di ossigeno • ipo- per i composti col numero più basso di atomi di ossigeno

5. Il nome di un composto ionico consiste di due termini: il primo indica l’anione, il secondo il catione: Cr(NO 3)3 nitrato di cromo (III) Sn. Cl 2 cloruro di stagno 6. Il nome sistematico di un composto molecolare binario che contiene due diversi non metalli consiste di due termini. Il primo è formato da: • il prefisso greco appropriato indicante il numero di atomi dell’elemento che nella formula appare per secondo • la radice del nome del secondo elemento • il suffisso –uro o ido (nel caso degli ossidi).

• Il secondo indica il nome dell’elemento che compare per primo nelle formula; un prefisso greco viene usato per indicare il numero di atomi di quell’elemento nella formula. N 2 O 5 pentossido di diazoto N 2 O 3 triossido di diazoto N 2 O 4 tetrossido di diazoto NO ossido di azoto

7. I composti molecolari binari che contengono H e che si dissociano in acqua formando ioni H+ sono detti acidi. Sostanza pura Soluzione acquosa HCl(g) cloruro di idrogeno H+(aq), Cl-(aq) acido cloridrico HBr(g) bromuro di idrogeno H+(aq), Br-(aq) acido bromidrico HI(g) ioduro di idrogeno H+(aq), I-(aq) acido iodidrico 8. Gli acidi che contengono ossigeno sono detti ossiacidi. HCl. O 4 acido perclorico Cl. O 4 - ione perclorato HCl. O 3 acido clorico Cl. O 3 - ione clorato HCl. O 2 acido cloroso Cl. O 2 - ione clorito HCl. O acido ipocloroso Cl. O- ione ipoclorito