Atom Molekul dan Ion 11102020 Kimia Dasar EvaZulfahYasser


















- Slides: 19

Atom, Molekul, dan Ion 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 1

Tujuan • Mengetahui teori atom Dalton dan hukum • • hukum kimia yang dijelaskannya. Mengetahui eksperimen-eksperimen dalam menentukan struktur atom. Mengenal tabel periodik dan tata letak unsur dalam tabel periodik. Mengetahui jenis-jenis senyawa kimia (molekul dan ion) Mengetahui tata cara penamaan senyawa anorganik. 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 2

Soal • Tentukan jenis unsur-unsur berikut (logam, • nonlogam, metalloid): a. He b. P c. Cd d. Ca e. Br f. As g. Ge h. Yb i. Te j. Pd Beri nama/rumus kimia senyawa-senyawa berikut: a. HCl. O 3 b. chromium (III) carbonate c. N 2 O 5 d. magnesium bicarbonate e. potassium hypochlorite f. Na 2 PO 4 g. Sr. SO 3 h. copper (II) acetate i. K 2 Cr. O 4 j. Cu(NO 3)2 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 3

Teori Atom • Teori Atom Dalton: 1. Setiap unsur terdiri atas partikel yang sangat 2. 3. 4. kecil yang disebut atom. Semua atom satu unsur adalah identik, atom unsur lain adalah berbeda dan memiliki sifat yang lain. Atom satu unsur tidak diubah menjadi atom jenis lain oleh reaksi kimia; atom tidak dibuat atau dihancurkan dengan reaksi kimia. Senyawa terbentuk ketika atom-atom dari 1 unsur atau lebih bergabung; senyawa tertentu selalu mempunyai jumlah relatif dan jenis atom yang sama. 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 4

• Teori atom Dalton menjelaskan: Ø hukum perbandingan tetap (postulat IV) Ø hukum kekekalan materi: total massa materi sebelum dan sesudah reaksi kimia adalah sama (postulat III) Ø hukum perbandingan berganda: jika dua unsur membentuk lebih dari satu senyawa, massa-massa dari satu unsur yang bergabung dengan massa yang tertentu dari unsur lainnya merupakan nisbah bilangan bulat terhadap satu dengan yang lainnya. 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 5

Penemuan Struktur Atom • Atom terdiri atas partikel-partikel yang lebih • 1) kecil yang disebut partikel subatomik. Eksperimen-eksperimen yang dilakukan untuk meneliti partikel subatomik tersebut adalah: Tabung katode dan penemuan elektron (Thompson) 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 6

2) Eksperimen Tetes Minyak Millikan penentuan muatan elektron 3) Eksperimen Rutherford penemuan inti atom (proton dan neutron) 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 7

Isotop, Nomor Atom dan Nomor Massa Partikel sub-atomik: proton, netron, elektron X atom X a nomor atom jumlah proton dalam atom b nomor massa jumlah proton dan netron Isotop: atom dari unsur tertentu yang memiliki jumlah netron berbeda Nuklida: atom dari isotop yang spesifik 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 8

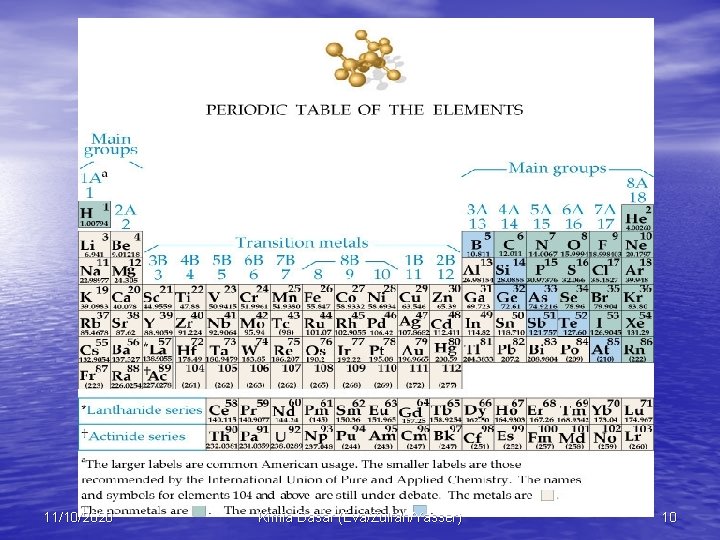
Tabel Periodik • Unsur digolongkan ke dalam logam atau nonlogam berdasarkan atas ada (atau tidaknya) sifat kilap logam, kemampuan menghantarkan listrik dan kalor, dan ductability. • Beberapa unsur mempunyai sifat di antara logam dan nonlogam, disebut metalloid. 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 9

11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 10

• Kolom pada tabel periodik disebut golongan. • Baris pada tabel periodik disebut periode. • Unsur-unsur yang terletak pada kolom yang sama mempunyai sifat-sifat fisika dan kimia yang serupa. • Semua unsur yang terletak di sebelah kiri tabel periodik termasuk logam (kecuali hidrogen). 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 11

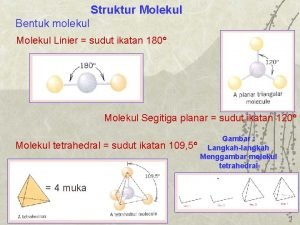
Molekul dan Senyawa Molekular • Molekul: gabungan 2 atau lebih atom yang • • • terikat erat yang tidak memiliki muatan listrik. Senyawa molekular : senyawa yang terdiri dari molekul-molekul, contoh: H 2 O 2, CH 3 COOH, dsb. dinyatakan dengan rumus molekul Rumus empiris: menyatakan perbandingan paling sederhana unsur-unsur dalam senyawa, contoh: HO, CH 2 O 2, dsb Sebagian besar senyawa molekular terdiri dari nonlogam. 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 12

Ion dan Senyawa Ionik • Ion: atom atau kumpulan atom yang bermuatan listrik (+/-). • Ion + : kation, ion - : anion • Muatan ion dapat diprediksi dengan tabel periodik. • Senyawa ionik: kombinasi logam dan nonlogam, contoh: Ba. Cl 2, Al 2 O 3 • Senyawa molekular : kombinasi antar unsur nonlogam 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 13

Tata Nama Senyawa Anorganik • Penamaan Senyawa Ion Fkation logam: ion + nama unsur, contoh: Na+ ion natrium Fjika logam dapat membentuk kation dengan muatan berbeda, muatan dinyatakan dengan angka Romawi dalam kurung, contoh: Fe 2+ ion besi (II) Fkation nonlogam: nama kation dengan akhiran –ium, contoh: H 3 O+ ion hidronium 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 14

Fanion: ion monoatomik dinamai dengan menambahkan - akhiran –ida pada nama unsur tersebut, contoh: H- ion hidrida, O 2 - ion oksida Fbeberapa ion poliatomik sederhana juga memiliki akhiran –ida , contoh: OH- ion hidroksida, CN- ion sianida, O 22 - ion peroksida Foksianion (anion poliatomik yang mengandung oksigen) dinamai dengan menambahkan akhiran –at atau –it , contoh: NO 3 - nitrat, NO 2 - nitrit, SO 42 - sulfat, SO 32 sulfit FCl. O 4 - perklorat, Cl. O 3 - klorat, Cl. O 2 - ion klorit, Cl. O hipoklorit F anion yang diturunkan dengan menambahkan H+ pada oksianion, dinamai dengan memberikan hidrogen atau dihidrogen sebagai awalan, contoh: CO 32 - ion karbonat, H 2 PO 4 - ion dihidrogen fosfat 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 15

Senyawa Ion • Tata nama senyawa ion adalah nama kation diikuti dengan nama anion, contoh: ? Ba. Br 2 barium bromida ? Cu(Cl. O 4)2 tembaga (II) perklorat ? Li 3 PO 4 ? ? Zn. HPO 4 ? ? (NH 4)2 Cr 2 O 7 ? ? Sn. I 2 ? ? Co. Br 2 ? 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 16

Tata Nama Asam • Asam yang berdasarkan anion yang berakhiran –ida dinamai dengan menambahkan kata asam di depan nama anion, contoh: HCl asam klorida, H 2 S asam sulfida • Asam yang berdasarkan anion yang berakhiran –at atau –it dinamai dengan menambahkan kata asam di depan nama anion, contoh: HNO 3 asam nitrat 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 17

Tata Nama Senyawa Biner • Nama unsur yang terletak lebih • • • ke kanan pada tabel periodik biasanya ditulis lebih dulu. Jika kedua unsur berada dalam satu golongan, yang terletak lebih bawah ditulis lebih dulu. Unsur yang kedua diberi akhiran –ida. Awalan Yunani digunakan untuk menyebutkan jumlah atom tiap unsur. Contoh: NF 3 nitrogen trifluorida, P 4 S 10 tetrafosfor dekasulfida 11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 18

11/10/2020 Kimia Dasar (Eva/Zulfah/Yasser) 19
 Molekul senyawa adalah
Molekul senyawa adalah Peta konsep hukum dasar kimia
Peta konsep hukum dasar kimia Hibridisasi atom c pada molekul hcoh adalah
Hibridisasi atom c pada molekul hcoh adalah Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Uniones intramoleculares
Uniones intramoleculares Induced dipole induced dipole interaction
Induced dipole induced dipole interaction Laporan pengukuran dan ketidakpastian
Laporan pengukuran dan ketidakpastian Dasar dasar dan perlakuan adil di tempat kerja
Dasar dasar dan perlakuan adil di tempat kerja Konsep dasar unit pemrosesan dan dasar datapath
Konsep dasar unit pemrosesan dan dasar datapath Organisasi datapath
Organisasi datapath Formula?
Formula? Atom molecule and ion
Atom molecule and ion Atom ion
Atom ion The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Perkembangan model atom
Perkembangan model atom Ikatan kovalen
Ikatan kovalen Struktur geometri if2
Struktur geometri if2 Fonem adalah
Fonem adalah Perkembangan konsepsi bk
Perkembangan konsepsi bk