AST VE BAZ TANIMLARI ARHENUS AST BAZ TANIMI


ASİT VE BAZ TANIMLARI ARHENİUS ASİT BAZ TANIMI: • Asitler, sulu çözeltilerine hidrojen iyonu ( H), bazlar ise hidroksit iyonu ( OH-) verebilen maddelerdir.

• Bu tanıma göre H 2 SO 4, HCl, HNO 3, HBr, HI gibi maddeler asit, Na. OH, KOH, Ba(OH)2 gibi maddeler de bazdır. • HCl ( g ) → H+( suda ) + Cl-(suda) • Na. OH(k)→Na+(suda ) + OH-( suda ) • H 2 SO 4 → 2 H+(suda)+SO 4 -2(suda)

Bu maddelerin suda çözünme denklemleri: • HCl ( g ) → H+( suda ) + Cl-(suda) • H 2 SO 4 → 2 H+(suda)+SO 4 -2(suda) • Na. OH(k)→Na+(suda ) + OH-( suda ) • KOH(k) →K +(suda ) + OH-( suda )
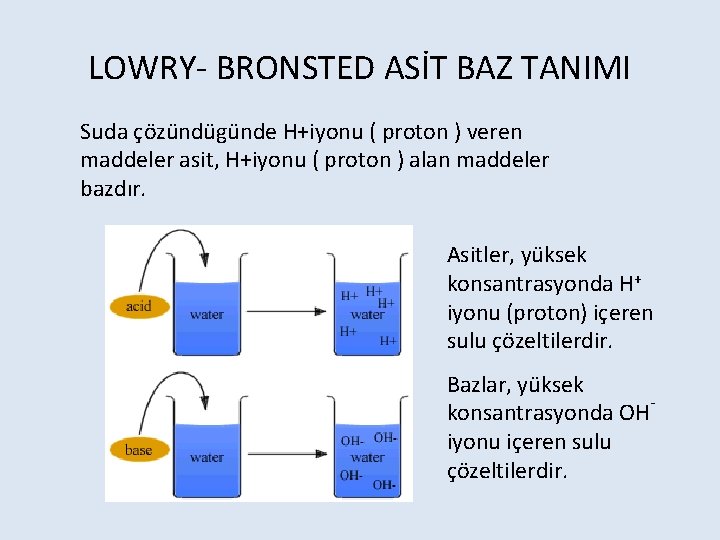
LOWRY- BRONSTED ASİT BAZ TANIMI Suda çözündügünde H+iyonu ( proton ) veren maddeler asit, H+iyonu ( proton ) alan maddeler bazdır. Asitler, yüksek konsantrasyonda H+ iyonu (proton) içeren sulu çözeltilerdir. Bazlar, yüksek konsantrasyonda OH¯ iyonu içeren sulu çözeltilerdir.

Buna göre bir asitin H+ iyonu vermiş hali, tekrar H+ iyonu alabileceği için bazdır. Yine bir bazın OH iyonu vermiş hali, tekrar OH iyonu alabileceği için bir asittir. Bu çifte konjuge asit baz çfti denir.

• NH 3(suda) + H 2 O( s ) → NH 4+(suda)+OH- (suda) baz asit baz Burada NH 3 ile NH 4+ , H 2 O ile OH- konjuge Asit- baz çiftlerini oluştururlar. • Hem asit, hem de baz gibi davranan maddelere amfoter maddeler denir.

LEWİS ASİT BAZ TANIMI • Elektron çifti alabilen maddelere asit, elektron çifti verebilen maddelere baz denir. BF 3 + F- → BF 4 AICI 3 + CI- →AICI 4 BF 3 , AICI 3 gibi maddeler lewis asiti CI- , Fgibi maddeler lewis bazıdır.

ASi. T VE BAZLARIN GENEL ÖZELLİKLERİ ASi. TLER • Sulu çözeltileri elektrik akımını iletir. • Mavi turnusol kağıdının rengini kırmızıya çevirirler. • Tatları ekşidir. ( sirke , limon gibi ) • Mg , Zn , Fe , Al , Na gibi soy olmayan metallere etki ederek bunlaın tuzlarını oluturur ve hidrojen gazını açığa çıkarırlar. • Soy metaller dışındaki metallerle H 2 gazı çıkarırlar.

• Asitler , bazlarla etkileşerek nötrleşme ürünleri olan tuzları oluştururlar. HCl + Na. OH → Na. Cl + H 2 O • Asitler karbonat grubu içeren bileşiklere etki ederek , CO 2 gazı açığa çıkarırlar. Mg. CO 3 + 2 HCl → Mg. Cl 2 + H 2 O + CO 2

BAZLAR: • Sulu çözeltileri elektrik akımını iletir. • Çözeltilerinin tadı acıdır ve elde kayganlık duygusu verir. • Kırmızı turnusol kağıdının rengini maviye dönüştürür. • Asitlerle nötrleşme tepkimesi vererek tuz oluştururlar. • Na. OH + HNO 3 → Na. NO 3 + H 2 O

• Genel olarak metallere etki etmezler. Ancak Al, Zn , Sn , Pb , Cr gibi amfoter metallerle H 2 gazı açığa çıkarırlar. Zn + Na. OH → Na 2 Zn. O 2 + H 2 2 Al+ 6 Na. OH → 2 Na 3 Al. O 3 + 3 H 2

ASİT VE BAZLARIN KUVVETİ

KUVVETLİ ASİTLER Asidin kuvveti, asidin suda iyonlaşabilme derecesi ile ilişkilidir. Bazı asitler sulu çözeltilerinde % 100 iyonlaşırlar. Bu tür asitlere kuvvetli asit denir. HCl , HBr , HNO 3 , HCl. O , H 2 SO 4 gibi.

• Aynı elementin oksi asitlerinde oksijen sayısı arttıkça, H+ iyonunun verilmesi kolaylaşır. Dolaysıyla asitlik kuvveti artar. • Periyodik cetvelde aynı periyotta bulunan elementlerin asitleri ( HX türündeki asitlerde ) X elementinin elektronegatifliği arttıkça asidin kuvveti artar. • CH 4 < NH 3 < H 2 O < HF

Aynı grup elementlerinde, grupta aşağı elementin atom çapının artışı ile asidin kuvveti artar. HF HCl HBr HI Asit kuvveti artar.

ZAYIF ASi. TLER Bazı asitler ise sulu çözeltilerinde çok az oranda iyonlaşırlar. Bu tür asitlere zayıf asit denir. CH 3 COOH , HF , H 2 CO 3 , HCN. . .

Kuvvetli bazlar Sulu çözeltilerinde % 100 iyonlaşan bazlara kuvvetli baz denir. 1 A grubunun hidroksitleri ( Li. OH , Na. OH KOH , Rb. O, Cs. OH ) , 2 A grubunun hidroksitleri Sr ( OH)2 , Ba(OH)2 Kuvvetli bazlardır.

ZAYIF BAZLAR Sulu çözeltilerinde çok az oranda iyonlaşan bazlara zayıf baz denir. NH 3 bir zayıf baz örneğidir. NH 3(g)+H 2 O(s)→NH 4+(suda) +OH(suda)

Tamponlar Zayıf bir asit (proton donörü) ve onun konjuge bazını (proton akseptörü) eşit miktarlarda içeren karışımlar tampon sistemi olarak bilinirler.
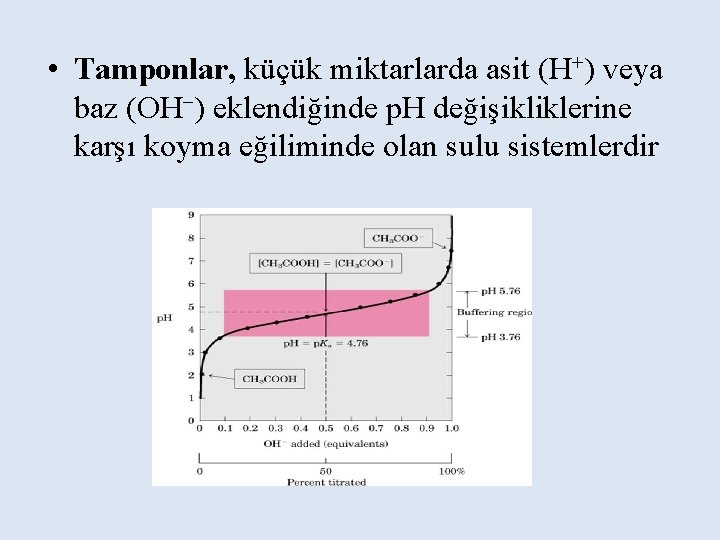
• Tamponlar, küçük miktarlarda asit (H+) veya baz (OH ) eklendiğinde p. H değişikliklerine karşı koyma eğiliminde olan sulu sistemlerdir

Sulu çözeltide ortamın H+ iyonu konsantrasyonuna (p. H’ına) göre renk değiştiren maddeler indikatör olarak tanımlanırlar. İndikatörler, titrasyonlarda sık kullanılırlar
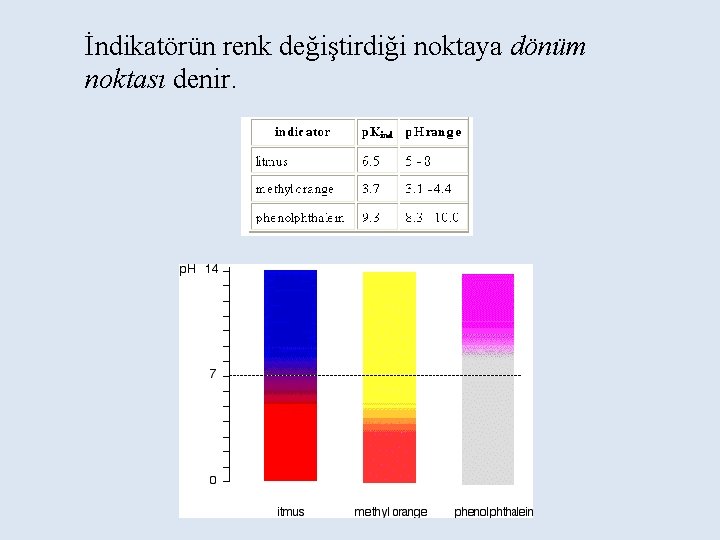
İndikatörün renk değiştirdiği noktaya dönüm noktası denir.

Sulu çözeltilerin p. H’ı, elektrometrik yöntemler denen, iki elektrot arasındaki potansiyel farkının bir galvanometre ile ölçülmesi esasına dayanan yöntemlerle daha hassas olarak ölçülebilir. p. H metre denen aletlerde elektrottan çıkan sinyal, şiddetlendirilir ve p. H’ı bilinen bir çözelti tarafından oluşturulan sinyal ile karşılaştırılır.
- Slides: 24