Anorganische Reaktionsmechanismen in Lsungen Konturkarte der Energieflchen des






























- Slides: 33

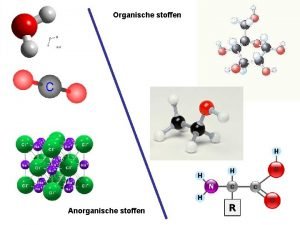
Anorganische Reaktionsmechanismen in Lösungen Konturkarte der Energieflächen des linearen H + H 2 = H 2 + H Systems

Literatur • James H. Espenson: Chemical Kinetics and Reaction Mechanisms; Mc. Graw -Hill, Inc. , New York (1995) • Ralph G. Wilkins: Kinetics and mechanisms of reactions of transition metal complexes; 2. Auflage. VCH Verlagsgesellschaft, Weinheim, New York (1991) Das Studium von Reaktionsmechanismen - ermöglicht das Design von Synthesewegen zu neuen Verbindungen - ermöglicht die Entwicklung optimaler Katalysatoren

Reaktionen von Komplexverbindungen können extrem schnell oder sehr langsam sein In einer Femtosekunde legt das Licht eine Strecke von 0, 3 µm zurück.

Inhalte v. Temperaturabhängigkeit der Geschwindigkeitskonstante v. Zusammengesetzte Geschwindigkeitskonstanten v. Druckabhängigkeit der Geschwindigkeitskonstante, Aktivierungsvolumen v. Chemische Interpretation der Aktivierungsparameter v. Theorie des Übergangszustandes v. Energiediagramme v. Prinzip der mikroskopischen Reversibilität v. Spezielle Eigenschaften der Reaktionen in einem Lösungsmittel v. Diffusionskontrollierte Geschwindigkeitskonstanten v. Kinetik von Ionenreaktionen: a) Einfluss der Dielektrizitätskonstante des Lösungsmittels b) Einfluss gelöster Salze v. Kinetische Isotopie-Effekte v. Kinetik des Isotopenaustauschs

v Elektronenübertragungsprozesse a) Reaktionen des solvatisierten Elektrons b) Redoxreaktionen, die in der äußeren Sphäre ablaufen c) Franck-Kondon Prinzip d) Marcus-Gleichung e) c) Redoxreaktionen, die in der inneren Sphäre ablaufen f) outer-sphere oder inner-sphere Mechanismus? g) verschiedene Brückenmechanismen 5 NH 3 h) d) nicht-komplementäre Redoxreaktionen i) e) photochemische Redoxreaktionen

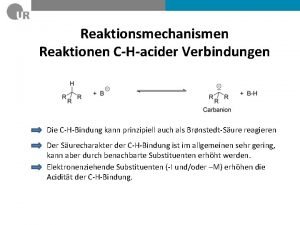
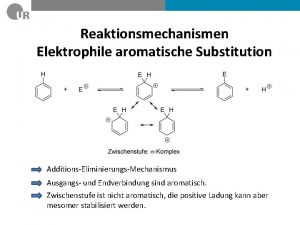
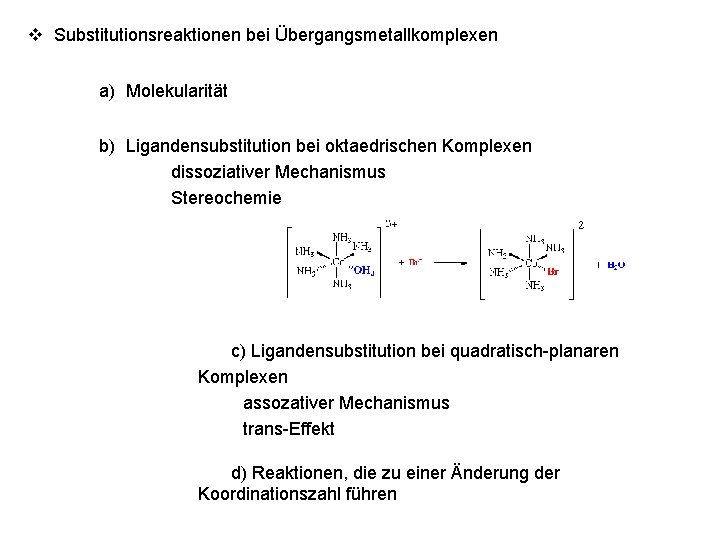
v Substitutionsreaktionen bei Übergangsmetallkomplexen a) Molekularität b) Ligandensubstitution bei oktaedrischen Komplexen dissoziativer Mechanismus Stereochemie c) Ligandensubstitution bei quadratisch-planaren Komplexen assozativer Mechanismus trans-Effekt d) Reaktionen, die zu einer Änderung der Koordinationszahl führen

v. Kettenreaktionen v. Oszillierende Reaktionen Belousov-Zhabotinsky-Reaktion, Axel Schunk, 1998

Ein Reaktionsmechanismus beschreibt die aufeinanderfolgenden molekularen Vorgänge während einer chemischen Reaktion von den Reagenzien bis zu den Produkten. Er zeigt, ob eine gegebene chemische Reaktion als einzelner molekularer Prozess abläuft – als Elementarreaktion – oder als Aufeinanderfolge mehrerer Elementarreaktionen, und ob es dann nur einen einzigen Reaktionsweg gibt, oder mehrere im Wettbewerb befindliche Reaktionsfolgen vorliegen. Wenn mehrere Reaktionsschritte (=Elementarreaktionen) hintereinander stattfinden, treten in allen Fällen kurzlebige Zwischenverbindungen auf.

Man bemüht sich, Struktur und Zusammensetzung jeder vermuteten Zwischenverbindungen zu bestimmen. Eventuell durch sehr schnelle spektroskopische Techniken. In manchen Fällen gelingt es, ein Reagenz zu finden, das mit der kurzlebigen Zwischenverbindung zu einem stabilen Produkt reagiert (“chemical trapping“). Struktur und Zusammensetzung des „gefangenen“ Produkts lassen dann auf die Eigenschaften der Zwischenverbindung schließen. Eine weitere Möglichkeit, die Zwischenverbindung zu stabilisieren, ist “freeze trapping“.

– „freeze trapping“ wird z. B. kombiniert mit Röntgenstrukturanalyse, Elektronenmikroskopie und solidstate NMR um die Zwischenverbindungen zu charakterisieren

• An der experimentellen und theoretischen Erforschung von Reaktionsgeschwindigkeiten und Reaktionsmechanismen gewisser Typen von Reaktionen wird seit Jahrzehnten intensiv geforscht, die Erkenntnisse werden immer detaillierter. Besonders betrifft das: • Elektronentransfer-Reaktionen • Nucleophile Substitutionen, besonders Hydrolysereaktionen

Theoretische Modelle wurden entwickelt, die Reaktionsgeschwindigkeiten von Elementarreaktionen erklären oder sogar voraussagen können. Die Grundlage für diese theoretischen Modelle bildet die Abhängigkeit der Geschwindigkeitskonstante von Temperatur und Druck. Aus dieser experimentell zu bestimmenden Abhängigkeit lässt sich auf die Aktivierungsparameter schließen: Aktivierungsenthalpie, Aktivierungsentropie und Aktivierungsvolumen. Die Aktivierungsparameter lassen Schlüsse auf den Reaktionsmechanismus zu.


• Aktivierungsenergie Ea = Energie des aktivierten Zustands minus mittlere Energie der reagierenden Moleküle. • Ea ist daher immer >0

H 2 + I 2 = 2 HI Max Bodenstein (1871 -1942) „Begründer chemischen Kinetik“

Deutung der Arrhenius-Gleichung für eine bimolekulare Reaktion Nicht alle Zusammenstöße führen zur Reaktion, sondern nur die Zusammenstöße besonders energiereicher Moleküle. Der Bruchteil jener Molekül-Zusammenstöße, bei denen die gesamte Stoßenergie Ea übersteigt, ist gleich (=Boltzmann‘scher Faktor), daher gilt wobei der Wert der Geschwindigkeitskonstante wäre, wenn keine Aktivierungsenergie nötig wäre.

Deutung der Arrhenius-Gleichung ändert sich nur wenig mit der Temperatur und kann (über weniger ausgedehnte Temperaturbereiche) näherungsweise als konstant angesehen werden. Die bekannte Erhöhung der Reaktionsgeschwindigkeit mit steigender Temperatur beruht also hauptsächlich auf einer Zunahme des Anteils energiereicher Moleküle und nur untergeordnet auf einer Zunahme der Stoßzahl. Bei einer Änderung der Reaktionstemperatur ändert sich die Durchschnitts-Energie der reagierenden Stoffe. Zur gleichen Zeit ändert sich auch die Maxwell-Boltzmann‘sche Energieverteilung der Moleküle.

Im Faktor ist berücksichtigt, dass die zum Übergangszustand zusammentretenden Moleküle keine mathematischen Punkte sind, sondern räumliche Ausdehnung und Form besitzen, sodass nur Stöße mit geeigneter räumlicher Anordnung zum Erfolg führen können (=sterischer Faktor).

Theorie des Übergangszustandes= Transition State Theory TST Von Henry Eyring (1901 -1981), Weiterentwicklung der Arrhenius-Theorie auf Basis der Statistischen Thermodynamik. Die Edukte sind von den Produkten durch einen Potentialwall (Aktivierungsbarriere) getrennt, der einen Sattelpunkt auf der Potentialhyperfläche darstellt. Die Reaktion der Edukte über den Übergangszustand zu den Produkten verläuft entlang einer Reaktionskoordinate = Weg zwischen den Edukten und Produkten mit jeweils minimaler Änderung der potentiellen Energie. Der aktivierte Komplex liegt auf dem Sattelpunkt.

• Eyring machte durch die Einführung der Reaktionskoordinate einen sehr wichtigen neuen Beitrag. • Eine weitere wichtige neue Annahme war, dass der aktivierte Komplex mit den reagierenden Molekülen in einem „Quasi-Gleichgewicht“ steht.

Foto: Kauzmann Eyring, H. , "The Activated Complex in Chemical Reactions, " J. Chem. Phys. , 1935, 3, 107 -115.

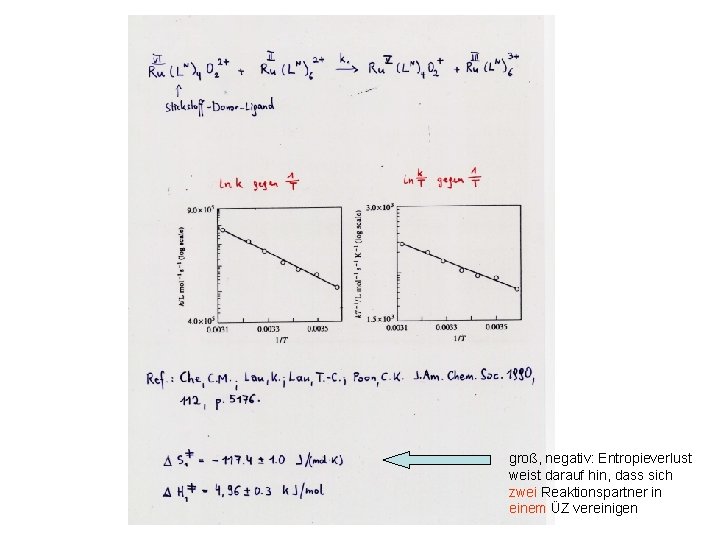
groß, negativ: Entropieverlust weist darauf hin, dass sich zwei Reaktionspartner in einem ÜZ vereinigen

Nur wahre Geschwindigkeitskonstanten, also solche, die keine unerkannten, ungeklärten Konzentrationsabhängigkeiten enthalten, können mit dem Arrhenius- oder TST Modell behandelt werden! Probleme bei der Deutung der Reaktionsgeschwindigkeits-Messwerte können dann auftreten, wenn die untersuchte Reaktion keine Elementarreaktion ist.

Zusammengesetzte Geschwindigkeitskonstanten Falls die Reaktion aus mehreren Elementarreaktionen zusammengesetzt ist, ergibt sich die Geschwindigkeitskonstante in vielen Fällen aus den Geschwindigkeitskonstanten der Elementarreaktionen und den Gleichgewichtskonstanten vorgelagerter, sich sehr rasch einstellender „Gleichgewichte“.

Beispiel 1 zusammengesetzte Geschwindigkeitskonstante

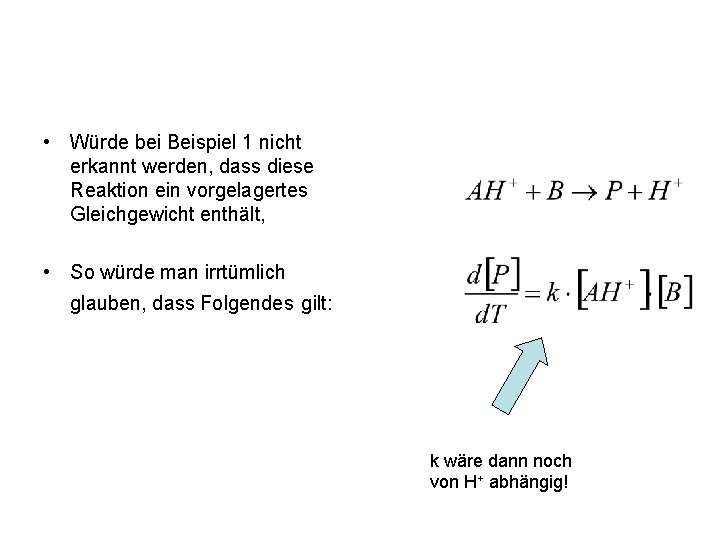
• Würde bei Beispiel 1 nicht erkannt werden, dass diese Reaktion ein vorgelagertes Gleichgewicht enthält, • So würde man irrtümlich glauben, dass Folgendes gilt: k wäre dann noch von H+ abhängig!

Wie seht das Temperaturprofil der zusammengesetzten Geschwindigkeitskonstante aus? sind temperaturunabhängig!

Beispiel 1 Temperaturprofil: lineares Temperaturprofil ln(k/T) gegen (1/T) Kennt man so kann man die Werte für die Aktivierungsenthalpie und Aktivierungsentropie aus der Steigung und dem Ordinatenabschnitt erhalten.

• In diesem Fall mit vorgelagertem Gleichgewicht kann es passieren, dass negativ ist mit einem Absolutbetrag größer als • Dann ist eine negative Zahl! Das bedeutet, die Reaktionsgeschwindigkeit würde paradoxerweise mit steigender Temperatur sinken (falls dieser Effekt den Faktor T überwiegt).

Beispiel 2 Die intermediäre Verbindung I bildet sich in einem vorgelagerten Gleichgewicht

Beispiel 2 zusammengesetzte Geschwindigkeitskonstante:

Beispiel 2 Temperaturprofil lineares Temperaturprofil

 Autotrofe organismen voorbeelden
Autotrofe organismen voorbeelden 17 kamele
17 kamele Lsungen
Lsungen Des des des
Des des des Vincent willem van gogh
Vincent willem van gogh Weg der atemluft durch den körper
Weg der atemluft durch den körper Weltuntergangstheorie
Weltuntergangstheorie Wer ist der gründer der modernen türkei
Wer ist der gründer der modernen türkei Die geschichte vom skorpion und dem frosch
Die geschichte vom skorpion und dem frosch Burgen aufbau
Burgen aufbau Der gott der stadt heym
Der gott der stadt heym Der gegenstand der psychologie
Der gegenstand der psychologie Erste tag der woche
Erste tag der woche Der seele heimat ist der sinn
Der seele heimat ist der sinn Der daumen pflückt die pflaumen
Der daumen pflückt die pflaumen Der zug des lebens geschichte
Der zug des lebens geschichte Ostia antica gedicht
Ostia antica gedicht Das scheitern der weimarer republik
Das scheitern der weimarer republik Zug des lebens text
Zug des lebens text Direktion der justiz und des innern kanton zürich
Direktion der justiz und des innern kanton zürich Alle sind mitreisende im zug des lebens
Alle sind mitreisende im zug des lebens Hol ordentlich schwung auf der schaukel des lebens
Hol ordentlich schwung auf der schaukel des lebens Lauer wind
Lauer wind Alle sind mitreisende im zug des lebens
Alle sind mitreisende im zug des lebens Wie fragt man nach der adverbialen bestimmung des ortes
Wie fragt man nach der adverbialen bestimmung des ortes Der weg des pfeffersacks
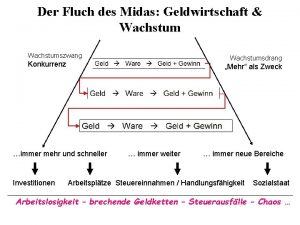
Der weg des pfeffersacks Der fluch des midas
Der fluch des midas Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Modes verbaux et leurs valeurs
Modes verbaux et leurs valeurs Volume d un corps
Volume d un corps Robin des bois des alpes
Robin des bois des alpes Mesure de niveaux pour liquides et solides
Mesure de niveaux pour liquides et solides Triple des meet in the middle attack
Triple des meet in the middle attack La diffusion des idées des lumières
La diffusion des idées des lumières