ANORGANICK CHEMIE Vodk kyslk peroxid vodku a voda















- Slides: 24

ANORGANICKÁ CHEMIE Vodík, kyslík, peroxid vodíku a voda Věda zabývající se prvky a jejich sloučeninami (kromě většiny sloučenin uhlíku). Tradiční dělení prvků: kovy, polokovy a nekovy 1

září říjen Vodík Kyslík Peroxid vodíku Voda 18. Skupina (Vzácné plyny) 17. Skupina (Halogeny) 16. skup. chalkogeny (S, SO 2, SO 3, H 2 SO 4, H 2 S) 15. Skupina (N, P) 14. Skupina (uhlík, křemík, Ge, Sn, Pb) 13. Skupina (Bor, hliník) prosinec 2. Skupina (Be, Mg, Ca, SR, Ba, Ra) 1. Skupina (alkalické kovy) leden listopad 2

Nejrozšířenější prvky na zemi: kyslík, křemík, hliník, železo, vápník, sodík, draslík, hořčík, vodík, titan. 3

Symbol: H Mezinárodní název: hydrogenium Elektronegativita (X): 2, 2 Atomová relativní hmotnost (Ar): 1, 008 Počet valenčních elektronů: 1 Elektronová konfigurace: 1 s 1 Izotopy: 1. 1 H (P): 1 p, 1 e, 0 n 2. 2 H (D): 1 p, 1 e, 1 n 3. 3 H (T): 1 p, 1 e, 2 n výskyt: a) volný: Vodík Nejrozšířenější prvek ve vesmíru, ve vyšších vrstvách atmosféry b) vázaný: Většina sloučenin, základní biogenní prvek příprava (v laboratoři): Redukce kyselin kovy v Kippově přístroji Zn + 2 HCl → Zn. Cl 2 + H 2 Zn + H 2 SO 4 → Zn. SO 4 + H 2 4

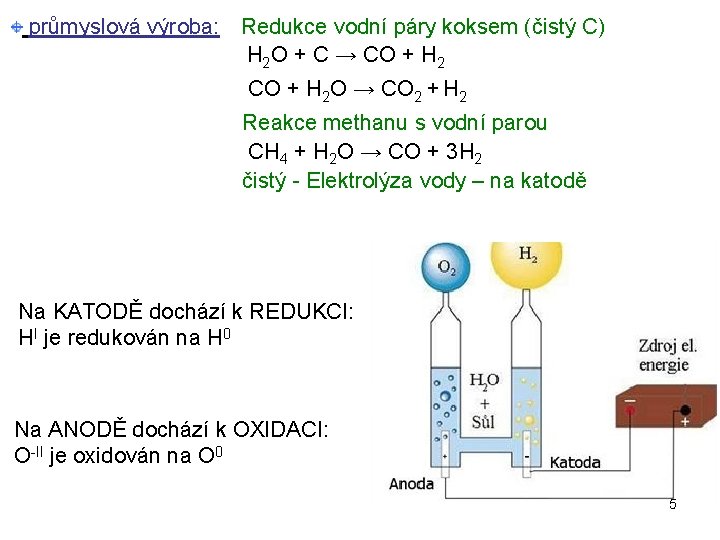
průmyslová výroba: Redukce vodní páry koksem (čistý C) H 2 O + C → CO + H 2 O → CO 2 + H 2 Reakce methanu s vodní parou CH 4 + H 2 O → CO + 3 H 2 čistý - Elektrolýza vody – na katodě Na KATODĚ dochází k REDUKCI: HI je redukován na H 0 Na ANODĚ dochází k OXIDACI: O-II je oxidován na O 0 5

vlastnosti: Bezbarvý plyn, bez chuti a zápachu. Tvoří dvouatomové molekuly (H 2). Ve vodě nepatrně rozpustný Lehčí než vzduch, se vzduchem tvoří výbušnou směs. Hořlavý (2 H 2 + O 2 → 2 H 2 O), ale hoření nepodporuje. Snadno zkapalnitelný. Přechovává se v ocelových lahvích (označené červeným pruhem). Významné redukční činidlo (příprava kovů - metalurgie) Např. Cu. O + + H 2 → Cu + H 2 O sloučeniny: voda, hydridy, hydroxidy, kyseliny, všechny org. sloučeniny 6

užití: • Chemický průmysl: Výroba HCl, NH 3, HNO 3… • Potravinářský průmysl: Hydrogenace (ztužování tuků) • Zdroj energie: raketové palivo • Řezání a sváření kovů (autogeny) – (hoření vodíku s kyslíkem je silně exotermní a vyvíjí teploty přes 3 000 °C). 7

• Hydridy – viz sešit 8

Kyslík Symbol: Mezinárodní název: Elektronegativita (X): Atomová relativní hmotnost (Ar): Počet valenčních elektronů: Elektronová konfigurace: Izotopy: 1. 16 O (99, 76%): 2. 17 O (0, 04%): 3. 18 O (0, 2%): chalkogen 8 p, 8 e, 8 n 8 p, 8 e, 9 n 8 p, 8 e, 10 n Po F nejelektronegativnější prvek, velmi reaktivní výskyt: Nejrozšířenější prvek na Zemi, vzduch (21%), voda, v litosféře, biogenní prvek Výskyt ve dvou modifikacích: O 2 (dikyslik) a O 3 (ozon) 9

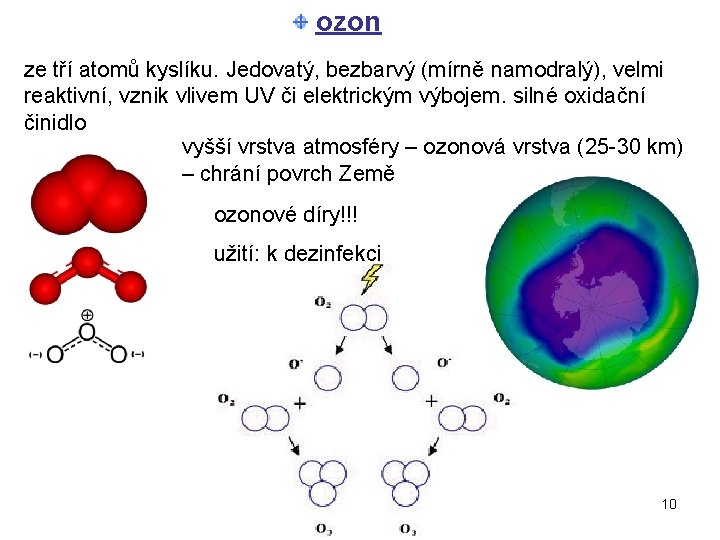
ozon ze tří atomů kyslíku. Jedovatý, bezbarvý (mírně namodralý), velmi reaktivní, vznik vlivem UV či elektrickým výbojem. silné oxidační činidlo vyšší vrstva atmosféry – ozonová vrstva (25 -30 km) – chrání povrch Země ozonové díry!!! užití: k dezinfekci 10

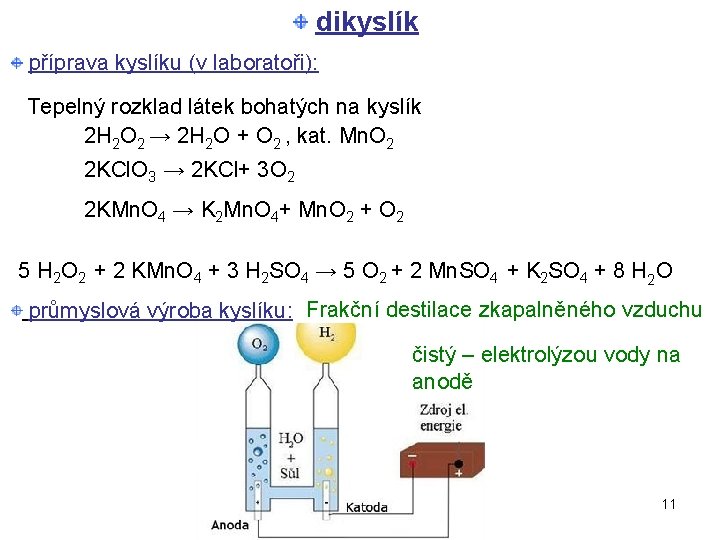
dikyslík příprava kyslíku (v laboratoři): Tepelný rozklad látek bohatých na kyslík 2 H 2 O 2 → 2 H 2 O + O 2 , kat. Mn. O 2 2 KCl. O 3 → 2 KCl+ 3 O 2 2 KMn. O 4 → K 2 Mn. O 4+ Mn. O 2 + O 2 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 → 5 O 2 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O průmyslová výroba kyslíku: Frakční destilace zkapalněného vzduchu čistý – elektrolýzou vody na anodě 11

vlastnosti: Bezbarvý plyn, bez chuti a zápachu, Těžší než vzduch. Bezbarvý plyn, bez chuti a zápachu. Nehořlavý, ale hoření podporuje. Přechovává se v ocelových lahvích (označené modrým pruhem). Silné oxidační činidlo (koroze, dýchání, hoření. . . ) sloučeniny: oxidy, peroxidy, voda, hydroxidy, kyslíkaté kyseliny a jejich soli, org. sloučeniny (kyslíkaté deriváty uhlovodíků) užití: dýchací přístroje, autogen, lékařství, výroba kovů (oxidační činidlo), kapalný kyslík – raketová technika (pohon) 12

oxidy S elektropozitivnějšími prvky než je kyslík a) kyselé b) bazické Od nekovů (CO 2, SO 2) Od kovů s vyšším oxid. číslem (Cr. O 3) S vodou reagují za vzniku kyslíkatých kyselin S elektropozitivnějšími prvky (Na 2 O) S vodou reagují za vzniku hydroxidů c) amfotermní Zn. O, Al 2 O 3 Reagují s kyselinami i zásadami za vzniku solí Al 2 O 3+ 6 HCl Al 2 Cl 6 + 3 H 2 O Al 2 O 3 +2 Na. OH+6 H 2 O 2 Na[Al(OH)4] +3 H 2 d) neutrální NO, CO Nereagují s kyselinami ani se zásadami 13

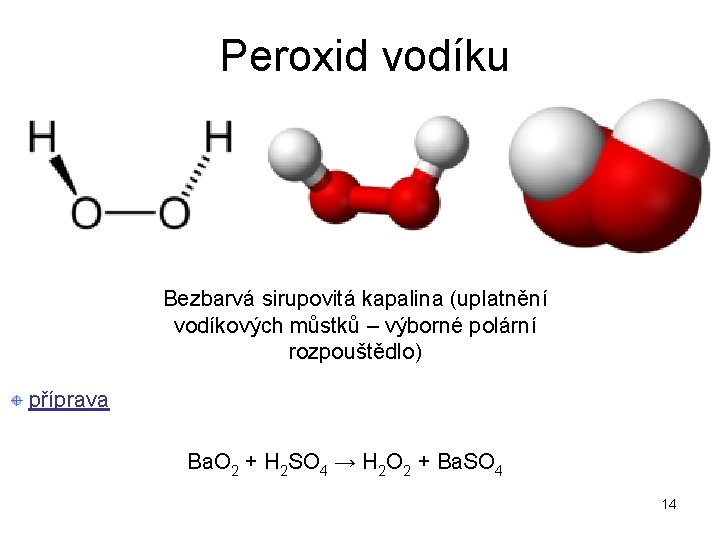
Peroxid vodíku Bezbarvá sirupovitá kapalina (uplatnění vodíkových můstků – výborné polární rozpouštědlo) příprava Ba. O 2 + H 2 SO 4 → H 2 O 2 + Ba. SO 4 14

chemické vlastnosti a) Oxidační činidlo 2 I- + H 2 O 2 + H 3 O+ → I 2 + 4 H 2 O S 2 - + 4 H 2 O 2 → SO 42 - + 4 H 2 O a) Redukční činidlo (se silnými oxidačními činidly) Ag 2 O + H 2 O 2→ 2 Ag + H 2 O + O 2 5 H 2 O 2 + 2 Mn. O 4 - + 6 H+ → 5 O 2 + 2 Mn 2+ + 8 H 2 O (jedna z výrob kyslíku) 5 H 2 O 2 + 2 KMn. O 4 + 3 H 2 SO 4 → 5 O 2 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O a) Charakter slabé dvojsytné kyseliny Dva typy solí: hydrogenperoxidy a peroxidy (jedná se o iontové slouč. ) 15

užití H 2 O 2 → H 2 O + O dezinfekce 16

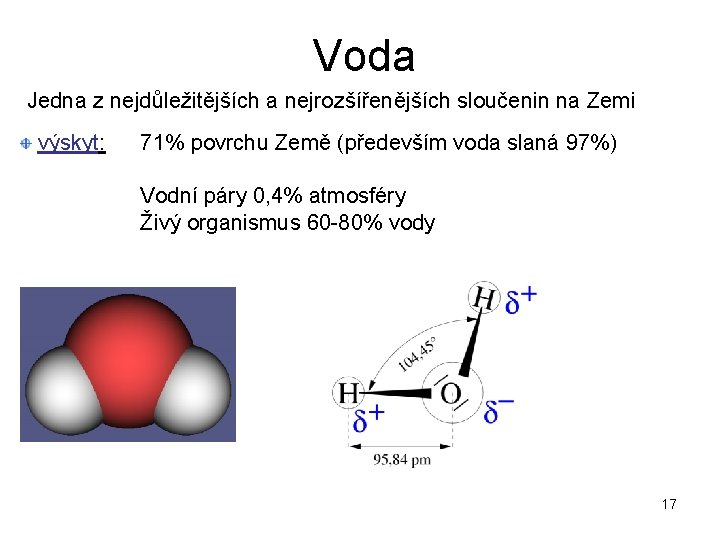
Voda Jedna z nejdůležitějších a nejrozšířenějších sloučenin na Zemi výskyt: 71% povrchu Země (především voda slaná 97%) Vodní páry 0, 4% atmosféry Živý organismus 60 -80% vody 17

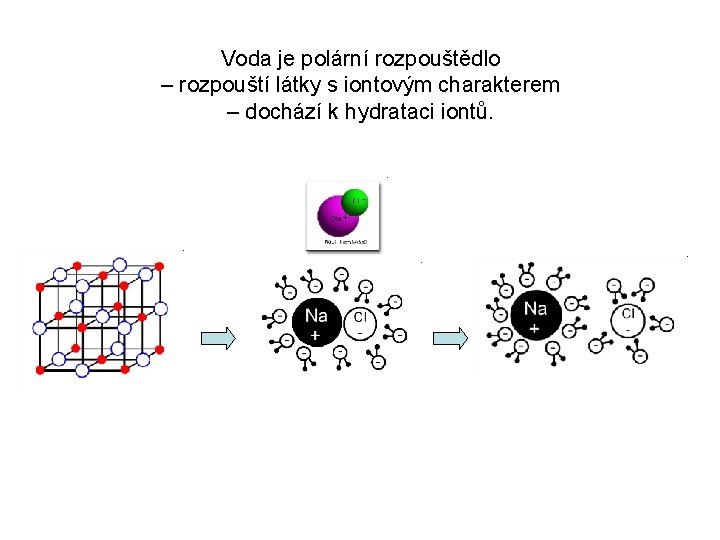
Voda je polární rozpouštědlo – rozpouští látky s iontovým charakterem – dochází k hydrataci iontů.

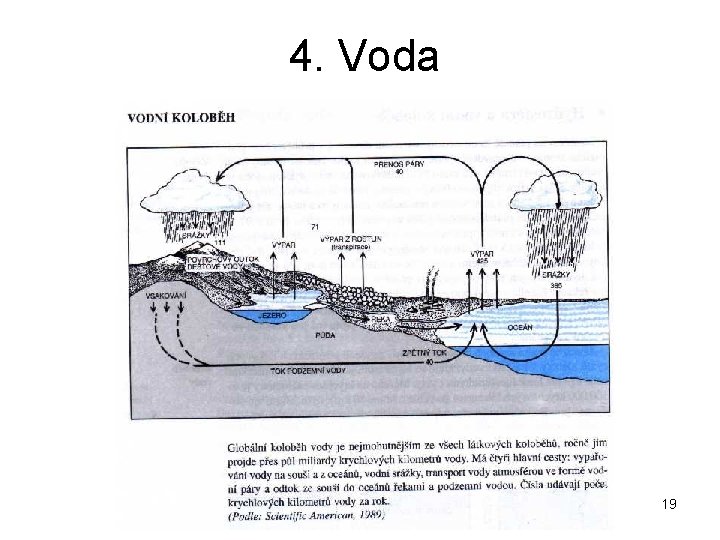
4. Voda 19

Chemicky čistá voda se na Zemi nevyskytuje (nejčistší je Led či sníh) Přírodní zdroje vody: podle hydrologie a meteorologie: a) povrchová (slaná a sladká) - voda všech vodních povrchových zdrojů b) podzemní - nachází se pod zemským povrchem c) ve formě srážek Tvrdost vody Veličina nejčastěji udávající koncentraci Ca 2+, Mg 2+ ve vodě a) přechodná tu způsobují rozpustné hydrogenuhličitany (především Ca(HCO 3)2 a Mg(HCO 3)2 ); tuto tvrdost vody lze odstranit převařením: Celková tvrdost vody Ca(HCO 3)2 → Ca. CO 3 + H 2 O + CO 2 Mg(HCO 3)2 → Mg. CO 3 + H 2 O + CO 2. b) trvalá tu způsobují především sírany (Ca. SO 4 a Mg. SO 4); tuto tvrdost vody nelze odstranit převařením. 20

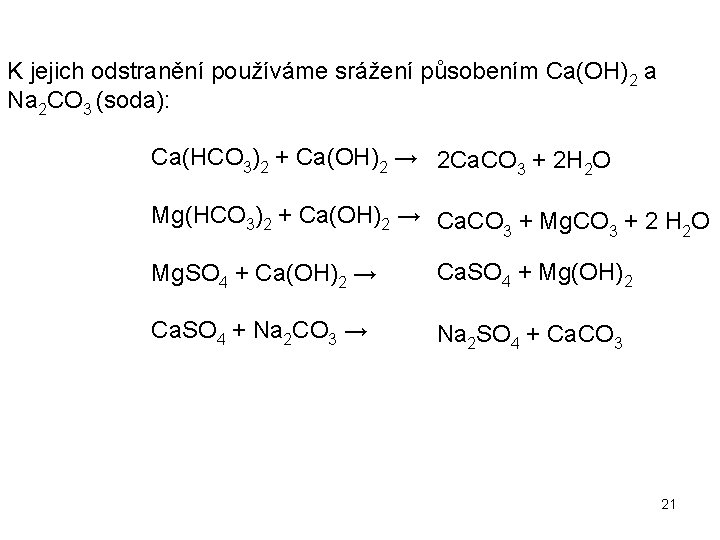
K jejich odstranění používáme srážení působením Ca(OH)2 a Na 2 CO 3 (soda): Ca(HCO 3)2 + Ca(OH)2 → 2 Ca. CO 3 + 2 H 2 O Mg(HCO 3)2 + Ca(OH)2 → Ca. CO + Mg. CO + 2 H O 3 3 2 Mg. SO 4 + Ca(OH)2 → Ca. SO 4 + Mg(OH)2 Ca. SO 4 + Na 2 CO 3 → Na 2 SO 4 + Ca. CO 3 21

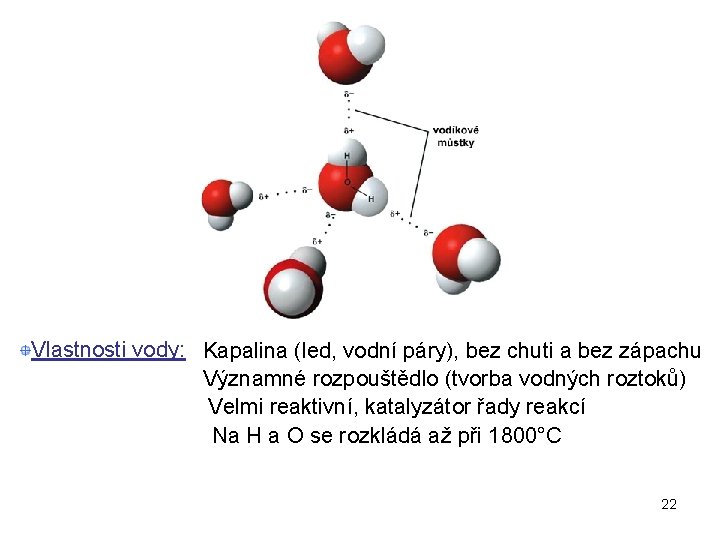
Vlastnosti vody: Kapalina (led, vodní páry), bez chuti a bez zápachu Významné rozpouštědlo (tvorba vodných roztoků) Velmi reaktivní, katalyzátor řady reakcí Na H a O se rozkládá až při 1800°C 22

23

Druhy vody + užití: 1. Pitná Čirá, bez zápachu, příjemné chuti, nesmí obsahovat dusičnany, amonné soli a choroboplodné zárodky 2. Destilovaná Odpařením vody a následnou kondenzací vodní páry. Neutrální bez chuti a bez zápachu. Užití: laboratoře, chladiče, žehličky, akumulátory, lékařství… 3. Minerální Obsahuje větší množství rozpuštěných solí a plynů (CO 2). Stolní, léčivá 4. Užitková Podpovrchová, sladká voda Užití: mytí, praní, čištění… 5. Odpadní Vzniká činností člověka 24