Anorganick chemie Systematick st V systematick sti naleznete
















- Slides: 17

Anorganická chemie Systematická část V systematické části naleznete u každé přednášky přehled demonstračních pokusů, které jste na přednáškách viděli. Obsah přednášky pak naleznete v kterékoliv základní učebnici anorganické chemie pro vysoké školy. Informace obecného charakteru naleznete jednak hned u první přednášky „Vodík a kyslík“, kde se seznámíte s různými teoriemi kyselin a zásad a také s oxidací a redukcí. Úvodu do chemie přechodných prvků se základy koordinační chemie a teorie ligandového pole je věnována samostatná (předposlední) přednáška.

Vodík a kyslík Teorie kyselin a zásad – Arrheniova teorie – Brönstedtova teorie (p. H, iontový součin vody) – Kyseliny a zásady v nevodných prostředích (NH 3, SO 2) – Kyseliny a zásady v roztavených oxosolích (Luxova teorie) – Obecná Lewisova teorie kyselin a zásad

Oxidace a redukce Název slova „oxidace“ je původně odvozen od latinského názvu kyslíku (Oxygenium) a byly jím označovány slučovací reakce s kyslíkem. Dnes má pojem oxidace a redukce daleko obecnější význam, přičemž oxidací je míněno zvyšování kladného oxidačního čísla (mocenství), tedy proces odevzdání elektronů a redukcí pak snižování kladného oxidačního čísla (mocenství), tedy proces přijímání elektronů. Kvantifikovat oxidační a redukční schopnosti atomů (iontů, molekul) pak můžeme na základě tzv. „oxidačně redukčního potenciálu“, definovaného následujícím výrazem (Nernstovou rovnicí ): RT ared E = Eº – ln z. F aox

kde: E Eº R T z F aox ared je příslušný oxidačně redukční potenciál je standardní oxidačně redukční potenciál je univerzální plynová konstanta je absolutní teplota je počet vyměněných elektronů je Faradayova konstanta je aktivita oxidované formy je aktivita redukované formy Z Nernstovy rovice vyplývá význam standardního oxidačně redukčního potenciálu: bude-li aktivita oxidované a redukované formy stejná, výraz za logaritmem bude roven 1 a celý druhý člen rovnice nule. Pak bude platit, že E = Eº. Problémem ovšem zůstává měření oxidačně redukčních potenciálů. Prakticky je totiž můžeme změřit pouze relativně vůči sobě. Proto byl stanoven definicí standardní potenciál tzv. vodíkové elektrody jako „ 0“:

Standardní elektrodový potenciál je definován jako elektromotorické napětí článku, jehož levou elektrodou je standardní vodíková elektroda, přičemž všechny složky reakcí jsou ve standardním stavu. Pro standardní vodíkovou elektrodu (ve zkratce SHE) platí (podle definice) při všech teplotách:

Demonstrační pokusy k vodíku a kyslíku: U demonstračních pokusů nejsou obvykle uvedeny úplné chemické rovnice. Nad každým popsaným pokusem se zamyslete a sami popište probíhající děj chemickou rovnicí. Toto se vztahuje na všechny demonstrační pokusy uvedené v systematické části. • štěknutí vodíku [ Zn (opláchnutý Cu. SO 4) + HCl(konc. ) ] • hoření špejle v O 2 [ H 2 O 2(1: 2) + H 2 SO 4+ KMn. O 4(rozetřený) ] Pomůcky: Zn, Cu. SO 4 (aq), HCl (konc. ), H 2 O 2, KMn. O 4, H 2 SO 4, špejle, velká erlenka, sirky, zábrusová dělička, zábrusová erlenka s postranním vývodem, svorka na zábrus, hadice, zaváděcí trubička, větší zkumavky, kádinka 500– 1000 ml ----------------------------------------

Halogeny Výklad je rozdělen na skupinovou charakteristiku (prvky, výskyt, oxidační stavy), bezkyslíkaté sloučeniny, a oxidy a oxokyseliny (zde je zdůrazněn základní rozdíl mezi fluorem a ostatními halogeny). Demonstrační pokusy Ukázat: I 2 (v lahvičce, páry v erlence po zahřátí) Br 2 [ Br 2(l) nenechávat kolovat, Br 2(aq. ) kolovat ] Cl 2 ( KMn. O 4 + HCl ) Reakce: Cl 2 + KBr(aq. ) —> Br 2 Cl 2 + KI(aq. ) —> I 2 rozpouštění I 2 v H 2 O, KI(aq. ), chloroformu, toluenu… jododusík (cca 1 malá lžička I 2)

Pomůcky: I 2, Br 2 aq. , KMn. O 4, HCl, KBr, KI, organická rozpouštědla pro vytřepávání erlenka s I 2 Zábrusová dělička, zábrusová bańka s postranním vývodem, svorka na zábrus, hadice, zaváděcí trubička, velké zkumavky, stojan na zkumavky --------------------------------------na jododusík: I 2, NH 4 OH, ethanol, büchnerka, odsávací baňka, guma, hadice, vývěva, startovací špejle, třecí miska, lžička ---------------------------------------

Chalkogeny Výklad je rozdělen na skupinovou charakteristiku (prvky, výskyt, oxidační stavy), bezkyslíkaté sloučeniny, a oxidy a oxokyseliny. Demonstrační pokusy Ukázat: S, Se (červený, černý), Te Reakce: SO 32− + KMn. O 4 ---(H+) odbarví se Se. O 32− + KMn. O 4 ---(H+) X SO 32− + N 2 H 6 SO 4 X Se. O 32− + N 2 H 6 SO 4 Se (červený), zahřát, okyselit H 2 SO 4 + KI X (pozor, H 2 SO 4 nesmí být konc. , jinak taky vypdane I 2. Možno ukázat jako porovnání vlastností konc × zřed. H 2 SO 4) H 2 Se. O 4 + KI I 2 Hoření síry – síra samotná hoří špatně – lepší je použít sirný knot

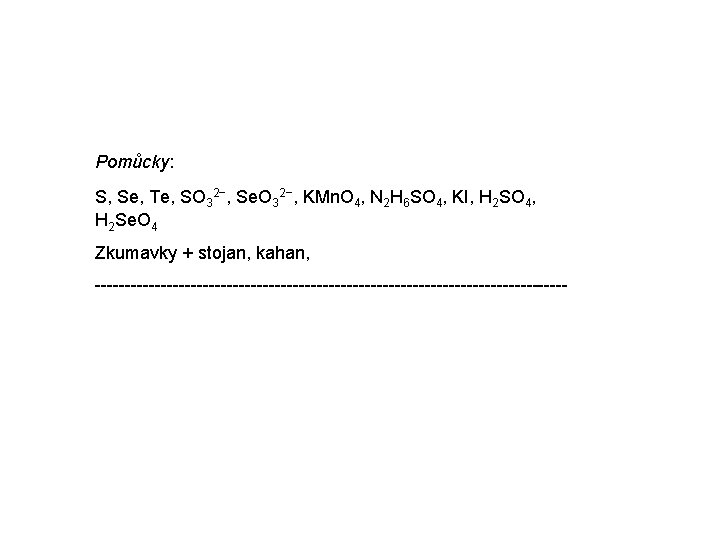
Pomůcky: S, Se, Te, SO 32−, Se. O 32−, KMn. O 4, N 2 H 6 SO 4, KI, H 2 SO 4, H 2 Se. O 4 Zkumavky + stojan, kahan, ----------------------------------------

Prvky skupiny dusíku Výklad je rozdělen na skupinovou charakteristiku (prvky, výskyt, oxidační stavy), bezkyslíkaté sloučeniny, a oxidy a oxokyseliny Demonstrační pokusy Ukázat: P (bílý, červený), Sb, Bi pokud nebyl připraven jododusík u jodu, lze jej zařadit sem hoření P(červený), P(bílý) – na konce plechu, uprostřed zahřívat Marshova zkouška: Zn (opláchnutý Cu. SO 4, pak HCl konc. ) + HCl (konc. ) – propláchnout aparaturu. test na štěkání vodíku. případně zapálit vodík na výstupu z aparatury. přidat HCl (zřed 1: 1− 2: 3) a As 2 O 3, (cca 50 mg, rozp. v konc HCl, pak zředit napůl). Ještě před vpuštěním As 3+ zahřát trubici mezi kuličkami, vpustit As 3+ a zahřívat do vyloučení arsenového zrcátka

Pomůcky: P-červený. , P-bílý, Sb, Bi, Zn, HCl (1: 1− 2: 3), Cu. SO 4 , jakýkoliv arsenitan nebo arseničnan Trojnožka, plech, sirky, kahan, zábrusová dělička, zábrusová baňka s postranním vývodem, svorka na zábrus, trubice, stojan, hadice, trubička ----------------------------------------

Prvky skupiny uhlíku a bor Přednáška zahrnuje skupinovou charakteristiku včetně srovnání běžných oxidačních stavů, ve kterých se tyto prvky vyskytují. Zvláštní pozornost je věnována srovnání stability dvoj- a čtyřmocenství u cínu a olova. V systematické části jsou pak probrány zejména anorganické sloučeniny uhlíku. Závěr přednášky je pak věnován jedinému nekovovému prvku třetí hlavní podskupiny – boru, se zaměřením na jeho vazebné možnosti. Demonstrační pokusy Ukázat: grafit, aktivní uhlí, Si, (Ge), Sn, Pb porovnání redox vlastností Pb a Sn: Pb. O 2(přisypat) + HCl(konc) —> Sn. O 2(přisypat) + HCl (konc) —> Pb. Cl 2(přisypat) + KMn. O 4 (zřed. ) Sn. Cl 2(přisypat) + KMn. O 4 (zřed. ) Pb. Cl 2 + H 2 O XX —> Sn. Cl 4 + Mn 2+

hoření Na v CO 2: vznikají saze. Do velké silnostěnné zkumavky napustit CO 2, vložit Na a intenzivně (dlouho) zahřívat kahanem. Na se vznítí a vznikají saze. Karbid : vhodit Ca. C 2 do kádinky s vodou a fenolftaleinem, zapálit unikající acetylen Srážení Si. O 2 · n. H 2 O vodní sklo (naředit cca 1: 1), za stálého míchání přikapávat zředěnou HCl, vzniká silikagel B H 3 BO 3 + Et. OH …zapálit —> estery hoří zeleně (použít buď methanol, nebo okyselit a dát hodně H 3 BO 3 a málo lihu)

Pomůcky: grafit, aktivní uhlí, Pb, Sn, Si, Ge Pb. O 2, Sn. O 2, HCl, Pb. Cl 2, Sn. Cl 2, KMn. O 4, Na 2 CO 3 (Na. HCO 3), karbid, vodní sklo, fenolftalein, H 3 BO 3 stojan + zkumavky, kahan, dělička, trubička, zkumavka, kádinka ----------------------------------------

Nepřechodné kovy 1. , 2. a 3. hlavní podskupiny Přednáška zahrnuje obecné a systematické vlastnosti prvků uvedených skupin. Důraz je kladen na amfoterní vlastnosti hliníku, afinitu k dusíku a kyslíku u 2. a 1. podskupiny a rozpustnost solí. Demonstrační pokusy vhodit Na do vody s fenolftaleinem hoření kovového Mg Al 3+ + NH 4 OH —> Al(OH)3 (s) Al(OH)3 + HCl —> rozpustí se Al(OH)3 + Na. OH —> rozpustí se Ukázat ampuli s Ga – po zahřátí rukou taje

Barvení plamene: Li – purpurově červeně Na – intenzivně žlutě K – fialově (do růžova) Rb – fialově Cs – fialově Ca – cihlově červeně Sr – karmínově červeně Ba – žlutozeleně Pomůcky: Al. Cl 3, NH 4 OH, HCl, Na. OH, Na, fenolftalein, soli výše uvedených kationtů, ampule s galiem zkumavky, stojan, kahan, platinové drátky, kádinky na mytí dátků