Anorganick chemie SOLI VY32INOVACE20 SOLI Jsou to chemick







- Slides: 9

Anorganická chemie SOLI VY_32_INOVACE_20 - SOLI

Ø Jsou to chemické sloučeniny složené z kationtů kovů a aniontů kyselin. Ø Jednotlivé ionty mohou být složeny z organických i anorganických látek. Ø V přírodě se vyskytují jako krystaly. Ø Mají vysoký bod tání a varu. Ø V roztoku nebo tavenině vedou elektrický proud. VY_32_INOVACE_20 - SOLI CHARAKTERISTIKA SOLÍ

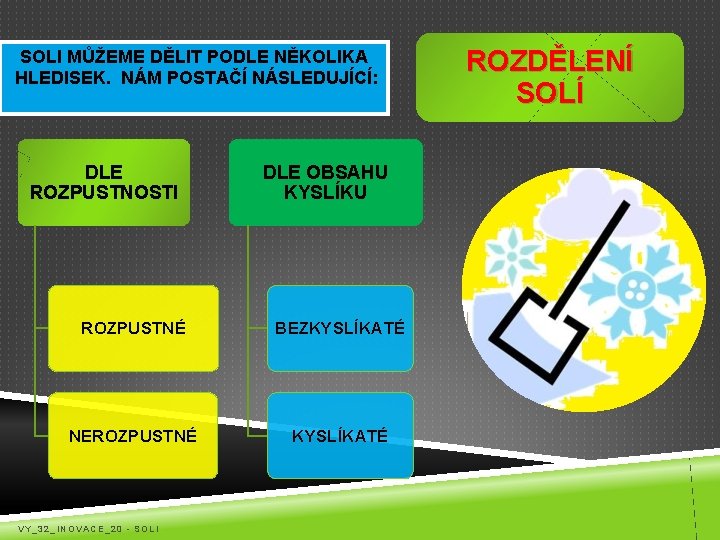
SOLI MŮŽEME DĚLIT PODLE NĚKOLIKA HLEDISEK. NÁM POSTAČÍ NÁSLEDUJÍCÍ: DLE ROZPUSTNOSTI DLE OBSAHU KYSLÍKU ROZPUSTNÉ BEZKYSLÍKATÉ NEROZPUSTNÉ KYSLÍKATÉ VY_32_INOVACE_20 - SOLI ROZDĚLENÍ SOLÍ

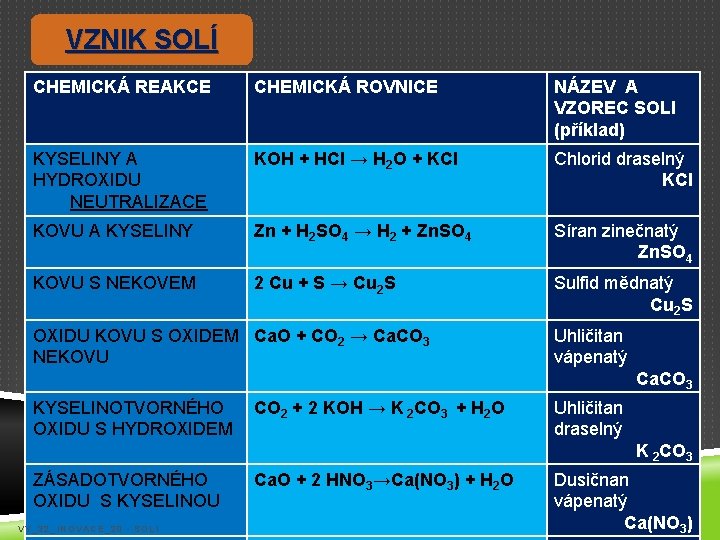
VZNIK SOLÍ CHEMICKÁ REAKCE CHEMICKÁ ROVNICE NÁZEV A VZOREC SOLI (příklad) KYSELINY A HYDROXIDU NEUTRALIZACE KOH + HCl → H 2 O + KCl Chlorid draselný KCl KOVU A KYSELINY Zn + H 2 SO 4 → H 2 + Zn. SO 4 Síran zinečnatý Zn. SO 4 KOVU S NEKOVEM 2 Cu + S → Cu 2 S Sulfid mědnatý Cu 2 S OXIDU KOVU S OXIDEM Ca. O + CO 2 → Ca. CO 3 NEKOVU Uhličitan vápenatý Ca. CO 3 KYSELINOTVORNÉHO OXIDU S HYDROXIDEM CO 2 + 2 KOH → K 2 CO 3 + H 2 O Uhličitan draselný K 2 CO 3 ZÁSADOTVORNÉHO OXIDU S KYSELINOU VY_32_INOVACE_20 - SOLI Ca. O + 2 HNO 3→Ca(NO 3) + H 2 O Dusičnan vápenatý Ca(NO 3)

NÁZVOSLOVÍ SOLÍ NÁZEV SOLI Podstatná jména v názvech solí s kyslíkem mají koncovku dle názvu kyseliny doplněné písmenkem - n VY_32_INOVACE_20 - SOLI PODSTATNÉ JMÉNO - aniont kyseliny PŘÍDAVNÉ JMÉNO - Název kationtu

Soli bezkyslíkatých kyselin a) halogenidy (Al. Cl 3) - dvouprvkové sloučeniny halogenu a vodíku, všechny halogeny mají ox. č. – I - jako všechny dvouprvkové sloučeniny mají zakončení – id b) sulfidy (Al 2 S 3) - dvouprvkové sloučeniny síry s kovovým prvkem, ve kterých mají atomy síry oxid. č. - II - pro tvorbu názvů a vzorců platí stejné pravidla jako pro oxidy - sulfidy = sirníky (postaru), jako oxidy - kysličníky l. II -I Al Cl VY_32_INOVACE_20 - SOLI 3 l. II Al 2 -II S 3

Soli kyslíkatých kyselin - tvorba vzorců - dusičnany, dusitany, uhličitany, … - místo kationtu může být vázána i amonná skupina - NH 4 NO 3 – dusičnan amonný příklad postupu: uhličitan železitý 1) název kyseliny: - kyselina uhličitá 2) vzorec kyseliny: H 2 CO 3 3) vzorec aniontu: (CO 3)-II 4) vzorec kationtu: Fe+III 5) vzorec soli (celk. náboj kationtů= celk. náboji aniontů) Fe 2(CO 3)3 VY_32_INOVACE_20 - SOLI

VY_32_INOVACE_20 - SOLI

ZDROJ: Ø Snímek č. 1: http: //office. microsoft. com/cs-cz/images/results. aspx? qu=soli&ex=2#ai: MC 900157675| Ø Snímek č. 2: http: //office. microsoft. com/cs-cz/images/results. aspx? qu=kopec&ex=1#ai: MP 900439361| VY_32_INOVACE_20 - SOLI