ANLISE GRAVIMTRICA Prof Augusto Tanamati ANLISE GRAVIMTRICA Analito




















- Slides: 23

ANÁLISE GRAVIMÉTRICA Prof Augusto Tanamati

ANÁLISE GRAVIMÉTRICA Analito: separado de uma amostra

MÉTODOS GRAVIMÉTRICOS DE ANÁLISE Gravimetria por precipitação: analito é separado de uma solução da amostra como um precipitado e é convertido a uma espécie de composição conhecida que pode ser pesada Gravimetria de volatilização: analito é isolado dos outros constituintes da amostra pela conversão a um gás de composição química conhecida Eletrogravimetria: analito é separado pela deposição em um eletrodo por meio de uma corrente elétrica Titulação gravimétrica

VANTAGENS a. b. c. d. É exata e precisa quando se usa balanças analíticas É fácil de controlar as possíveis fontes de erro Não há necessidade de calibração – medição direta As determinações podem ser realizadas com aparelhos relativamente baratos (mufla e cadinho de Pt – mais caros) O peso do elemento ou composto pode ser calculado a partir da fórmula química do composto e das massas atômicas dos elementos que constituem o composto pesado

GRAVIMETRIA POR PRECIPITAÇÃO 1. 2. 3. 4. 5. 6. 7. ETAPAS Preparo da solução Precipitação Digestão Filtração Lavagem Secagem ou calcinação Pesagem

GRAVIMETRIA POR PRECIPITAÇÃO

GRAVIMETRIA POR PRECIPITAÇÃO

GRAVIMETRIA POR PRECIPITAÇÃO Até massa constante

GRAVIMETRIA POR PRECIPITAÇÃO

TIPOS DE PRECIPITADOS

TIPOS DE PRECIPITADOS

TIPOS DE PRECIPITADOS


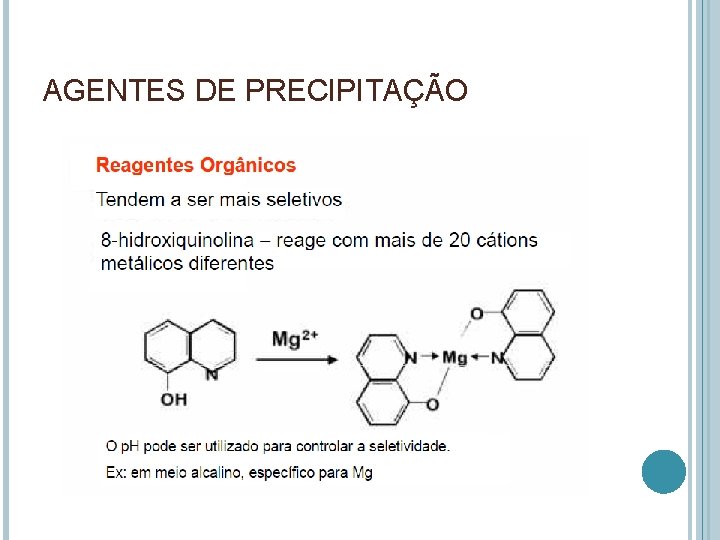
AGENTES DE PRECIPITAÇÃO

AGENTES DE PRECIPITAÇÃO

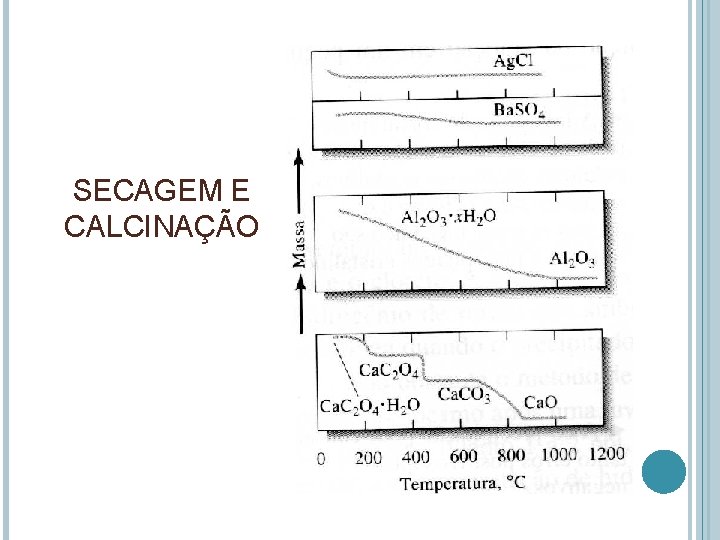
SECAGEM E CALCINAÇÃO DOS PRECIPITADOS Aquecimento dos precipitados até massa constante Remove o solvente e qualquer espécie volátil arrastada com o precipitado (água adsorvida, água ocluída, água de hidratação) Decomposição do sólido e formação de uma substância de composição definida

SECAGEM E CALCINAÇÃO

APLICAÇÕES Maioria dos cátions orgânicos e inorgânicos Espécies neutras, como água, CO 2, SO 2 e I 2 Lactose em derivados de leite, salicilatos em preparações farmacêuticas, fenolftaleínas em laxantes, nicotina em pesticidas, colesterol em cereais, benzaldeído em extrato de amêndoas

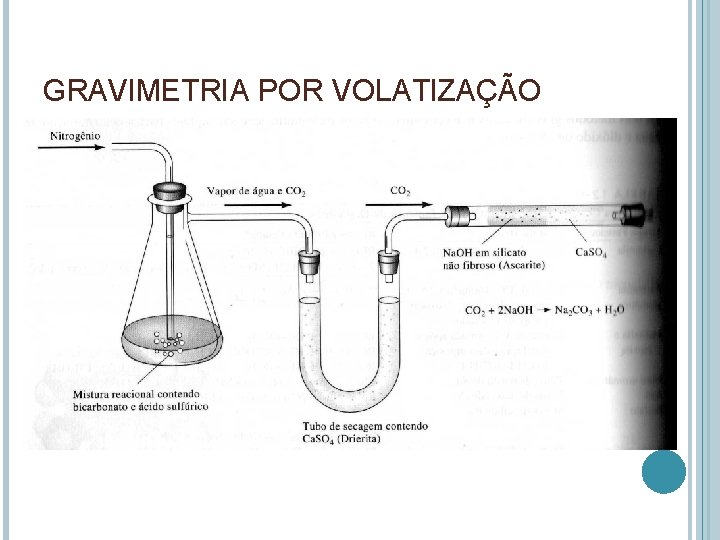
GRAVIMETRIA POR VOLATIZAÇÃO Água: passa por um secante (aumento de massa) Água indireta: perda de massa do material (teor de umidade de cereais) – pode haver erros CO 2

GRAVIMETRIA POR VOLATIZAÇÃO

CÁLCULOS 1. O cálcio presente em uma amostra de 200, 0 m. L de uma água natural foi determinado pela precipitação do cátion como Ca. C 2 O 4. O precipitado foi filtrado, lavado e calcinado em um cadinho com uma massa de 26, 6002 g quando vazio. A massa do cadinho mais Ca. O (56, 077 g/mol) foi de 26, 7134 g. Calcule a concentração de cálcio (40, 078 g/mol) nessa água em g/100 m. L de água.

CÁLCULOS 2. Um minério de ferro foi analisado pela dissolução de uma amostra de 1, 1324 g em HCl concentrado. A solução resultante foi diluída em água e o ferro (III) foi precipitado na forma de Fe 2 O 3. x. H 2 O pela adição de NH 3. Após filtração e lavagem, o resíduo foi calcinado a alta temperatura para gerar 0, 5394 g de Fe 2 O 3 puro (159, 69 g/mol). Calcule a porcentagem de Fe (55, 847 g/mol na amostra)

CÁLCULOS 3. Uma amostra de 0, 2356 g contendo apenas Na. Cl (58, 44 g/mol) e Ba. Cl 2 (208, 23 g/mol) gerou 0, 4637 g de Ag. Cl seco (143, 32 g/mol). Calcule a porcentagem de cada composto de halogênio presente na amostra.
 Analito
Analito Analito
Analito Analito
Analito Anlise swot
Anlise swot Fernando augusto segura restrepo
Fernando augusto segura restrepo Vida de augusto comte
Vida de augusto comte Possitivismo
Possitivismo Carlos augusto alves santana
Carlos augusto alves santana Brandao filho
Brandao filho Texto augusto cury
Texto augusto cury Pensamiento de augusto comte
Pensamiento de augusto comte Testamento di augusto
Testamento di augusto Augusto bautista
Augusto bautista Augusto di prima porta
Augusto di prima porta Cifrario di augusto
Cifrario di augusto When was augusto boal born
When was augusto boal born Cantos maternales
Cantos maternales Degasatura
Degasatura Estado teologico del positivismo
Estado teologico del positivismo Biografia de augusto boal
Biografia de augusto boal Moralizzazione dei costumi augusto
Moralizzazione dei costumi augusto Augusto coppola
Augusto coppola Liceo righi bologna
Liceo righi bologna Ley de los 3 estados de augusto comte
Ley de los 3 estados de augusto comte