Analyse dun sol I Les sols Pour analyser




- Slides: 5

Analyse d’un sol I - Les sols : Pour analyser un sol il faut distinguer sa terre arable (partie du sol dans laquelle les plantes développent leurs racines). Elle est composée principalement de matières minérales: en grande majorité du sable, de l’argile et du calcaire. Sable : Si. O 2. ( Silice ) Calcaire : Ca. CO 3. ( Carbonate de calcium ) Argile : Ions + ( C+, Ca²+ , … ), Ions – ( Ci- … ). Le sol est électriquement composé d’autant d’anions que de cations. Les charges s’annulant, le sol a une charge électrique neutre.

II - Préparer la « solution de sol » • Pour préparer la solution à base de terre, il faut : -Prélever de la terre dans le fond de bécher -Ajouter 10 à 20 m. L d’eau déminéralisée -Après agitation, laisser décanter -Filtrer la solution <<qui surnage>> dans une petite fiole erlenmeyer • C’est sur ce filtrat obtenu que seront réalisés les tests d’identifications.

III - Test d’acidité du sol : le p. H • Le p. H est une grandeur comprise entre 0 et 14. Elle indique la concentration de la solution ( acidité ). • Il se mesure à l’aide d’un p. H-mètre. • Ce p. H-mètre indique la valeur du p. H de la solution. • Le papier p. H se colore différemment selon <<l’acidité>> de la solution. • Par exemple à une température de 25°C, la solution est : - Acide si le p. H inférieur à 7 -Neutre si le p. H égale à 7 -Basique si le p. H supérieur à 7 • Plus le p. H est élevé, plus la concentration de la solution en ions H+ diminue.

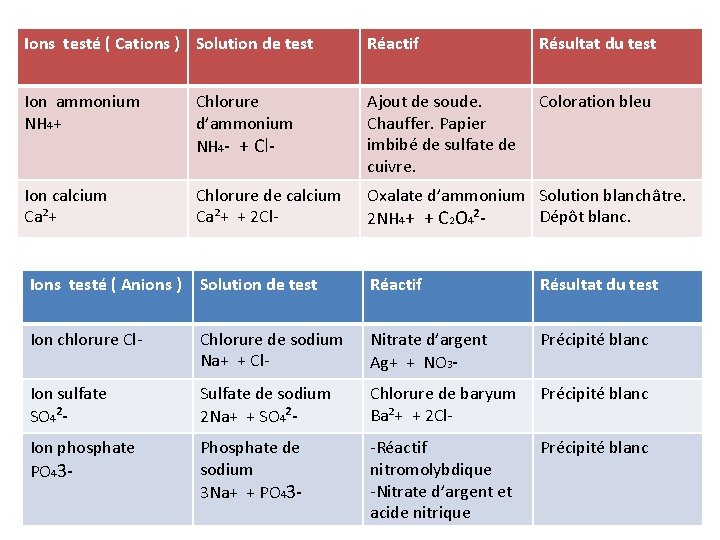
IV - Les test d’anions et de cations Pour effectuer les tests d’anions et de cations : -On introduit 1 m. L de la solution à tester dans un tube à essai. -On ajoute 3 gouttes de réactif -Agiter le tube tout en le chauffant ( Attention : Diriger le tube vers le mur ou extérieur et non vers quelqu’un d’autre. )

Ions testé ( Cations ) Solution de test Réactif Résultat du test Ion ammonium NH 4+ Chlorure d’ammonium NH 4 - + Cl- Ajout de soude. Chauffer. Papier imbibé de sulfate de cuivre. Coloration bleu Ion calcium Ca²+ Chlorure de calcium Ca²+ + 2 Cl- Oxalate d’ammonium Solution blanchâtre. Dépôt blanc. 2 NH 4+ + C 2 O 4²- Ions testé ( Anions ) Solution de test Réactif Résultat du test Ion chlorure Cl- Chlorure de sodium Na+ + Cl- Nitrate d’argent Ag+ + NO 3 - Précipité blanc Ion sulfate SO 4²- Sulfate de sodium 2 Na+ + SO 4²- Chlorure de baryum Ba²+ + 2 Cl- Précipité blanc Ion phosphate PO 43 - Phosphate de sodium 3 Na+ + PO 43 - -Réactif nitromolybdique -Nitrate d’argent et acide nitrique Précipité blanc