ANALIZA MIARECZKOWA wykad 1 Podzia analizy ilociowej w



















- Slides: 22

ANALIZA MIARECZKOWA wykład 1

Podział analizy ilościowej w zależności od metod pomiarowych 1. Analiza klasyczna (w oparciu o pomiar masy i objętości) - analiza wagowa - metody objętościowe 2. Analiza instrumentalna (oparta o pomiar zmiennej właściwości fizycznej lub fizykochemicznej układu) - metody spektroskopowe - metody elektroanalityczne - chromatografia - metody optyczne 3. Analiza śladów 2

Podział metod analitycznych w zależności od wielkości próbki analitycznej L. p. Nazwa metody 1 Makroanaliza 2 Mezoanaliza 3 Mikroanaliza 4 Masa próbki (g) do 10 -1 - 10 -2 - 10 -3 Metoda mikrogramowa 10 -4 - 10 -6 3

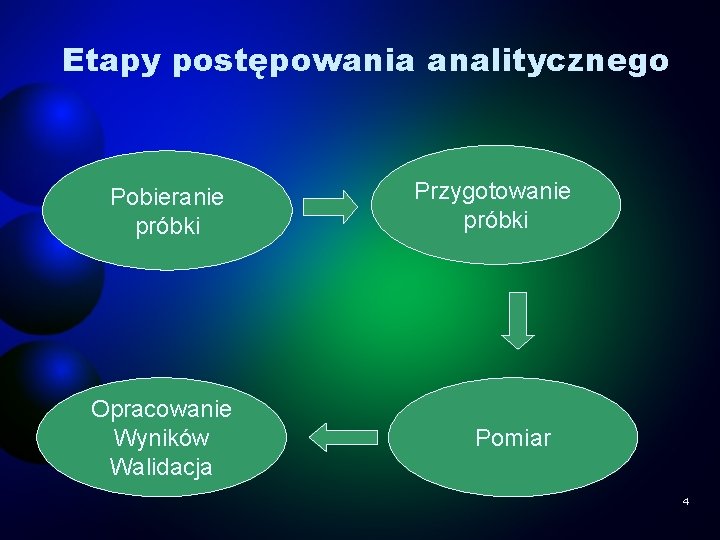
Etapy postępowania analitycznego Pobieranie próbki Opracowanie Wyników Walidacja Przygotowanie próbki Pomiar 4

Czułość, dokładność i precyzja metod analitycznych Ø Ø Precyzyjne i dokładne Precyzyjne i mało dokładne Mało precyzyjne i mało dokładne 5

Analiza miareczkowa -Volumetria Podstawowe pojęcia Ø Ø Ø Ø określenie analizy miareczkowej roztwór mianowany miareczkowanie punkt równoważności - PR punkt końcowy miareczkowania – PK substancja podstawowa (wzorcowa) indykator (wskaźnik) krzywa miareczkowania 6

v W analizie miareczkowej mogą znaleźć zastosowanie tylko reakcje które spełniają następujące warunki: Ø Reakcja zachodzi szybko po dodaniu nawet małej porcji odczynnika Ø Reakcja przebiega stechiometrycznie Ø Istnieje możliwość zaobserwowania końca miareczkowania Ø Inne substancje znajdujące się w roztworze nie mogą reagować z odczynnikiem użytym do miareczkowania 7

v Miareczkowanie to wprowadzenie roztworu mianowanego do roztworu zawierającego oznaczaną substancję, niewielkimi porcjami tzw. miareczkami do momentu, w którym ilość dodawanego odczynnika zrównoważy ilość składnika oznaczanego. v Moment ten nazywamy punktem równoważności (PR). v Punktem końcowym (PK) miareczkowania nazywamy punkt, w którym kończymy miareczkowanie wskutek wyraźnej zmiany barwy wskaźnika, która zaszła w roztworze 8

v Indykator czyli wskaźnik – substancja zmieniająca barwę w chwili zakończenia reakcji między oznaczaną substancją i roztworem mianowanym. Wskazuje PK miareczkowania. Przykłady; -oranż metylowy, fenoloftaleina -mureksyd, kalces v Titrant – roztwór mianowany przeznaczony do miareczkowania. 9

v Roztwór mianowany – to roztwór o dokładnie znanym stężeniu: Ø molowym Ø procentowym Ø lub mianie (miano roztworu-titranta-jest to liczba gramów substancji rozpuszczonej znajdująca się w 1 ml tego roztworu) w g/ml Ø lub ilością oznaczanego składnika, która reaguje z roztworem mianowanym wyrażonym liczbą do czwartego miejsca znaczącego np. 1. 213 M; 0. 1187 M; 0. 02234 M; 0, 008621 M 10

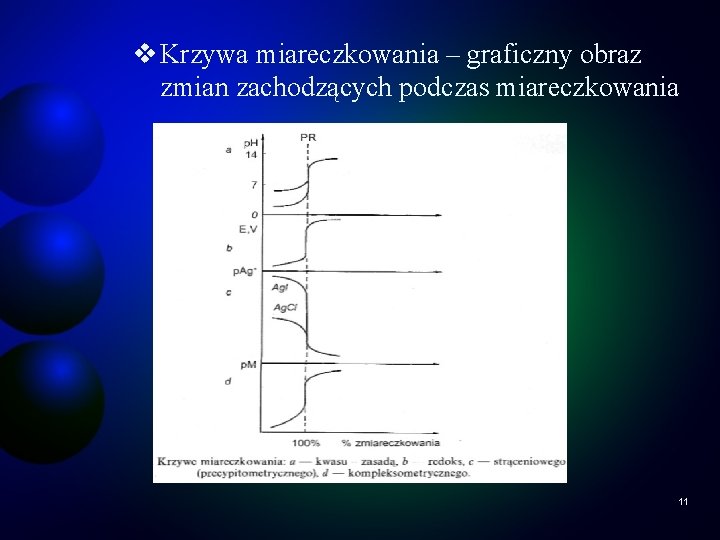
v Krzywa miareczkowania – graficzny obraz zmian zachodzących podczas miareczkowania 11

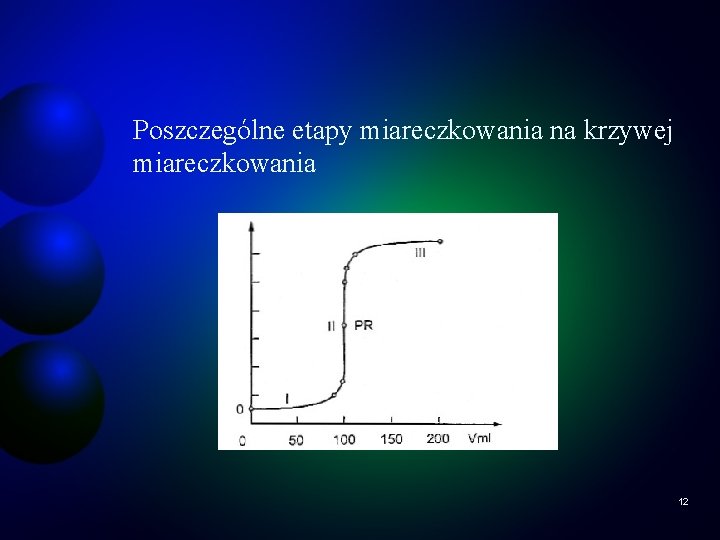
Poszczególne etapy miareczkowania na krzywej miareczkowania 12

v Błąd miareczkowania – róźnica pomiędzy PR i PK Jeżeli PK następuje przed PR to błąd miareczkowania jest ujemny. Jeżeli PK następuje po PR jest dodatni Błąd miareczkowania nie powinien przekroczyć 0, 05 -0, 1%. Minimalizacja błędu polega głównie na Ø doborze najwłaściwszego wskaźnika Ø Zastosowaniu odpowiedniej poprawki 13

Klasyfikacja metod miareczkowych v wg zachodzącej reakcji Ø Alkacymetria Ø Kompleksometria Ø Precypitometria Ø Redoksymetria v wg detekcji punktu równoważności Ø Indykacja wzrokowa Ø Indykacja instrumentalna (amaperometria. potencjometria, konduktometria, fotokolorymetria) 14

v wg sposobu prowadzenia miareczkowania Ø Miareczkowanie bezpośrednie Jest to metoda najprostsza – roztwór substancji oznaczanej miareczkuje się roztworem mianowanym odczynnika miareczkującego. • Miareczkowanie odwrotne – inaczej zwane metodą odmiareczkowywania. Metoda ta wymaga użycia 2 roztworów mianowanych i stosowana jest w przypadku: (reakcji red-oks, reakcji kompleksowania) lub w przypadku niemożności doboru wskaźnika do miareczkowania bezpośredniego. 15

• Przebieg takiego miareczkowania odwrotnego jest określony: do roztworu substancji oznaczanej wprowadzamy określoną ilość roztworu mianowanego odczynnika miareczkującego (w nadmiarze), a następnie odmiareczkowujemy ten nadmiar innym roztworem miareczkującym. Właściwy indykator wykrywa punkt końcowy reakcji obu odczynników miareczkujących 16

Ø Miareczkowanie podstawieniowe Nie polega ono na miareczkowaniu oznaczanego składnika, lecz substancji będącej produktem reakcji oznaczanego składnika z odpowiednim odczynnikiem. Znaczna część oznaczeń jodometrycznych jest przykładem stosowania miareczkowania podstawieniowego. 17

Ø Miareczkowanie pośrednie jest odmianą miareczkowania podstawieniowego. Metody te są stosowane do oznaczania np. anionu, dla którego nie ma odpowiedniego odczynnik maiareczkującego. Wytrąca się go w postaci osadu i po odsączeniu ponownie roztwarza. Miareczkowanie obejmuje oznaczenie ilości kationu związanego z oznaczanym anionem. 18

v Przygotowanie i ustalenie miana titrantów Mianowanie najczęściej wykonuje się metodą miareczkową, przy czym roztwór którego miano się wyznacza powinien być zawsze w biurecie! W praktyce laboratoryjnej mianowanie wykonuje się poprzez: Ø Miareczkowanie odważek substancji wzorcowych Ø Miareczkowanie roztworów wzorcowych 19

Wymagania stawiane substancji wzorcowej; Ø posiada ściśle określony skład chemiczny Ø jest łatwa do otrzymania, suszenia i przechowywania w stanie czystym Ø nie powinna być higroskopijna, ani ulegać żadnym innym zmianom na powietrzu Ø zawartość domieszek nie może przekraczać 0, 01 -0, 02% Ø jej reakcja z roztworem mianowanym musi przebiegać stechiometrycznie Ø pożądane jej aby miała możliwie dużą masę molową 20

Błędy w analizie miareczkowej: v Metodyczne np. niemożność dobrania wskaźnika tak by PK=PR v Operacyjne Ø zbyt szybkie miareczkowanie Ø brudne naczynia miarowe -zbyt małe ilości zużywane do miareczkowania -niedokładne odczytywanie objętości -trudności w obserwowaniu zmiany barwy wskaźnika np. oranż metylowy żółta-cebulowa-pomarańczowa-różowokoralowa 21

v Obliczanie zawartości substancji oznaczanej 22