Analiza Instrumentalna dr Dariusz Guziejewski dguziejewskiuni lodz pl








































- Slides: 51

Analiza Instrumentalna

dr Dariusz Guziejewski dguziejewski@uni. lodz. pl 635 -54 -80 konsultacje: p. 7 piątek 10 -12

Analiza Instrumentalna dostęp do plików, zakładka Dydaktyka, strona Zakładu Analizy Instrumentalnej login: Analiza_Instrumentalna hasło: chemia 2014

Analiza Instrumentalna wykład 14 h (1 xtyg. 1 h) Egzamin!!!

• Analiza Instrumentalna 14 h wykład egzamin 14 h konwersatorium 54 h laboratorium • Analiza Instrumentalna N (Nauczanie chemii) 14 h wykład egzamin 14 h konwersatorium 28 h laboratorium

Zakres Materiału 1. Podział metod analitycznych 2. Metody elektrochemiczne (kulometria, woltamperometria) 3. Metody spektroskopowe (UV/Vis, ASA, ESA) 4. Metody separacyjne (GC, HPLC, TLC, EC)

ZALECANE PODRĘCZNIKI A. Cygański "Metody elektroanalityczne", WNT A. Cygański "Metody spektroskopowe w chemii analitycznej", WNT J. Minczewski, Z. Marczenko "Chemia analityczna tom 3", PWN. W. Szczepaniak "Metody instrumentalne w analizie chemicznej", PWN Z. Witkiewicz "Podstawy chromatografii", WNT J. Badecka-Jędrzejewska "Wybrane zagadnienia z analizy instrumentalnej", Wyd. UŁ

Podręczniki • J. Badecka-Jędrzejewska, Laboratorium z analizy instrumentalnej

Podręczniki • A. Cygański, Metody elektroanalityczne

Podręczniki • A. Cygański, Metody spektroskopowe

Podręczniki • Z. Witkiewicz, J. Kałużna. Czaplińska Podstawy chromatografii i technik elektromigracyjnych

Podręczniki • W. Szczepaniak, Metody instrumentalne w analizie chemicznej


M. Skowron-Jaskólska, W. Ciesielski Zadania rachunkowe z analizy instrumentalnej W. Ciesielski, J. Badecka. Jędrzejewska, Ćwiczenia rachunkowe z analizy instrumentalnej

Co to jest chemia analityczna? Interdyscyplinarna nauka zajmująca się opracowaniem oraz praktycznym zastosowaniem metod pozwalających na określenie ze znaną precyzją i dokładnością składu chemicznego obiektów materialnych. Przedmiotem analityki jest: Informacja o rodzaju i zawartości składników włącznie z ich przestrzennym uporządkowaniem i rozmieszczeniem, a także zmianami w czasie. Wynikiem badań analitycznych jest informacja uzyskiwana poprzez materialne lub energetyczne oddziaływanie na badany obiekt.

ANALIZA INSTRUMENTALNA Analiza z wykorzystaniem instrumentów, czyli przyrządów (aparatów) pomiarowych, które mierzą właściwość fizyczną lub fizykochemiczną, czyli sygnał analityczny dla badanego analitu. Sygnał ten dostarcza jakościowych i/lub ilościowych informacji o tym analicie.

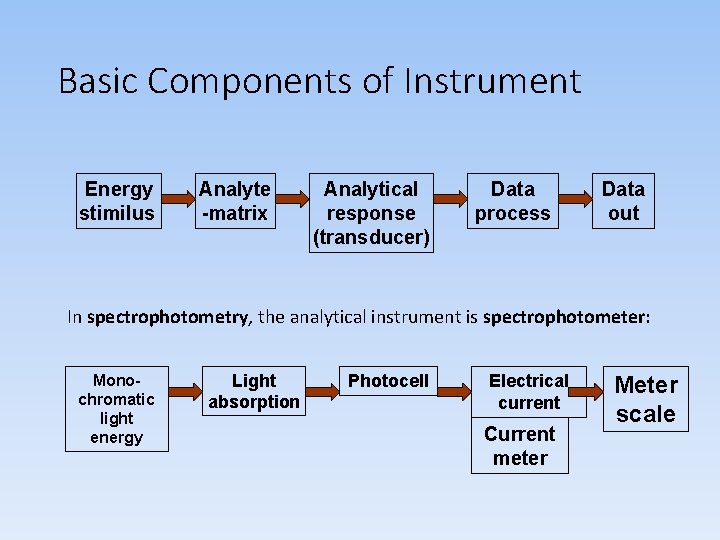
Basic Components of Instrument Energy stimilus Analyte -matrix Analytical response (transducer) Data process Data out In spectrophotometry, the analytical instrument is spectrophotometer: Monochromatic light energy Light absorption Photocell Electrical current Current meter Meter scale

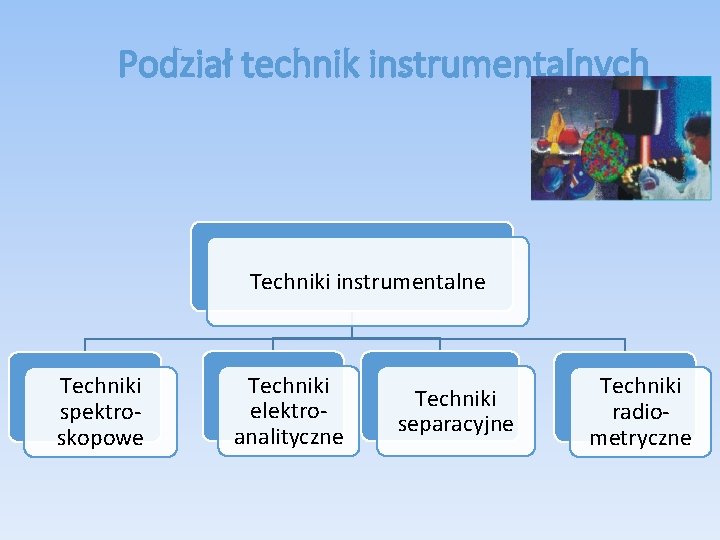
Podział technik instrumentalnych Techniki instrumentalne Techniki spektroskopowe Techniki elektroanalityczne Techniki separacyjne Techniki radiometryczne

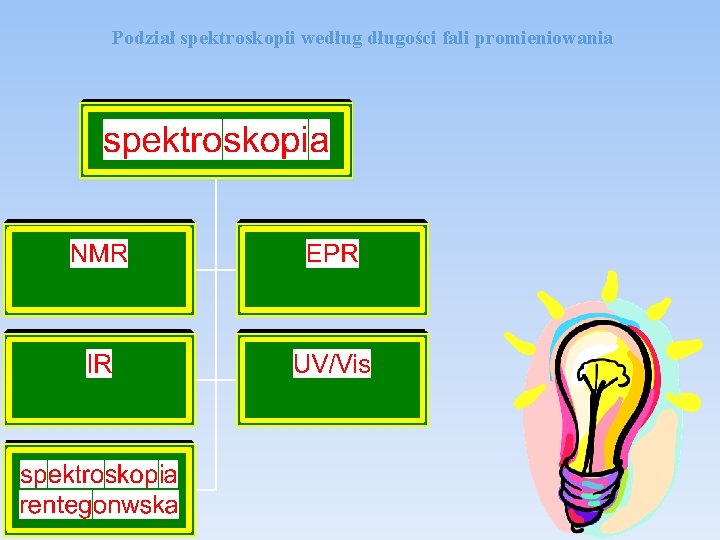
PODSTAWOWE TECHNIKI INSTRUMENTALNE 1. Metody spektroskopowe spektrofotometria UV/VIS, spektrofotometria w podczerwieni, spektrofotometria fluorescencyjna i fosforescencyjna, absorpcyjna i emisyjna spektrometria atomowa (ASA, ESA), spektroskopia Ramana, spektroskopia rentgenowska, techniki radiochemiczne, analiza aktywacyjna, spektroskopia magnetycznego rezonansu jądrowego (NMR), spektroskopia elektronowego rezonansu paramagnetycznego (EPR).

PODSTAWOWE TECHNIKI INSTRUMENTALNE 2. Metody elektroanalityczne (elektrochemiczne) potencjometria, konduktometria, polarografia i woltamperometria, elektrograwimetria i kulometria,

3. Metody separacyjne Chromatografia gazowa (GC), Chromatografia cieczowa: wysokosprawna (HPLC) i planarna (TLC), Chromatografia fluidalna Techniki elektromigracyjne (ćwiczenie pokazowe)

5. Techniki łączone chromatografia gazowa lub cieczowa – spektrometria masowa (GC-MS), emisyjna spektroskopia atomowa ICP – spektrometria masowa (ESA ICP-MS), chromatografia gazowa lub cieczowa - spektrofotometria w podczerwieni (GC-IR). lub cieczowa -

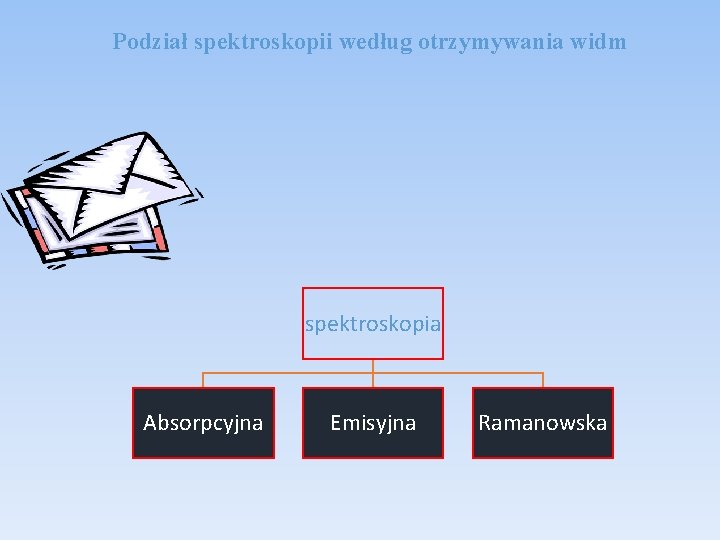
Podział spektroskopii według otrzymywania widm spektroskopia Absorpcyjna Emisyjna Ramanowska

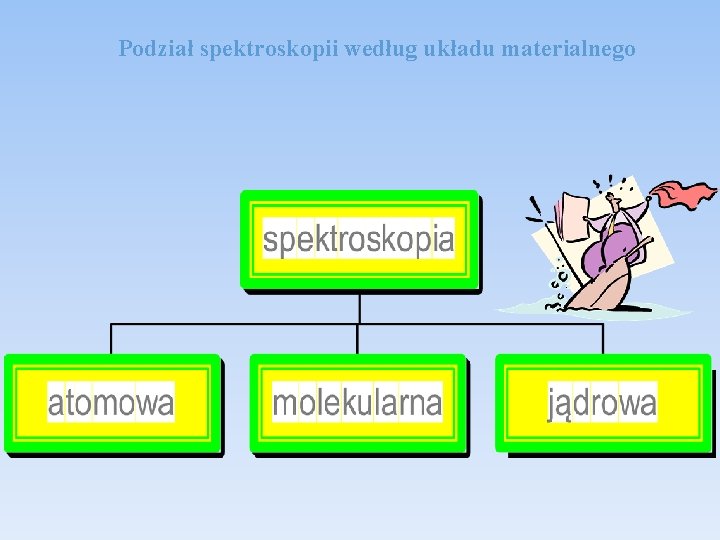
Podział spektroskopii według układu materialnego

Podział spektroskopii wedługości fali promieniowania

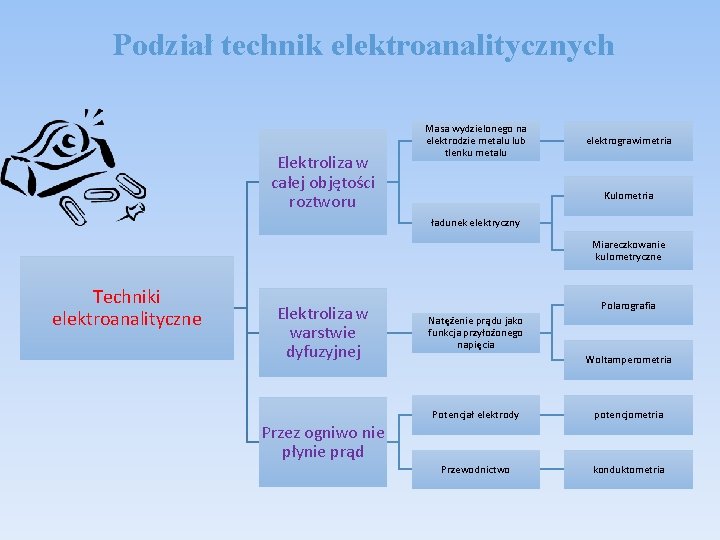
Podział technik elektroanalitycznych Elektroliza w całej objętości roztworu Masa wydzielonego na elektrodzie metalu lub tlenku metalu elektrograwimetria Kulometria ładunek elektryczny Miareczkowanie kulometryczne Techniki elektroanalityczne Elektroliza w warstwie dyfuzyjnej Przez ogniwo nie płynie prąd Polarografia Natężenie prądu jako funkcja przyłożonego napięcia Woltamperometria Potencjał elektrody potencjometria Przewodnictwo konduktometria

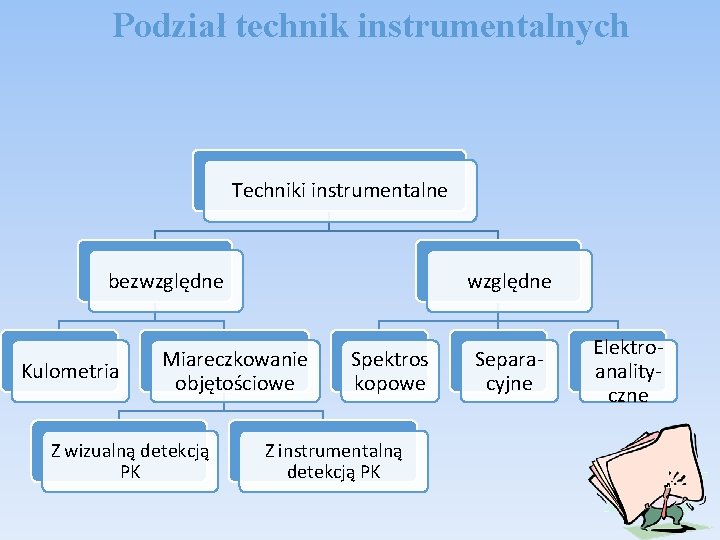
Podział technik instrumentalnych Techniki instrumentalne bezwzględne Kulometria względne Miareczkowanie objętościowe Z wizualną detekcją PK Spektros kopowe Z instrumentalną detekcją PK Separacyjne Elektroanalityczne

METODY BEZWZGLĘDNE (ABSOLUTNE) Metody opierające się na reakcjach chemicznych lub elektrochemicznych przebiegających całkowicie i zgodnie ze znaną stechiometrią. Informacji o badanej próbce uzyskuje się na podstawie pomiaru odpowiedniej wielkości fizycznej: metoda wielkość mierzona grawimetria masa miareczkowanie objętość titranta gazometria objętość gazu kulometria ładunek elektrograwimetria masa substancji wydzielonej na elektrodzie termograwimetria ubytek masy

METODY PORÓWNAWCZE (WZGLĘDNE) W celu uzyskania dokładnych wyników ilościowych wymagają kalibracji względem znanych wzorców. Kalibracja polega na ustaleniu zależności między wartością sygnału detektora, a stężeniem (ilością) analitu generującego sygnał: y = f(c) y – wielkość mierzona, c – stężenie analitu. W pewnym zakresie stężeń funkcja ma charakter prostoliniowy i przyjmuje postać: y = a·c lub y = a·c + b a – współczynnik proporcjonalności, wyznaczany w procesie kalibracji, b - odcinek na osi Y, który może być na przykład wartością sygnału analitycznego ślepej próby, wyznaczonym w procesie kalibracji. Pomiary względne można realizować różnymi metodami: 1. Metoda krzywej kalibracyjnej (prostej wzorcowej). 2. Metoda dodawania wzorca. 3. Metoda wzorca wewnętrznego. 4. Metoda porównania ze wzorcem.

Wybór odpowiedniej metody kalibracji zależy od: charakteru zależności funkcyjnej, charakteru próbek analitycznych, czynników zakłócających, charakterystyki aparatury, warunków doświadczenia. Jakość kalibrowania zależy od czynników takich jak: powtarzalność pomiarów wykorzystywanych do kalibrowania, wiarygodność stosowanych wzorców, poprawność porównania sygnału analitycznego dla badanego obiektu z zależnością otrzymaną w czasie kalibracji.

METODA PROSTEJ WZORCOWEJ Przygotowanie prostej wzorcowej 1. Przygotowanie 3 -8 roztworów wzorcowych o znanej zawartości analitu xw (stężenie, masa, liczba moli). 2. Przygotowanie roztworu próbki. 3. Pomiar sygnału analitycznego Yw dla roztworów wzorcowych. 4. Pomiar sygnału analitycznego YP dla roztworu próbki. x Y 1 2 2 4 3 6 4 8 5 10 próbka 5

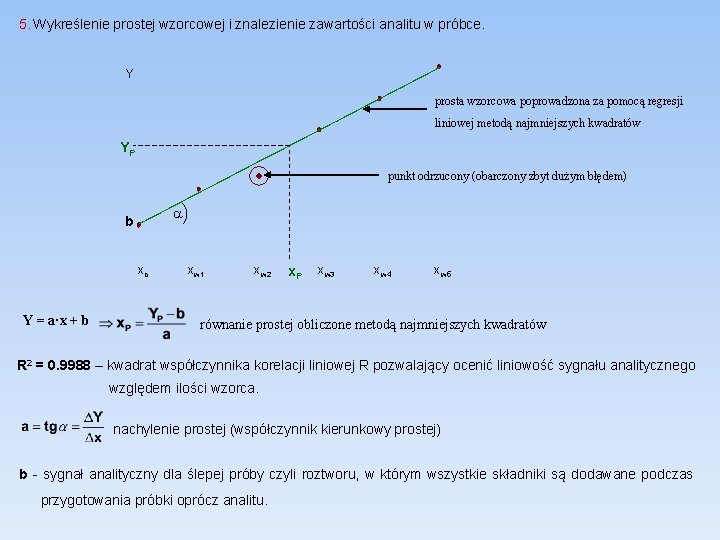
5. Wykreślenie prostej wzorcowej i znalezienie zawartości analitu w próbce. Y prosta wzorcowa poprowadzona za pomocą regresji liniowej metodą najmniejszych kwadratów YP punkt odrzucony (obarczony zbyt dużym błędem) b a xo x w 1 x w 2 x x. P w 3 x w 4 x w 5 Y = a·x + b równanie prostej obliczone metodą najmniejszych kwadratów R 2 = 0. 9988 – kwadrat współczynnika korelacji liniowej R pozwalający ocenić liniowość sygnału analitycznego względem ilości wzorca. nachylenie prostej (współczynnik kierunkowy prostej) b - sygnał analityczny dla ślepej próby czyli roztworu, w którym wszystkie składniki są dodawane podczas przygotowania próbki oprócz analitu.


Aby otrzymać idealną prostą kalibracyjną powinny być spełnione warunki: 1. Środowisko w jakim znajduje się analit w próbce powinno być podobne jak środowisko wzorca. 2. Procedura przygotowania roztworów wzorcowych powinna być taka sama jak procedura przygotowania próbki. 3. Warunki podczas pomiarów powinny być takie same dla przygotowania prostej wzorcowej jak i dla próbki. 4. Niezbędne jest częste sprawdzenie przebiegu wykresu, zwłaszcza przy każdej zmianie warunków analitycznych, którą jest np. przygotowanie nowej porcji odczynników, wymiana jakiegoś elementu aparatury, a nawet zmiana analityka wykonującego pomiary. Sporządzenie wykresu i wyznaczenie za jego pomocą zawartości analitu w rzeczywistej próbce analitycznej może być źródłem poważnych błędów systematycznych. Tak dzieje się, jeśli wykres odnosi się tylko do etapu samego pomiaru instrumentalnego, a nie do całej procedury obejmującej wszystkie etapy procesu analitycznego.

METODA DODATKU WZORCA Metodę dodatku wzorca można realizować w wariantach: pojedynczego dodatku wzorca, wielokrotnego dodatku wzorca. Wykonanie oznaczenia 1. Przygotowanie podstawowego roztworu wzorcowego o znanej zawartości analitu xw (stężenie, masa, liczba moli). 2. Przygotowanie próbki. 3. Pomiar sygnału analitycznego Yo dla próbki (P). 4. Dodanie do próbki określonej ilości roztworu wzorcowego (W 1). 5. Pomiar sygnału analitycznego Yo+w 1 próbki z dodatkiem wzorca (P+W 1). Dla wariantu wielokrotnego dodatku wzorca: 6. Kolejny dodatek określonej ilości roztworu wzorcowego (W 2). 7. Pomiar sygnału analitycznego Yo+w 2 próbki z kolejnym dodatkiem wzorca (P+W 1+W 2). 8. Kolejny dodatek roztworu wzorcowego (W 3. . . Wn) i pomiar sygnału analitycznego (P+W 1+W 2+W 3+. . . Wn).

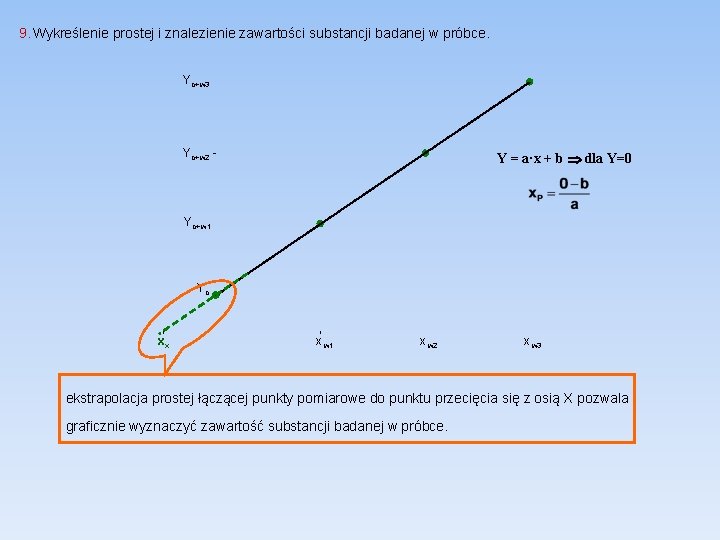
9. Wykreślenie prostej i znalezienie zawartości substancji badanej w próbce. Yo+w 3 Yo+w 2 Y = a·x + b dla Y=0 Yo+w 1 Yo xx x w 1 x w 2 x w 3 ekstrapolacja prostej łączącej punkty pomiarowe do punktu przecięcia się z osią X pozwala graficznie wyznaczyć zawartość substancji badanej w próbce.

Zalety metody dodatku wzorca jest stosowana gdy nie jest możliwe przygotowanie roztworów wzorcowych o składzie identycznym ze składem próbki; daje dobre wyniki gdy brak jest informacji o wszystkich składnikach próbki, które mogą wywoływać efekt matrycowy; stosowana gdy poszczególne próbki różnią się od siebie matrycą; Ograniczenia metody dodatku wzorca może być stosowana gdy sygnał jest wprost proporcjonalny do stężenia lub jego określonej funkcji np. log c; zależność nie zawsze jest prostoliniowa co może powodować, że ekstrapolacja daje zaniżone lub zawyżone wyniki; forma chemiczna lub zachowanie dodawanego wzorca analitu nie zawsze jest identyczne z zachowaniem lub formą analitu obecnego w próbce, dlatego metodę stosuje się w praktyce jedynie do próbek w roztworze, gdy jest wysoce prawdopodobne że analit jest w tej samej postaci; metoda nie eliminuje błędów wywołanych wpływem interferencji addytywnych, powodujących równoległe przesunięcie wykresu.

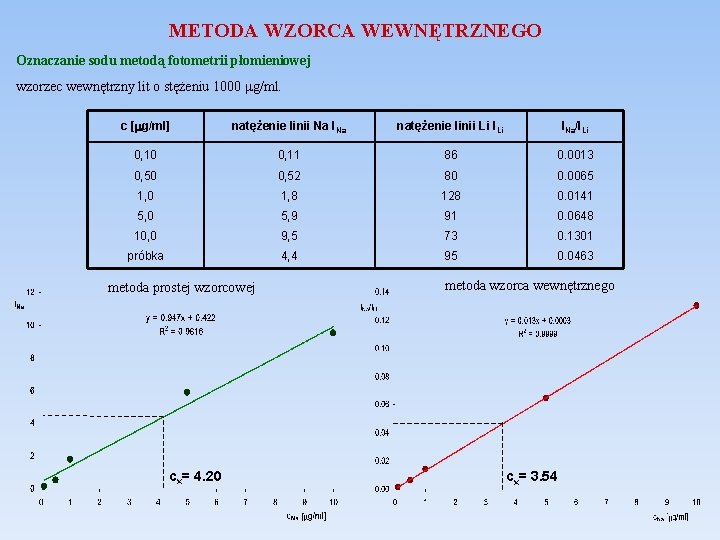
METODA WZORCA WEWNĘTRZNEGO Wzorzec wewnętrzny to substancja odniesienia o właściwościach chemicznych i fizycznych podobnych do właściwości analitu, która z nim w żaden sposób nie oddziałuje. Sygnał analityczny uzyskiwany od wzorca wewnętrznego powinien być dobrze oddzielony od sygnału analitu. Znaną ilość wzorca wewnętrznego dodaje się do: próbek, roztworów wzorcowych, ślepej próby. Przygotowanie prostej wzorcowej 1. Przygotowanie 3 -8 roztworów wzorcowych o znanej zawartości analitu xw (stężenie, masa, liczba moli) oraz znanej ilości wzorca wewnętrznego. 2. Pomiar sygnału analitycznego Yw dla roztworów wzorcowych i zawartego w nich wzorca wewnętrznego Yso. 3. Przygotowanie próbki i dodatek znanej ilości wzorca wewnętrznego. 4. Pomiar sygnału analitycznego dla próbki Yx i zawartej w niej substancji odniesienia Yso. 5. Wykreślenie prostej kalibracyjnej:

METODA WZORCA WEWNĘTRZNEGO Oznaczanie sodu metodą fotometrii płomieniowej wzorzec wewnętrzny lit o stężeniu 1000 mg/ml. c [mg/ml] natężenie linii Na INa natężenie linii Li INa/ILi 0, 10 0, 11 86 0. 0013 0, 50 0, 52 80 0. 0065 1, 0 1, 8 128 0. 0141 5, 0 5, 9 91 0. 0648 10, 0 9, 5 73 0. 1301 próbka 4, 4 95 0. 0463 metoda prostej wzorcowej cx= 4. 20 metoda wzorca wewnętrznego cx= 3. 54

Zalety metody wzorca wewnętrznego pozwala przybliżyć warunki podczas kalibracji do warunków pomiaru sygnału dla próbki; sygnał analityczny zdefiniowany jako stosunek sygnału analitu do sygnału wzorca wewnętrznego umożliwia wyeliminowanie wpływów matrycy, które w taki sam sposób oddziaływają na obie substancje; pozwala zmniejszyć wpływy związane ze zmiana stężenia analitu w czasie przygotowywania próbki np. . niecałkowita ekstrakcja; pozwala wyeliminować wpływ niektórych interferencji związanych ze składem próbki; pozwala zminimalizować wpływ warunków pomiarowych na sygnał analityczny. Wzorzec wewnętrzny powinien spełniać następujące wymagania: nie występuje w próbkach pierwotnych, właściwości fizyko-chemiczne są podobne do analitu. Jest to szczególnie istotne na etapie przygotowania próbek (oczyszczania, wzbogacania czy derywatyzacji), powinien być możliwie wysokiej czystości, stabilny chemicznie odpowiedź detektora dla wzorca wewnętrznego powinna być zbliżona do odpowiedzi substancji oznaczanych

METODA PORÓWNANIA ZE WZORCEM Najszybsza i najprostsza z metod, obarczona jednak największym prawdopodobieństwem wystąpienia błędów. Wykonanie pomiaru 1. Przygotowanie roztworu wzorcowego o znanej zawartości analitu xw (stężenie, masa, liczba moli). 2. Przygotowanie roztworu próbki o zawartości analitu x. P. 3. Pomiar sygnału analitycznego Yw dla roztworu wzorcowego. 4. Pomiar sygnału analitycznego YP dla roztworu próbki. 5. Porównanie uzyskanych sygnałów analitycznych przy założeniu, że zależność sygnałów analitycznych od stężenia analitu spełnia zależność Y = ax: Yw = k x w i YP = k x. P Najczęściej procedurę tę stosuje się do: stwierdzenia czy stężenie analitu jest mniejsze czy większe od pewnej wartości progowej. wyznaczenia przybliżonego stężenia analitu.

W doborze techniki instrumentalnej kierujemy się kryteriami: 1. Precyzja i dokładność – ile czasu i uwagi będzie wymagała analiza. 2. Ilość dostępnej próbki – jaka musi być czułość metody. 3. Zakres stężeń analitu. 4. Skład próbki mogący mieć wpływ na przebieg analizy – selektywność metody. 5. Fizyczne i chemiczne właściwości matrycy – metody analizy cieczy lub gazów w zależności od tego jaka jest próbka. 6. Ilość próbek, które mają być analizowane i powiązany z tym koszt analizy- ekonomia. 7. Szybkość i łatwość wykonania oznaczenia. 8. Dostępność aparatury. Parametry charakteryzujące techniki analityczne: precyzja, czułość, granica detekcji, zakres liniowości wskazań, selektywność.

Błędy w analizie chemicznej: • Przypadkowe • Systematyczne • Grube Błędy przypadkowe są niewielkie, a ich dokładna przyczyna nie jest znana. Błędy systematyczne mają charakter stały, powodują zmianę sygnału zawsze w tym samym kierunku i mają ściśle określoną przyczynę, często błędy te można usunąć przez korektę postępowania w trakcie wykonywania analizy. Błędy grube powstają na skutek niedopatrzenia lub winy wykonawcy, mogą być powodowane złym pobraniem próbki, błędami obliczeń, nieodpowiednim doborem procedury.

Wybór metody analitycznej • Na ile odtwarzalna? - Precyzja • Na ile zbliżony wynik do wartości rzeczywistej? Dokładność • Jak małe zmiany mogą zostać zmierzone? - Czułość • W jakim zakresie wartości? – Zakres liniowy • Jak bardzo przeszkadzają inne substancje? Selektywność • Jak wiele próbek? – Wydajność (czas, koszt analizy)

Precyzja • Błędy nieokreślone lub przypadkowe • Bezwzględne odchylenie standardowe: • • średnie odchylenie kwadratowe : s 2 Względne odchylenie standardowe: RSD = Współczynnik zmienności: CV = % RSD Odchylenie standardowe wartości średniej: sm =

Dokładność • Charakteryzuje błędy pochodzące od operatora, metody, instrumentów… • Błąd systematyczny: μ – x true

Czułość • Czułość kalibracji: Im większe nachylenie krzywej kalibracyjnej m, tym bardziej czułe są wykonywane pomiary

Granica oznaczalności • Sygnał musi być większy niż przypadkowy poziom szumów ślepej próby • Minimalny sygnał: Sygnał min = Śr. Sygnał blank + k.Sygnał blank • Na podstawie statystyki i charakterystyki (na poziomie 95%. Poziomu ufności) k = sygnał/szum >= 3

Zakres liniowy • Na poziomie granicy wykrywalności można stwierdzić, że analit jest obecny w próbce, ale nie można przeprowadzić analizy ilościowej • Granica oznaczalności (LOQ): k = 10 • Granica liniowości (LOL): gdy sygnał nie jest dłużej proporcjonalny do stężenia • Zakres liniowy: LOL / LOQ = 102 do > 106

Selektywność • Żadna metoda analityczna nie jest wolna od wpływu substancji przeszkadzających. Najlepsza metoda jest bardziej czuła w stosunku do analitu aniżeli interferentów. • Matryca zawierająca związki A&B: Sygnał = m A c A +m B c B + Sygnał blank • Współczynnik selektywności: k B, A = m B / m A k mają wartość pomiędzy 0 (brak selektywności) a dużą liczbą (wysoce selektywne).

Do zobaczenia za tydzień
 Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Instrumentalna analiza
Instrumentalna analiza Krajša instrumentalna skladba
Krajša instrumentalna skladba Henryk ross lodz ghetto photos
Henryk ross lodz ghetto photos Metalpol lodz
Metalpol lodz Apd uni lodz
Apd uni lodz Eksoc uni lodz
Eksoc uni lodz Technikum nr 19 łódź
Technikum nr 19 łódź Lodz nightlife
Lodz nightlife Ppp3 lodz
Ppp3 lodz Dariusz walczak md
Dariusz walczak md Dariusz krok
Dariusz krok Dariusz chojecki
Dariusz chojecki Dariusz wardowski
Dariusz wardowski Dariusz nieć
Dariusz nieć Dariusz budrowski łomża
Dariusz budrowski łomża Powygryzane przez mole
Powygryzane przez mole Falowniki zasada działania
Falowniki zasada działania Dariusz turlej
Dariusz turlej Krklegal
Krklegal Dariusz łobejko
Dariusz łobejko Dariusz fabicki
Dariusz fabicki Dr dariusz nowak
Dr dariusz nowak Dariusz caban pwr
Dariusz caban pwr Dariusz felcenloben
Dariusz felcenloben Dariusz kessel
Dariusz kessel Dariusz żebiełowicz
Dariusz żebiełowicz Analiza wagowa
Analiza wagowa Transakciona analiza
Transakciona analiza Analiza la siguiente situación
Analiza la siguiente situación Situaciona analiza
Situaciona analiza Pretilnost
Pretilnost Analiza senzoriala a berii
Analiza senzoriala a berii Finansijska analiza
Finansijska analiza Biografia e ndre mjedes
Biografia e ndre mjedes Jednoczynnikowa analiza wariancji
Jednoczynnikowa analiza wariancji Bilanci i gjendjes
Bilanci i gjendjes Biljeske jedne gimnazijalke
Biljeske jedne gimnazijalke Poruka price radoznali djecak
Poruka price radoznali djecak Zerat e bilancit
Zerat e bilancit Lca analiza
Lca analiza Keš flou
Keš flou Kako podeliti pricu na celine
Kako podeliti pricu na celine Korelacija i regresija
Korelacija i regresija Steep analiza
Steep analiza Analiza swot kfc
Analiza swot kfc Cesta skender kulenovic tekst
Cesta skender kulenovic tekst Analiza e konkurrences
Analiza e konkurrences Uokvirena kompozicija
Uokvirena kompozicija Ilijada
Ilijada