ANALITYCZNE ASPEKTY OZNACZENIA ENZYMW I ICH PRZYDATNO DIAGNOSTYCZNA





































- Slides: 39

ANALITYCZNE ASPEKTY OZNACZENIA ENZYMÓW I ICH PRZYDATNOŚĆ DIAGNOSTYCZNA. PROBLEMY ANALITYCZNE OZNACZANIA BILIRUBINY Gabriela Gołąb III rok OAM grupa A 1

ENZYMY Wielkocząsteczkowe, w większości białkowe, katalizatory przyspieszające specyficzne reakcje chemiczne poprzez obniżenie ich energii aktywacji Enzym katalizuje reakcje przekształcania substratów w produkty, a szybkość tej reakcji jest zależna od ilości aktywnego enzymy w środowisku reakcji

ENZYMY JEDNOSTKI AKTYWNOŚCI ENZYMÓW: 1 JEDNOSTKA (1 UNIT) – to taka ilość enzymu, która w standardowych warunkach katalizuje powstawanie lub rozpad 1 mikromola substratu/produktu w ciągu 1 min • 1 KATAL (1 KAT)– to taka ilość enzymu, która w standardowych warunkach przekształca 1 mol substratu w ciągu 1 s (jednostka zgodna z układem SI) 1 kat = 6∙ 107 U 1 U = 16, 67∙ 10 -9 kat = 16, 67 nkat

ENZYMY Apoenzymy – części białkowe enzymów Koenzymy – drobnocząsteczkowe związki organiczne lub jony nieorganiczne, których obecność w centrum aktywnym jest niezbędna do katalitycznego działania enzymu (koenzym silnie związany z cząsteczką białka = grupa prostetyczna) Grupy prostetyczne i koenzymy (kosubstraty) ulegają przemianie podczas reakcji enzymatycznej powracają do pierwotnej postaci w wyniku reakcji wtórnej Część białkowa – decyduje o: • specyficzności w stosunku do substratu (jaki rodzaj substratu ulega przemianie) • kierunku reakcji

IZOENZYMY Zakodowane w DNA, fizycznie odmienne postacie danego enzymu – różnią się: - wrażliwością na temperaturę - wrażliwością na działanie różnych związków chemicznych - powinowactwem do substratu - ruchliwością elektroforetyczną - właściwościami immunologicznymi • katalizują tę samą reakcję • występują w różnych typach komórek lub komparmentach subkomórkowych • przykłady izoenzymów: LDH, CK, ALP

IZOFORMY Odmienne fizycznie postacie danego enzymu powstające w wyniku modyfikacji potranslacyjnej (np. glikozylacja, hydroksylacja, oksydacja)

OZNACZANIE ENZYMÓW • pomiar ilości enzymu – po jego wyizolowaniu z badanego materiału • pomiar aktywności enzymu – na podstawie szybkości katalizowanej reakcji uzyskujemy informację o ilości enzymu

STANDARYZACJA OZNACZANIE ENZYMÓW • stosowanie jednej jednostki aktywności reakcji enzymatycznej - katali • stosowanie przez producentów do kalibracji metod co najmniej drugorzędowego wzorca aktywności enzymatycznej • stosowanie szczegółowo opisanych metod • aktywność enzymu musi być stała w czasie oznaczania • mierzona aktywność enzymu musi być proporcjonalna do rozcieńczenia próbki • zakres roboczy metody musi odpowiadać zakresowi wielkości aktywności enzymu mierzonej w laboratorium • reakcję enzymatyczną należy zawsze prowadzić w temperaturze 37°C

WARUNKI REKACJI ENZYMATYCZNEJ • TEMPERATURA termostabilność enzymu – najwyższa temperatura, w której nie dochodzi jeszcze do termicznej inaktywacji enzymu • p. H I SIŁA JONOWA Optymalne p. H: 7 -8 dla większości enzymów 1, 5 pepsyna 4 -6 fosfataza kwaśna 8 -10 fosfataza alkaliczna • STĘŻENIE SUBSTRATU • INHIBITORY (substancje nisko- lub wysokocząsteczkowe lub jony)

WARUNKI REKACJI ENZYMATYCZNEJ • AKTYWATORY a. jony (Mn+2, Fe+2, Co+2, Zn+2, K+) - Zn+2 – fosfataza alkaliczna i karboksypeptydaza - Cl-, Br- - amylaza - Mg+2 – kinaza kreatynowa b. aktywatory prekursorów enzymów c. koenzymy/kosubstraty - NAD+, NADP+, FAD - dehydrogenazy - fosforan pirydoksalu (PLP) – aminotransferazy - pochodne witamin z grupy B

ENZYMY 1. Enzymy komórkowe (wskaźnikowe) – uwalniane w wyniku uszkodzenia błony komórkowej lub rozpadu komórki - mikrosomalne – GGT - lizosomalne – ACP - mitochondrialne – AST, CK, GLD - cytoplazmatyczne – ALT, LDH, AST, CK - błony plazmatyczne – ALP, GGT 2. Enzymy sekrecyjne – wydzielane do krążenia, gdzie spełniają swoją funkcję - czynniki krzepnięcia i fibrynolizy - acylotransferaza lecytyna: cholesterol (LCAT) - cholinesteraza Ch. E (pseudocholinesteraza) 3. Enzymy ekskrecyjne – produkowane przez gruczoły i wydzielane do śliny, światła przewodu pokarmowego, płynu nasiennego itp. - amylaza - lipaza

ENZYMY – WARTOŚĆ DIAGNOSTYCZNA Kwaśna fosfataza (ACP) - prostata Alkaliczna fosfataza (ALP) – wątroba, kości Amylaza - trzustka Lipaza - trzustka Dehydrogenaza mleczanowa (LDH) – wątroba, serce • Transaminaza Asparanginowa (AST) – wątroba, serce • Transaminaza Alaninowa (ALT) – wątroba, serce • Kinaza Kreatynowa (CK) – serce , mięśnie, mózg • • •

ENZYMY – STOSOWANE UKŁADY POMIAROWE 1. Test optyczny 2. Analogi naturalnych substratów a. Fosfatazy ( p-nitrofenylofosforan, a-naftylofosforan b. Amylaza (p-nitrofenylo-D-maltoheptozyd, 2 -chloro-p-nitrofenyloa. D-maltotriozyd 3. Substancje, z których pod wpływem enzymów powstają barwne produkty reakcji (3, 3’, 5, 5’-tetrametylobenzydyna (TMB)) 4. Przeciwciała – metody immunoturbidymetryczne, radioimmunologiczne, immunoenzymatyczne

PRZYKŁADY ENZYMÓW

FOSFATAZA KWAŚNA - ACP • Enzym należący do hydrolaz • Katalizuje hydrolizę różnych estrów fosforanowych • Występuje w dużych stężeniach w gruczole krokowym i w chorobach kości • WZROST: choroby kości, rak prostaty, nadmierny rozpad erytrocytów lub trombocytów

FOSFATAZA ALKALICZNA (ALP) • Enzym wątroby, układu krążenia, układu kostnego • WZROST: choroby kości lub wątroby, nadmierna aktywność osteoblastów, upośledzenie wydzielania żółci, choroby jelit • Wyróżniamy kilka form izoenzymów ALP : ALPI – jelitowa ALPL – tkankowa ALPP – łożyskowa LAP – leukocytarna Metody rozdziału: a. elektroforeza żelowa b. analiza produktów denaturacji c. inhibicja mocznikiem d. techniki immunologiczne

AMINOTRANSFERAZY • Enzymy wątroby, układu krążenia • Niespecyficzne enzymy indykatorowe, biorące udział w przemianach białek • Transferazy – przenoszą grupy aminowe z aminokwasów na alfa-ketokwasy • PLP – koenzym

AMINOTRANSFERAZA ASPARAGINIANOWA (AST) • Występuje w cytoplazmie i mitochondriach komórek wątroby, w mięśniach, kanalikach nerkowych i erytrocytach • Katalizuje reakcje : alfa-ketoglutaran + Lasparanginian -> L-glutaminian + szczawiooctan • Normalny zakres : 5 -34 U/L • WZROST: uszkodzenie wątroby, nerek, mięśni szkieletowych, w zawale mięśnia sercowego

AMINOTRANSFERAZA ASPARAGINIANOWA (AST) OZNACZANIE: • Metoda Karmena: L-asparanginian+alfaketoglutaron L-glutaminian + szczawiooctan • Szczawiooctan + NADH+ H+ jabłaczan + NAD+ • Mierzenie spadku absorbcji przy 340 nm , który jest proporcjonalny do aktywności enzymu

AMINOTRANSFERAZA ALANINIOWA (ALT) • Występuje w cytoplaźmie komórek wątroby i w mięśniach poprzecznię prążkowanych serca • Katalizuje reakcje : alfa-ketoglutaran + alanina glutaminian + pirogronian • Normalny zakres : 10 -40 U/L • WZROST: uszkodzenie wątroby, mięśni szkieletowych, w zawale mięśnia sercowego

AMINOTRANSFERAZA ALANINIOWA (ALT) OZNACZANIE: Metoda Wróblewskiego i La Due’ego: • L-alanina + alfa-ketoglutaron L-glutaminian + pirogronian • Pirogronian + NADH+ H+ mleczan + NAD+ • Mierzenie spadku absorbcji przy 340 nm, który jest proporcjonalny do aktywności enzymu

Znaczenie kliniczne aminotransferaz WZROST AKTYWNOŚCI: • 100 x – ciężkie uszkodzenie wątroby • 10 -30 x – ostre WZW • 100 -1000 U/L autoimmunologiczne zapalenie wątroby • 1, 5 -5 x – marskość wątroby • 2 -3 x – zastój w krążeniu wrotnym, cholestaza, przewlekłe choroby mięśni, ONN

WSKAŹNIK DE RITISA • • Jest to stosunek aktywności aminotransferazy asparaginowej do aminotransferazy alaninowej (AST/ALT) Prawidłowo: wkaźnik >1 >2 – alkoholowe zapalenie wątroby <1 – ostre wirusowe zapalenie wątroby >1 – przewlekłe zapalenie wątroby >2 – zawał serca (2 doba)

KINAZA KREATYNOWA (CK) • Katalizuje odwracalną reakcję przenoszenia grupy fosforanowej na ADP regenerując ATP lub z ATP na kreatynę odbudowując zapasy fosfokreatyny • NORMA : 0 -16 U/L • Znaczenie kliniczne: choroby mięśni szkieletowych, serca, choroby OUN, tarczycy

DEHYDROGENAZA MLECZANOWA (LDH) • Katalizuje odwracalną konwersję mleczanu w pirogronianian i odwrotnie • Kofaktor: NADH/NAD+ • NORMA: 80 -285 U/L • WZROST: hemoliza erytrocytów, rozpad tkanek, zawał mięśnia sercowego (8 -12 h po ustąpieniu bólu) • Niewielki wzrost: choroby wątroby, anemia, choroby nerek, dystofia mięśni

LDH - IZOENZYMY • • • LD 1 – serce, erytrocyty LD 2 – leukocyty LD 3 – płuca LD 4 – nerki, łożysko LD 5 – mięśnie, wątroba Metoda rozdzielania i oznaczania izoenzymów LDH: a. Elektroforeza żelowa b. Selektywne metody chemicznej inhibicji c. Chromatografia jonowymienna d. Immunostrącanie

AMYLAZA Występuje w soku trzustkowym i w ślinie Zapoczątkowuje proces trawienia skrobi NORMA: 35 -140 U/L WZROST: zapalenie trzustki, urazy ślinianek, alkoholizm, świnka, niewydolność nerek • Metody oznaczania: -metoda skrobiowa (test sacharogeniczny, amyoklastyczny, chromogeniczny) -metoda z innymi substratami • •

LIPAZA • Hydrolizuje wiązania estrowa TG, czego produktami są WKT i gliceryna • NORMA: 0 -62 U/L • WZROST: choroby trzustki, perforacja wrzodu żołądka • Metody oznaczania: a. miareczkowanie kwas-zasada b. turbinymetria c. Spektrofotometria d. test immunologiczny

BILIRUBINA • Pomarańczowoczerwony barwnik żółciowy, produkt rozpadu hemoglobiny i innych hemoprotein • Bilirubina jest związkiem słabo rozpuszczalnym w wodzie, stąd w osoczu krwi transportowana jest w połączeniu z białkiem – albuminą. Frakcja bilirubiny nietrwale związanej z albuminami nazywana jest bilirubiną wolną lub pośrednią. Bilirubina wolna nie przedostaje się do moczu, może jednak przenikać barierę krewmózg • Bilirubina wolna transportowana jest do wątroby, gdzie ulega dalszym przemianom do rozpuszczalnej w wodzie bilirubiny związanej (bezpośredniej), przez co traci zdolność przenikania bariery krew-mózg i przestaje być związkiem neurotoksycznym. UDP-glukuronozylotransferaza sprzęga bilirubinę z kwasem glukuronowym (glukuronianem)

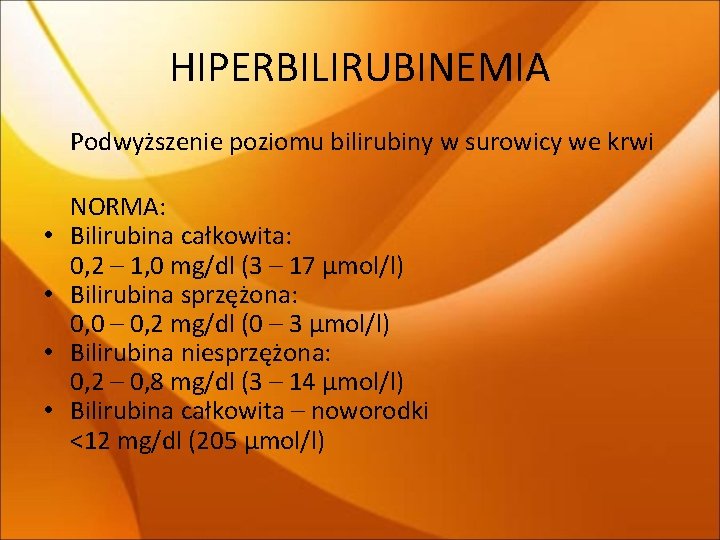
HIPERBILIRUBINEMIA Podwyższenie poziomu bilirubiny w surowicy we krwi • • NORMA: Bilirubina całkowita: 0, 2 – 1, 0 mg/dl (3 – 17 μmol/l) Bilirubina sprzężona: 0, 0 – 0, 2 mg/dl (0 – 3 μmol/l) Bilirubina niesprzężona: 0, 2 – 0, 8 mg/dl (3 – 14 μmol/l) Bilirubina całkowita – noworodki <12 mg/dl (205 μmol/l)

ZABURZENIA METABOLIZMU BILIRUBINY • HIPERBILIRUBINEMIA WOLNA ü Fizjologicznie u noworodków ü Hemoliza i zaburzenia erytropoezy ü Zespół Criglera-Najjara (wrodzony niedobór UGT) ü Zespół Gilberta (zredukowana aktywność transferazy lub zaburzony transport do hepatocytów)

ZABURZENIA METABOLIZMU BILIRUBINY • HIPERBILIRUBINEMIA POŚREDNIA ü Cholestaza węwnątrzwątrobowa wrodzona – zespół Dublin-Johnsona, zespół Rotora nabyta – marskość wątroby, alkoholizm, żywienie pozajelitowe, posocznica ü Cholestaza zewnątrzwątrobowa zamknięcie dróg żółciowych od wewnątrz (kamienie żółciowe, nowotwory) ucisk dróg żółciowych z zewnątrz

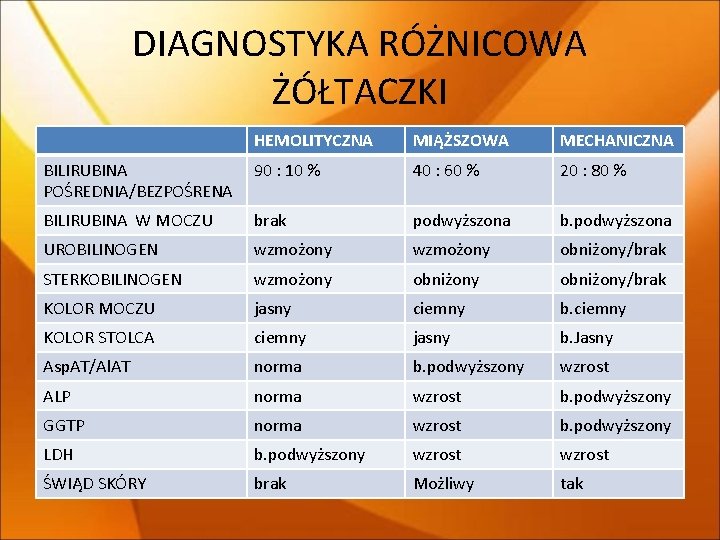
DIAGNOSTYKA RÓŻNICOWA ŻÓŁTACZKI HEMOLITYCZNA MIĄŻSZOWA MECHANICZNA BILIRUBINA POŚREDNIA/BEZPOŚRENA 90 : 10 % 40 : 60 % 20 : 80 % BILIRUBINA W MOCZU brak podwyższona b. podwyższona UROBILINOGEN wzmożony obniżony/brak STERKOBILINOGEN wzmożony obniżony/brak KOLOR MOCZU jasny ciemny b. ciemny KOLOR STOLCA ciemny jasny b. Jasny Asp. AT/Al. AT norma b. podwyższony wzrost ALP norma wzrost b. podwyższony GGTP norma wzrost b. podwyższony LDH b. podwyższony wzrost ŚWIĄD SKÓRY brak Możliwy tak

METODY OZNACZANIA BILIRUBINY 1. WYSOKOSPRAWNA CHROMATOGRAFIA CIECZOWA (HPLC) pozwala rozdzielić bilirubinę na 4 frakcje: a. b. c. d. alfa – frakcja bilirubiny wolnej beta – frakcja bilirubiny sprzężonej (monoglukuronid bilirubiny) gamma – frakcja bilirubiny sprzężonej (diglukuronid bilirubiny) delta – frakcja bilirubiny sprzężonej, związanej kowalencyjnie z albuminami; nie występuje u osób zdrowych i pojawia się przy wysokich, utrzymujących się stężeniach bilirubiny sprzężonej; utrzymuje się we krwi ok. 2 tygodni Metoda HPLC nie ma szerokiego zastosowania w rutynowej diagnostyce.

METODY OZNACZANIA BILIRUBINY 2. REAKCJA EHRLICHA – reakcja w której dwuazowany kwas sulfanilowy reaguje z bilirubiną z wytworzeniem dwóch barwnych izomerów (p. H obojętne – kolor purpurowy, p. H kwaśne lub zasadowe – kolor niebieski 3. METODA DER BERGA I MULLERA – gdzie po dodaniu alkoholu następuje przyspieszenie sprzęgania bilirubiny frakcja BR reagująca bez dodatku alkoholu – BR bezpośrednia frakcja BR nie reagująca bez dodatku alkoholu – BR pośrednia *dodatek alkoholu powoduje zmętnienie

METODY OZNACZANIA BILIRUBINY 4. METODA JENDRASSIKA I GROFA • BR całkowita – do roztworu dodaje się odczynnika kofeionowo-benzoesowego, a następnie dwufazowy kwas sulfanilowy. Reagują wszystkie formy BR. Następnie dodaje się kwas askorbinowy, winian i HCl. Mierzenie absorbancji 600 nm • BR związana – roztwór zakwasza się HCl i dodaje się dwuazowany kwas sulfanilowy. Z odczynnikiem reaguje tylko zestryfikowana BR i delta-BR. Następnie dodaje się kwas askorbinowy, winian i odczynnik kofeionowobenzoesowy. Mierzenie absorbancji 600 nm

METODY OZNACZANIA BILIRUBINY W MOCZU • Przy użyciu testów paskowych • Ekspozycja na światło powoduje rozpad bilirubiny • Wyniki fałszywie dodatnie: NSLPZ • Wyniki zaniżone: wysokie stężenie witaminy C, azotyny, ekspozycja na światło

BILIRUBINOMETR • Urządzenie do nieinwazyjnego przeskórnego pomiaru poziomu bilirubiny u noworodków. • Na pomiar nie ma wpływu płeć, wiek urodzeniowy, rasa ani waga noworodka. • Po zwirowaniu krwi należy zmierzyć bezpośrednio absorbancje w spektrofotometrze przy dwóch długościach fali

DZIĘKUJĘ ZA UWAGĘ
 Aspekty hry
Aspekty hry Psychopedagogiczne aspekty hipoterapii
Psychopedagogiczne aspekty hipoterapii Ich freue mich wenn ich dich seh ich finde dich so nett
Ich freue mich wenn ich dich seh ich finde dich so nett Budowa enzymu
Budowa enzymu Biaek
Biaek Enzymy indykatorowe
Enzymy indykatorowe Chropowatość
Chropowatość Oznaczenia samochodów pożarniczych
Oznaczenia samochodów pożarniczych Bpmn oznaczenia
Bpmn oznaczenia Oznaczenia słupków w samochodzie
Oznaczenia słupków w samochodzie Oznaczenia na skalach mierników
Oznaczenia na skalach mierników Rezystor kod paskowy
Rezystor kod paskowy Oznaczenia szlaków górskich
Oznaczenia szlaków górskich Oznaczenia ekologiczne na opakowaniach
Oznaczenia ekologiczne na opakowaniach Oznaczenia rezystorów
Oznaczenia rezystorów Symbole bramek logicznych
Symbole bramek logicznych Oznakowanie miejsc składowania w magazynie
Oznakowanie miejsc składowania w magazynie Sehnsucht ulla hahn 1945
Sehnsucht ulla hahn 1945 Ich revirom je dialnica
Ich revirom je dialnica Ich habe keine wespentaille ich habe eine hummelhüfte
Ich habe keine wespentaille ich habe eine hummelhüfte Ich kenne dich nicht aber ich mag dich
Ich kenne dich nicht aber ich mag dich Ich segle gerne
Ich segle gerne Ich, du
Ich, du Ich bin du bist er ist
Ich bin du bist er ist Ich liege nur noch rum
Ich liege nur noch rum Malen konjugation
Malen konjugation Ich werde du wirst
Ich werde du wirst Annex q
Annex q Wer bin ich josef guggenmos lösung
Wer bin ich josef guggenmos lösung Qarshi davlat universiteti ikkinchi mutaxassislik
Qarshi davlat universiteti ikkinchi mutaxassislik ıch du er sie es
ıch du er sie es Ich tues
Ich tues Possessive pronominer tysk
Possessive pronominer tysk Matematika shakllari
Matematika shakllari Chmury rodzaje
Chmury rodzaje Quality risk assessment example
Quality risk assessment example Ich botschaften beispiele
Ich botschaften beispiele Ich bin aufgestanden
Ich bin aufgestanden Gefunden goethe stilmittel
Gefunden goethe stilmittel Andrej hnilica
Andrej hnilica