Amoniac v mui am ni Dnh cho hc











- Slides: 23

Amoniac vµ muèi am «ni Dµnh cho häc sinh líp 11 PTTH ( 2 tiÕt )

Amoniac vµ muèi am «ni A. Amoniac ( NH 3 ) I. CÊu t¹o ph©n tö. II. TÝnh chÊt vËt lý. III. TÝnh chÊt ho¸ häc. IV. øng dông. V. §iÒu chÕ.

Amoniac vµ muèi am «ni B. Muèi am «ni I. TÝnh chÊt vËt lÝ. II. TÝnh chÊt ho¸ häc.

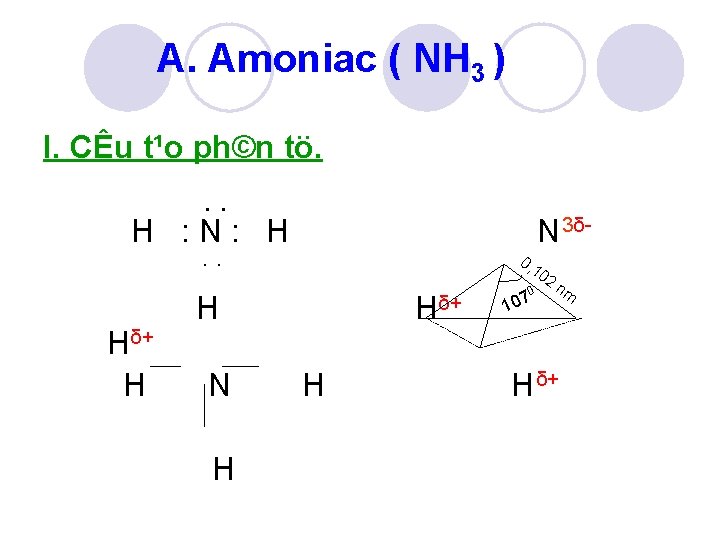
A. Amoniac ( NH 3 ) I. CÊu t¹o ph©n tö. . . H : N: H N 3δ . . Hδ+ H 0, 10 H N H Hδ+ H 0 107 2 nm H δ+

A. Amoniac (NH 3) II. TÝnh chÊt vËt lÝ. Lµ chÊt khÝ, kh «ng mµu, mïi khai vµ xèc. NhÑ h¬n kh «ng khÝ. Tan nhiÒu trong n íct¹o thµnh dung dÞch amoniac

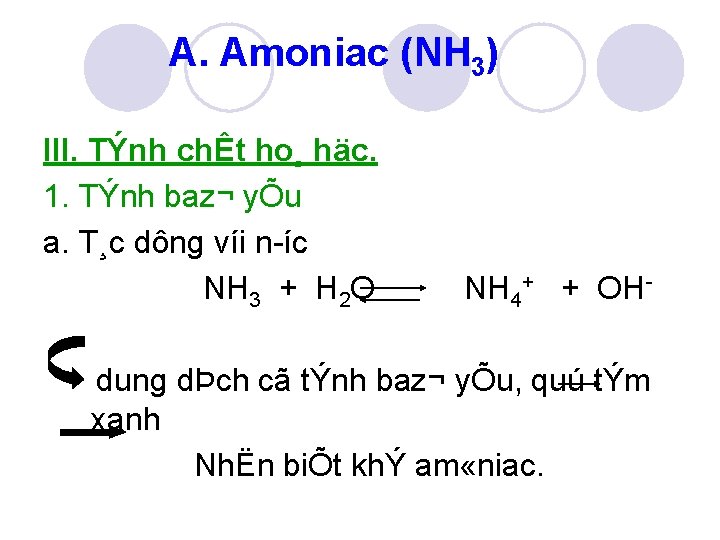
A. Amoniac (NH 3) III. TÝnh chÊt ho¸ häc. 1. TÝnh baz¬ yÕu a. T¸c dông víi n íc. NH 3 + H 2 O NH 4+ + OH dung dÞch cã tÝnh baz¬ yÕu, quú tÝm xanh NhËn biÕt khÝ am «niac.

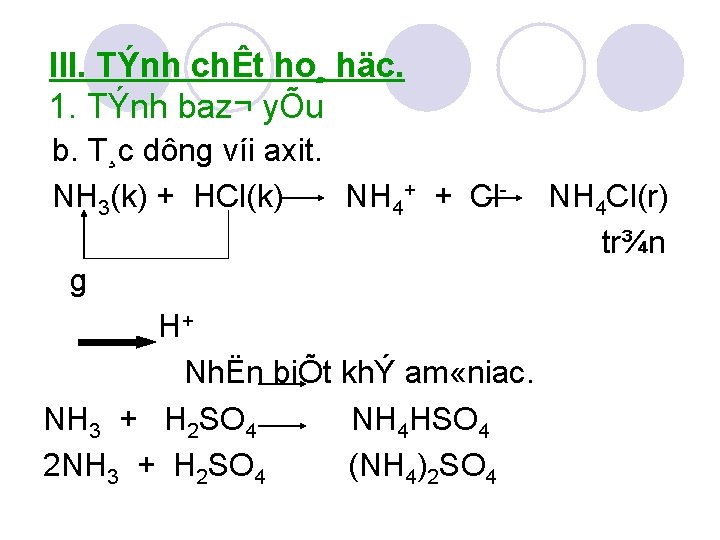
III. TÝnh chÊt ho¸ häc. 1. TÝnh baz¬ yÕu b. T¸c dông víi axit. NH 3(k) + HCl(k) NH 4+ + Cl g H+ NhËn biÕt khÝ am «niac. NH 3 + H 2 SO 4 NH 4 HSO 4 2 NH 3 + H 2 SO 4 (NH 4)2 SO 4 NH 4 Cl(r) tr¾n

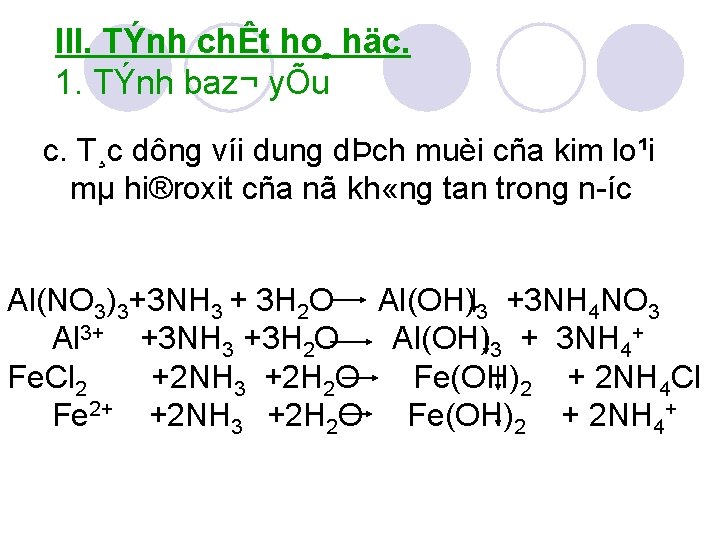
III. TÝnh chÊt ho¸ häc. 1. TÝnh baz¬ yÕu c. T¸c dông víi dung dÞch muèi cña kim lo¹i mµ hi®roxit cña nã kh «ng tan trong n íc. Al(NO 3)3+3 NH 3 + 3 H 2 O Al(OH)3 +3 NH 4 NO 3 Al 3+ +3 NH 3 +3 H 2 O Al(OH)3 + 3 NH 4+ Fe. Cl 2 +2 NH 3 +2 H 2 O Fe(OH)2 + 2 NH 4 Cl Fe 2+ +2 NH 3 +2 H 2 O Fe(OH)2 + 2 NH 4+

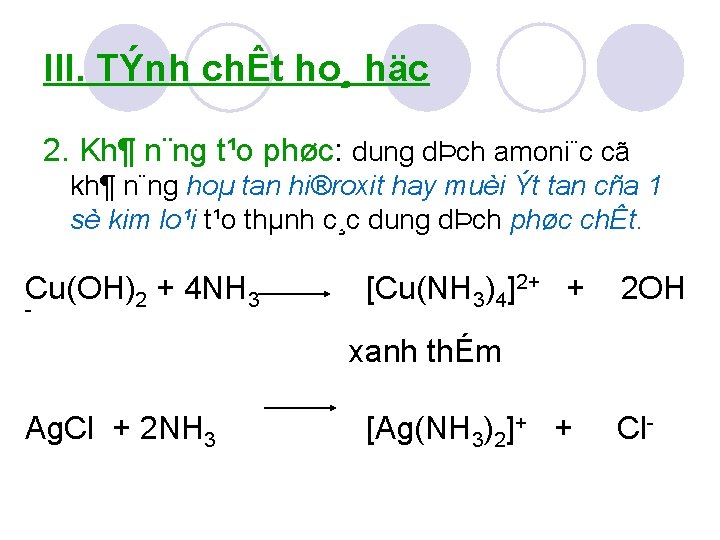
III. TÝnh chÊt ho¸ häc 2. Kh¶ n¨ng t¹o phøc: dung dÞch amoni¨c cã kh¶ n¨ng hoµ tan hi®roxit hay muèi Ýt tan cña 1 sè kim lo¹i t¹o thµnh c¸c dung dÞch phøc chÊt. Cu(OH)2 + 4 NH 3 [Cu(NH 3)4]2+ + 2 OH xanh thÉm Ag. Cl + 2 NH 3 [Ag(NH 3)2]+ + Cl

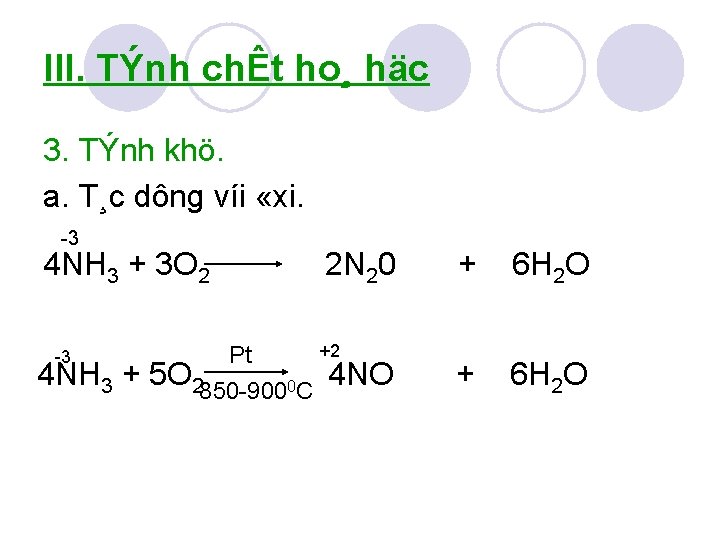
III. TÝnh chÊt ho¸ häc 3. TÝnh khö. a. T¸c dông víi «xi. 3 4 NH 3 + 3 O 2 3 4 NH 3 + 2 N 20 + 6 H 2 O +2 Pt 5 O 2850 9000 C 4 NO + 6 H 2 O

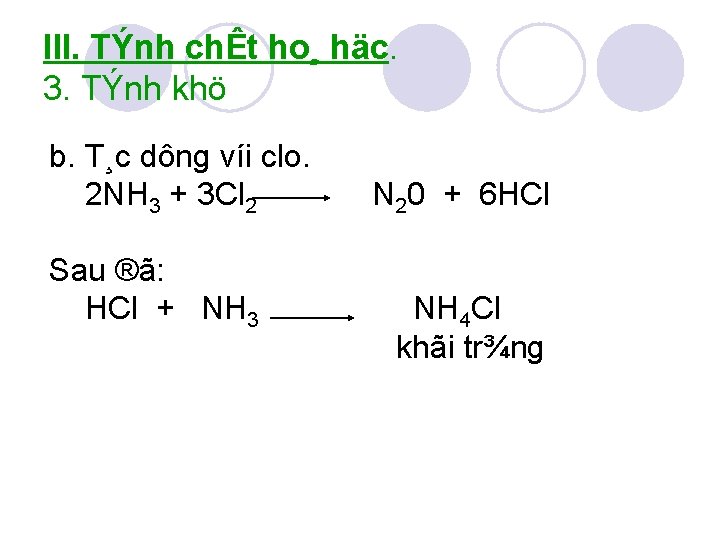
III. TÝnh chÊt ho¸ häc. 3. TÝnh khö b. T¸c dông víi clo. 2 NH 3 + 3 Cl 2 Sau ®ã: HCl + NH 3 N 20 + 6 HCl NH 4 Cl khãi tr¾ng

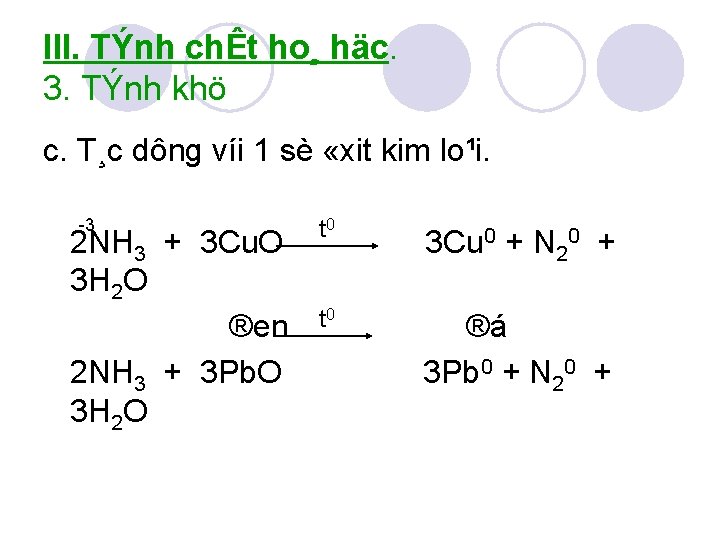
III. TÝnh chÊt ho¸ häc. 3. TÝnh khö c. T¸c dông víi 1 sè «xit kim lo¹i. 3 2 NH 3 + 3 Cu. O 3 H 2 O ®en 2 NH 3 + 3 Pb. O 3 H 2 O t 0 3 Cu 0 + N 20 + t 0 ®á 3 Pb 0 + N 20 +

IV. øng dông S¶n xuÊt HNO 3, ph©n ®¹m. §iÒu chÕ hi®razin N 2 H 4 lµm chÊt ®èt cho tªn löa. Lµm chÊt g©y l¹nh trong m¸y l¹nh.

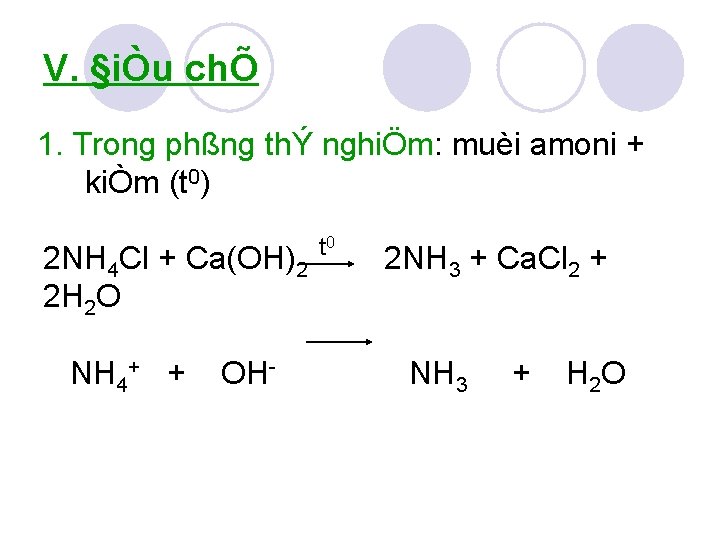
V. §iÒu chÕ 1. Trong phßng thÝ nghiÖm: muèi amoni + kiÒm (t 0) 2 NH 4 Cl + Ca(OH)2 2 H 2 O NH 4+ + OH t 0 2 NH 3 + Ca. Cl 2 + NH 3 + H 2 O

V. §iÒu chÕ 2. Trong c «ng nghiÖp. N 2(k) + H 2(k) 2 NH 3(k) H= 92 k. J C¸c yÕu tè lµm chuyÓn dÞch c©n b» ng vÒ phÝa tæng hîp NH 3: Nång ®é: gi¶m nång ®é NH 3, t¨ng nång ®é N 2 vµ H 2. ¸p suÊt: t¨ng ¸p suÊt (p thÝch hîp=300 1000 atm). T 0: h¹ t 0, t 0 thÝch hîp = 450 5000 C. Xóc t¸c: Fe ® îc ho¹t hãa b» ng Al 2 O 3, K 2 O.

b. muèi amoni I. TÝnh chÊt vËt lÝ. Muèi amoni lµ nh÷ng hîp chÊt ion mµ ph©n tö gåm cation amoni NH 4+ vµ anion gèc axit ( VD: NH 4 Cl, (NH 4)2 SO 4. . . ) Lµ chÊt kÕt tinh, kh «ng mµu. DÔ tan trong n íc.

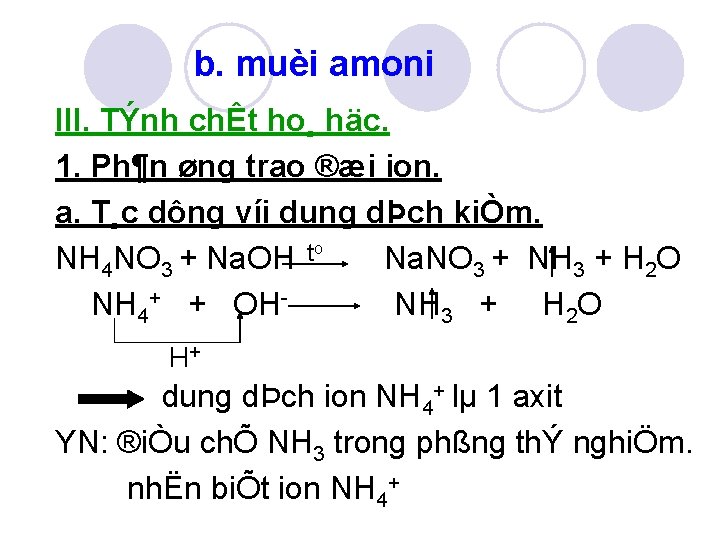
b. muèi amoni III. TÝnh chÊt ho¸ häc. 1. Ph¶n øng trao ®æi ion. a. T¸c dông víi dung dÞch kiÒm. o t NH 4 NO 3 + Na. OH Na. NO 3 + NH 3 + H 2 O NH 4+ + OH NH 3 + H 2 O H+ dung dÞch ion NH 4+ lµ 1 axit YN: ®iÒu chÕ NH 3 trong phßng thÝ nghiÖm. nhËn biÕt ion NH 4+

b. muèi amoni III. TÝnh chÊt ho¸ häc. 1. Ph¶n øng trao ®æi ion. b. T¸c dông víi dung dÞch muèi. NH 4 Cl + Ag. NO 3 NH 4 NO 3 + Ag. Cl Cl + Ag. Cl

b. muèi amoni I. TÝnh chÊt ho¸ häc. 2. Ph¶n øng nhiÖt ph©n. a. Muèi amoni t¹o bëi axit kh «ng cã tÝnh «xi t 0 ho¸ NH 3 + axit NH 4 Cl(r) to NH 3 (k) + HCl(k)

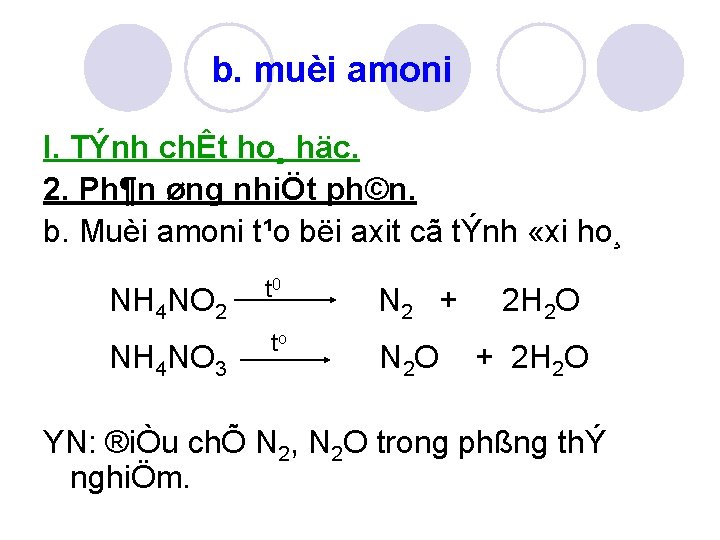
b. muèi amoni I. TÝnh chÊt ho¸ häc. 2. Ph¶n øng nhiÖt ph©n. b. Muèi amoni t¹o bëi axit cã tÝnh «xi ho¸ NH 4 NO 2 t 0 N 2 + NH 4 NO 3 to N 2 O 2 H 2 O + 2 H 2 O YN: ®iÒu chÕ N 2, N 2 O trong phßng thÝ nghiÖm.

c. LuyÖn tËp l 1. Dung dÞch amoni¨c cã thÓ hoµ tan ® îc Zn(OH)2 lµ do: a. Zn(OH)2 lµ hi®roxit l ìngtÝnh. b. Zn(OH)2 lµ 1 baz¬ Ýt tan. c. Zn(OH)2 cã kh¶ n¨ng t¹o thµnh phøc chÊt tan, t ¬ngtù nh Cu(OH)2. d. NH 3 lµ 1 hîp chÊt cã cùc vµ lµ 1 baz¬ yÕu. §¸p ¸n: c

c. LuyÖn tËp l 2. Cã thÓ ph©n biÖt muèi amoni víi c¸c muèi kh¸c b» ng c¸ch cho nã t¸c dông víi kiÒm m¹nh v× khi ®ã: a. muèi amoni sÏ chuyÓn thµnh mµu ®á. b. tho¸t ra 1 chÊt khÝ kh «ng mµu, rÊt xèc. c. tho¸t ra 1 chÊt khÝ mµu n©u ®á. d. tho¸t ra chÊt khÝ kh «ng mµu, kh «ng mïi. §¸p ¸n: b
