Ammoniak Gliederung Darstellung Eigenschaften AmmoniumSalze Nachweise Verwendung Schulrelevanz



















![Nachweise [Hg 2 N] + + + Raumnetzstruktur: A nti-Cristobalit Nachweise [Hg 2 N] + + + Raumnetzstruktur: A nti-Cristobalit](https://slidetodoc.com/presentation_image_h/b30c2261639fa80c39cd557a2fb8e80e/image-30.jpg)








- Slides: 49

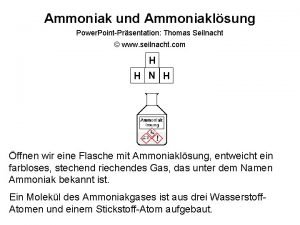
Ammoniak

Gliederung • • • Darstellung Eigenschaften Ammonium-Salze Nachweise Verwendung Schulrelevanz

Gliederung • • • Darstellung Eigenschaften Ammonium-Salze Nachweise Verwendung Schulrelevanz

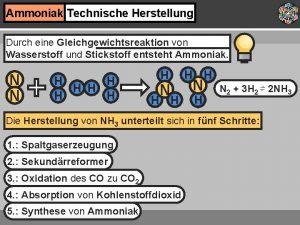
Darstellung von Ammoniak Labor: • Ammoniumsalze + Natronlauge Großtechnisch: • Rothe-Frank-Caro (Gewinnung aus Kalkstickstoff) • Serpek-Verfahren (Hydrolyse von Nitriden) • Haber-Bosch-Verfahren (aus den Elementen)

Darstellung Versuch 1 Das Haber-Bosch Verfahren

Darstellung Das Haber-Bosch-Verfahren Darstellung aus den Elementen 0 0 -3 N 2 (g) + 3 H 2 (g) +1 2 NH 3 (g) ΔH = - 92, 5 k. J Nobelpreis Produktion: 120 mio. t/Jahr Fritz Haber (1868 -1934) Carl Bosch (1874 -1940)

Darstellung Prinzip von Le Chatelier Hohe Ausbeute: • je niedriger die Temperatur • je höher der Druck • Kompromiss zwischen günstiger Gleichgewichtslage und hoher Reaktionsgeschwindigkeit Ammoniakanteile im GG

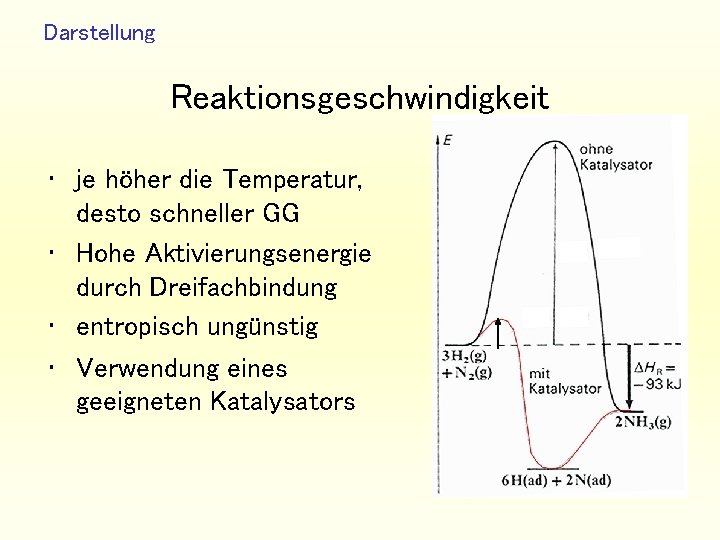
Darstellung Reaktionsgeschwindigkeit • je höher die Temperatur, desto schneller GG • Hohe Aktivierungsenergie durch Dreifachbindung • entropisch ungünstig • Verwendung eines geeigneten Katalysators

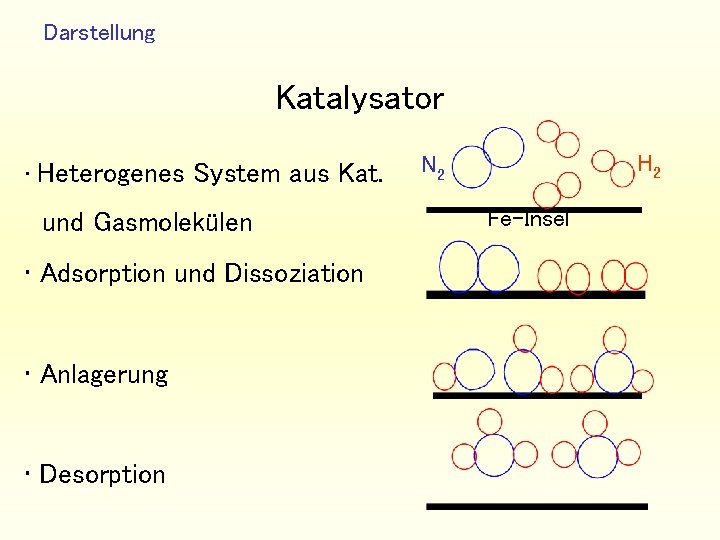
Darstellung Katalysator • Heterogenes System aus Kat. und Gasmolekülen • Adsorption und Dissoziation • Anlagerung • Desorption H 2 N 2 Fe-Insel

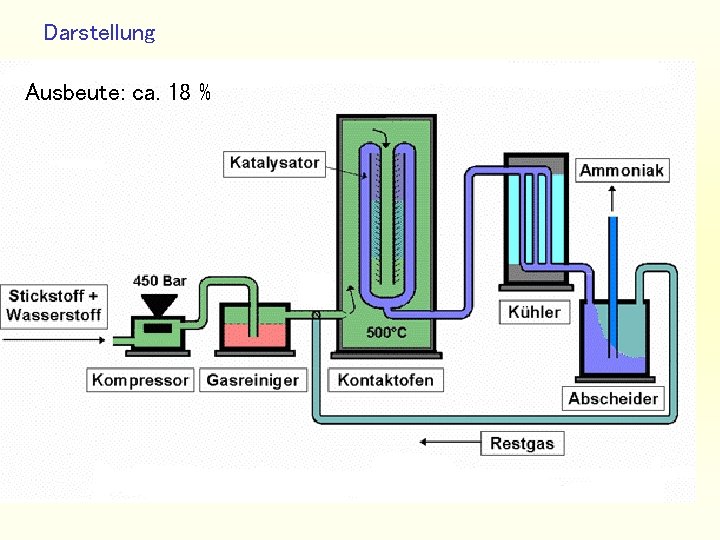
Darstellung Reaktionsbedingungen • Druck: 150 – 450 bar • Temperatur: 450 - 500°C • Mengenverhältnis Stickstoff/Wasserstoff: 1 : 3 • Katalysator: Eisen(II/III)-Oxid Fe 3 O 4 • Promotoren: K 2 O, Ca. O, Al 2 O 3 und Si. O 2

Darstellung Promotoren Al 2 O 3: struktureller Promotor K 2 O: elektronischer Promotor Ca. O: Stabilisierung der Makrostruktur Stabilisierung der Struktur und Verbesserung der Aktivität des Katalysators

Darstellung Ausbeute: ca. 18 %

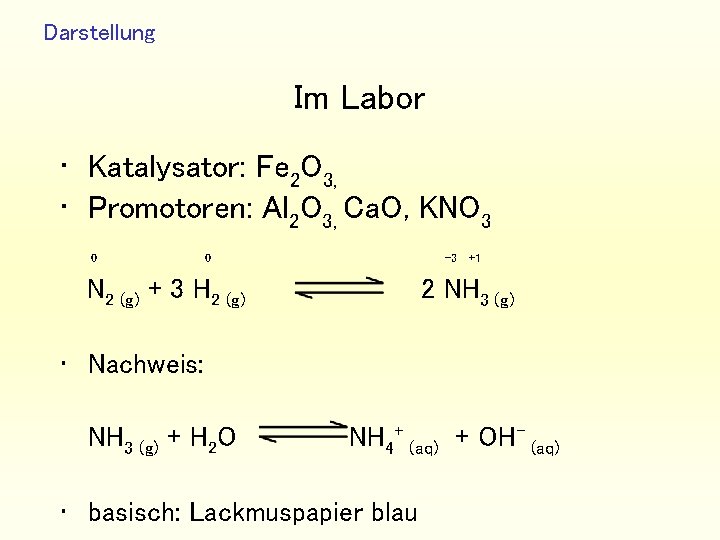
Darstellung Im Labor • Katalysator: Fe 2 O 3, • Promotoren: Al 2 O 3, Ca. O, KNO 3 0 0 -3 N 2 (g) + 3 H 2 (g) +1 2 NH 3 (g) • Nachweis: NH 3 (g) + H 2 O NH 4+ (aq) + OH- (aq) • basisch: Lackmuspapier blau

Gliederung • Darstellung • Eigenschaften • Ammonium-Salze • Nachweise • Verwendung • Schulrelevanz

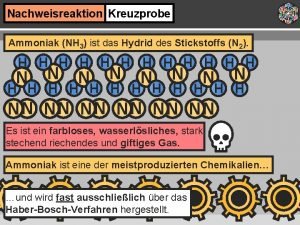
Eigenschaften von Ammoniak • • • pyramidenförmig, Bindungswinkel 107° farblos, riecht stechend, giftig, ätzend Smp. – 78°C, Sdp. – 33°C Bildung von H-Brücken Inversion δ - δ+

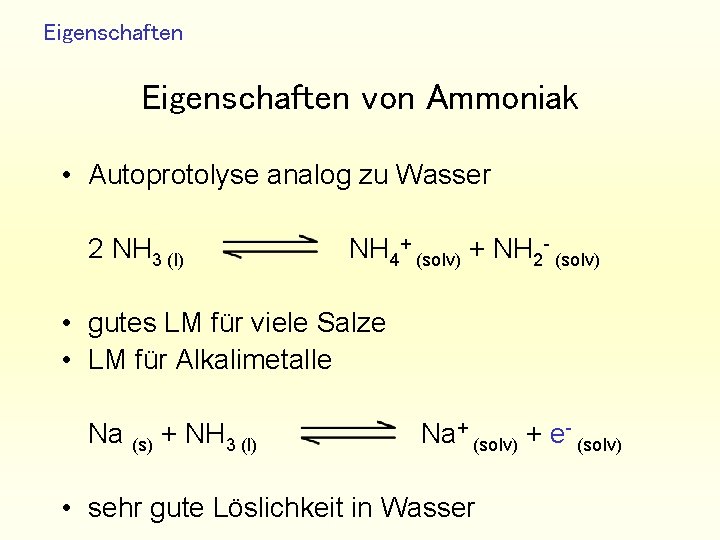
Eigenschaften von Ammoniak • Autoprotolyse analog zu Wasser 2 NH 3 (l) NH 4+ (solv) + NH 2 - (solv) • gutes LM für viele Salze • LM für Alkalimetalle Na (s) + NH 3 (l) Na+ (solv) + e- (solv) • sehr gute Löslichkeit in Wasser

Eigenschaften Versuch 2 Löslichkeit von Ammoniak in Wasser - Der „Springbrunnen“ -

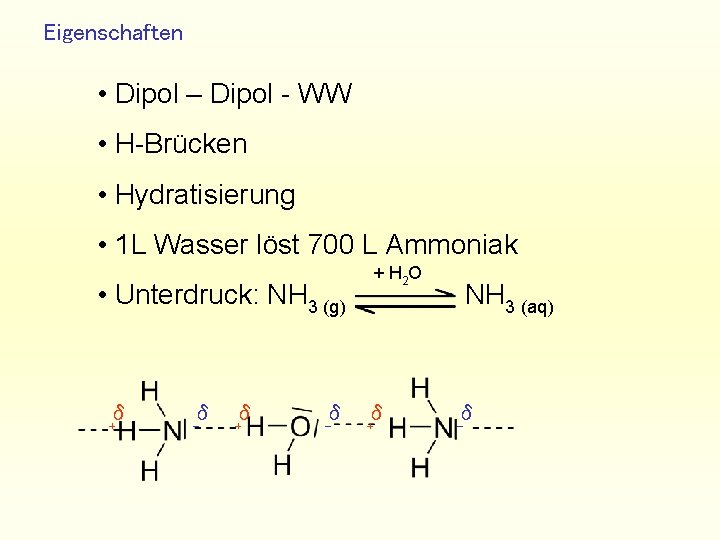
Eigenschaften • Dipol – Dipol - WW • H-Brücken • Hydratisierung • 1 L Wasser löst 700 L Ammoniak + H 2 O • Unterdruck: NH 3 (g) δ + δ - δ + NH 3 (aq) δ -

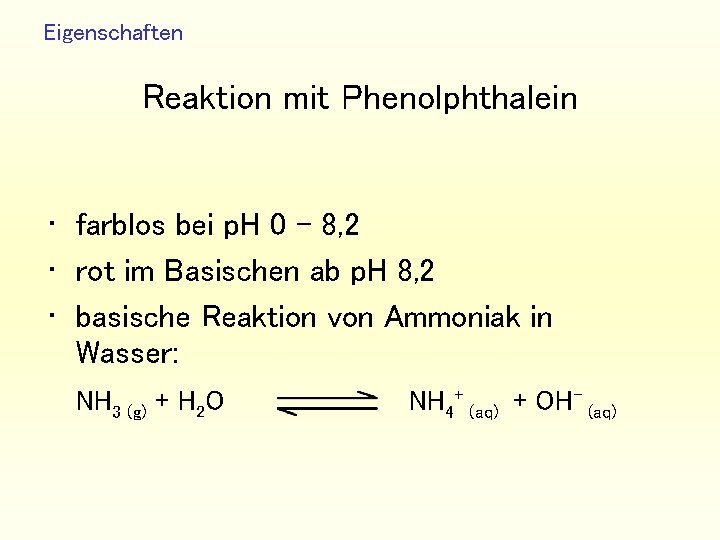
Eigenschaften Reaktion mit Phenolphthalein • farblos bei p. H 0 – 8, 2 • rot im Basischen ab p. H 8, 2 • basische Reaktion von Ammoniak in Wasser: NH 3 (g) + H 2 O NH 4+ (aq) + OH- (aq)

Eigenschaften + 2 OH- - H 2 O 2 - - + 2 H+ lactoide Form (farblos) 2 - - chinoide Form

Eigenschaften Versuch 3 Nachweis von Ammoniak in Harnstoff

Eigenschaften Zersetzung von Harnstoff Carbamidsäure Δ (s) + H 2 O • Nachweis: Indikatorpapier + (g) (aq) (g) + (g)

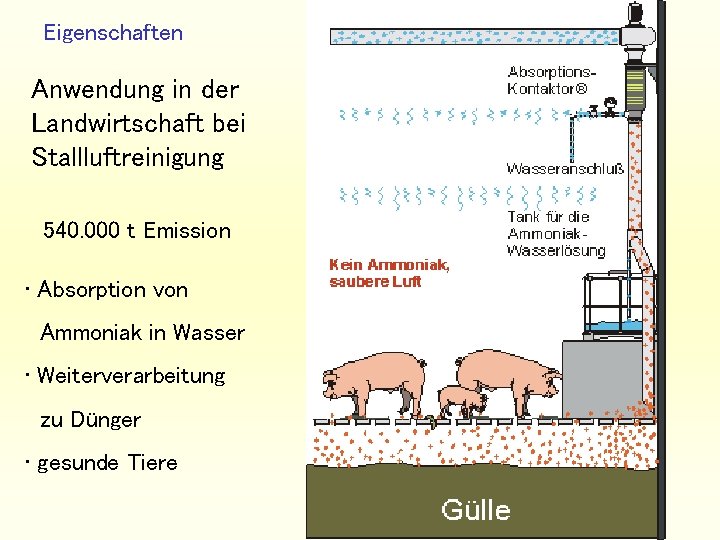
Eigenschaften Anwendung in der Landwirtschaft bei Stallluftreinigung 540. 000 t Emission • Absorption von Ammoniak in Wasser • Weiterverarbeitung zu Dünger • gesunde Tiere

Gliederung • Darstellung • Eigenschaften • Ammonium-Salze • Nachweise • Verwendung • Schulrelevanz

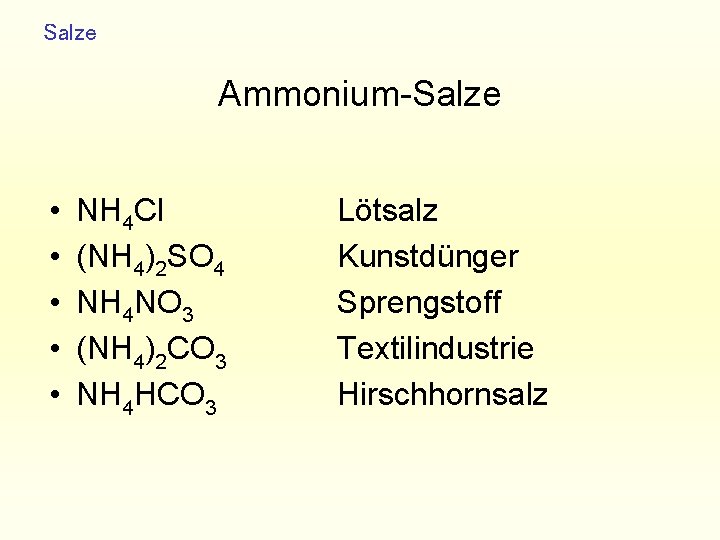
Salze Ammonium-Salze • • • NH 4 Cl (NH 4)2 SO 4 NH 4 NO 3 (NH 4)2 CO 3 NH 4 HCO 3 Lötsalz Kunstdünger Sprengstoff Textilindustrie Hirschhornsalz

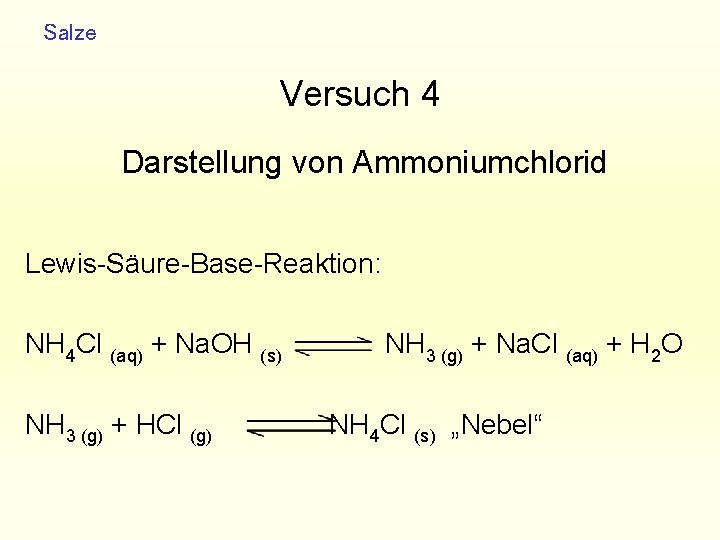
Salze Versuch 4 Darstellung von Ammoniumchlorid Lewis-Säure-Base-Reaktion: NH 4 Cl (aq) + Na. OH (s) NH 3 (g) + Na. Cl (aq) + H 2 O NH 3 (g) + HCl (g) NH 4 Cl (s) „Nebel“

Gliederung • Darstellung • Eigenschaften • Ammonium-Salze • Nachweise • Verwendung • Schulrelevanz

Nachweise von Ammoniak • • • HCl Phenolphthalein Indikatorpapier Nesslers-Reagenz Cu. SO 4

Nachweise Nachweis mit Nesslers-Reagenz Bildung des Nesslers-Reagenz 4 KI (aq) + Hg. Cl 2 (aq) K 2[Hg. I 4] (aq) + 2 KCl (aq) Bildung des Iodids der Millonschen Base: 2 [Hg. I 4]2 - (aq) + NH 4+ (aq) + 4 OH- (aq) [Hg 2 N]I (aq) + 4 H 2 O + 7 I- (aq)
![Nachweise Hg 2 N Raumnetzstruktur A ntiCristobalit Nachweise [Hg 2 N] + + + Raumnetzstruktur: A nti-Cristobalit](https://slidetodoc.com/presentation_image_h/b30c2261639fa80c39cd557a2fb8e80e/image-30.jpg)
Nachweise [Hg 2 N] + + + Raumnetzstruktur: A nti-Cristobalit

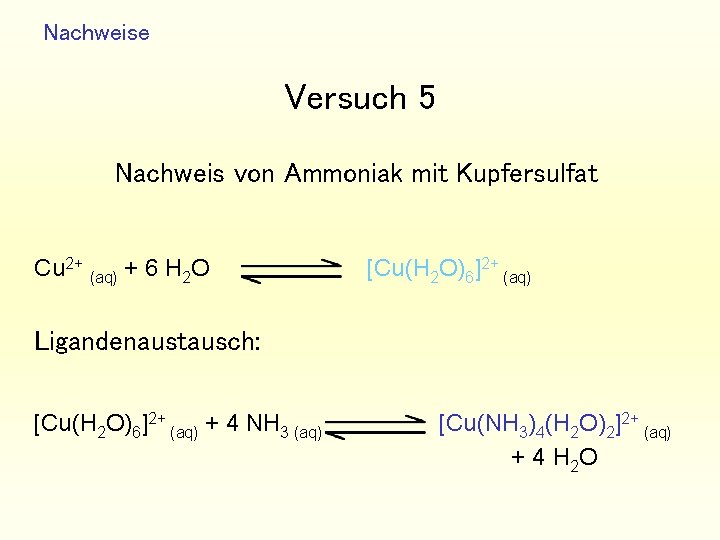
Nachweise Versuch 5 Nachweis von Ammoniak mit Kupfersulfat Cu 2+ (aq) + 6 H 2 O [Cu(H 2 O)6]2+ (aq) Ligandenaustausch: [Cu(H 2 O)6]2+ (aq) + 4 NH 3 (aq) [Cu(NH 3)4(H 2 O)2]2+ (aq) + 4 H 2 O

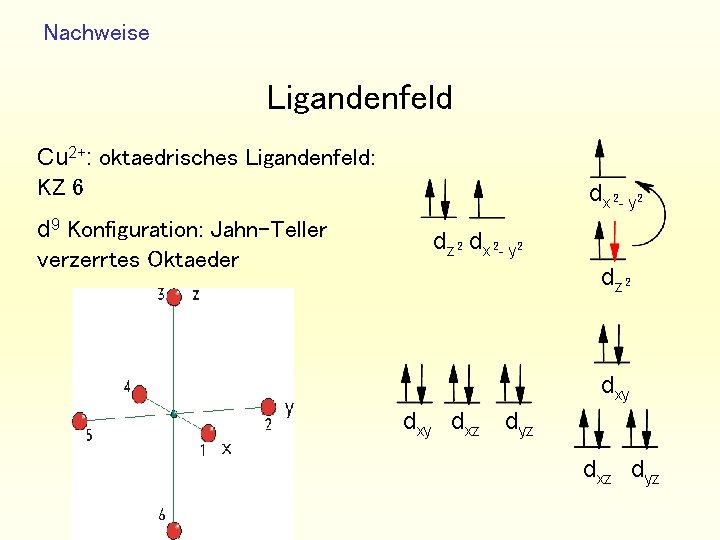
Nachweise Ligandenfeld Cu 2+: oktaedrisches Ligandenfeld: KZ 6 d 9 Konfiguration: Jahn-Teller verzerrtes Oktaeder dx - y 2 2 dz 2 dxy dxz dyz

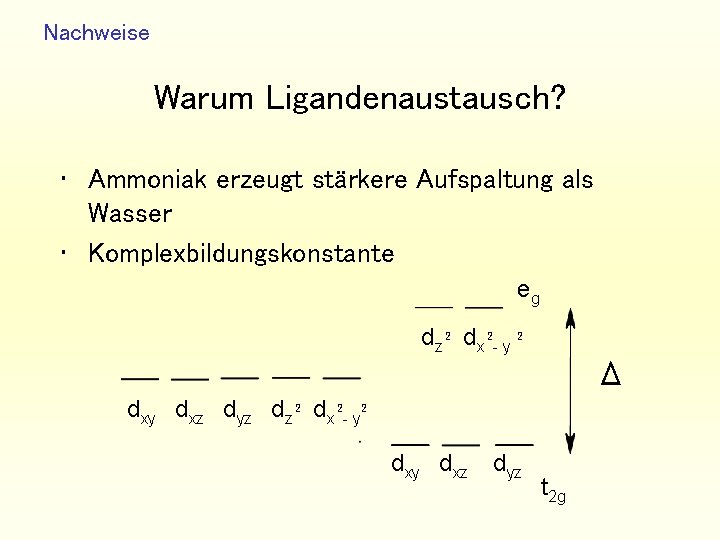
Nachweise Warum Ligandenaustausch? • Ammoniak erzeugt stärkere Aufspaltung als Wasser • Komplexbildungskonstante eg 2 2 dz 2 dx - y Δ 2 2 dxy dxz dyz dz 2 dx - y dxz dyz t 2 g

Nachweise Komplexbildungskonstante • MWG auf dieser Gleichgewichtsreaktion anwendbar: • stufenweise Anlagerung der Liganden KB = [MLnm+] _____ [Mm+(aq)] [L]n • je größer Konstante, desto beständiger der Komplex.

Gliederung • Darstellung • Eigenschaften • Ammonium-Salze • Nachweise • Verwendung • Schulrelevanz

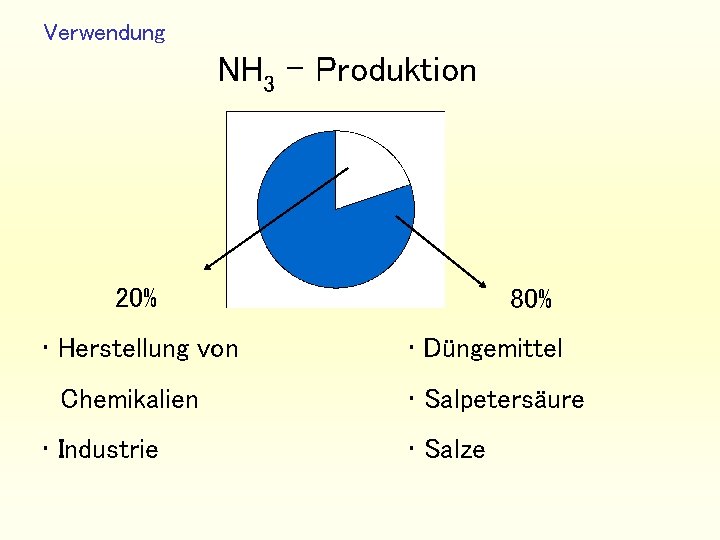
Verwendung NH 3 - Produktion 20% • Herstellung von Chemikalien • Industrie 80% • Düngemittel • Salpetersäure • Salze

Verwendung Industrie Chemikalien • Rauchgasreinigung • Hydrazin • Metallbearbeitung • Blausäure • Kunstseide • Polyamide • Farbstoffe • Salze • Nylon • Sprengstoff • Arzneimittel • Kältetechnik • Reinigungsmittel

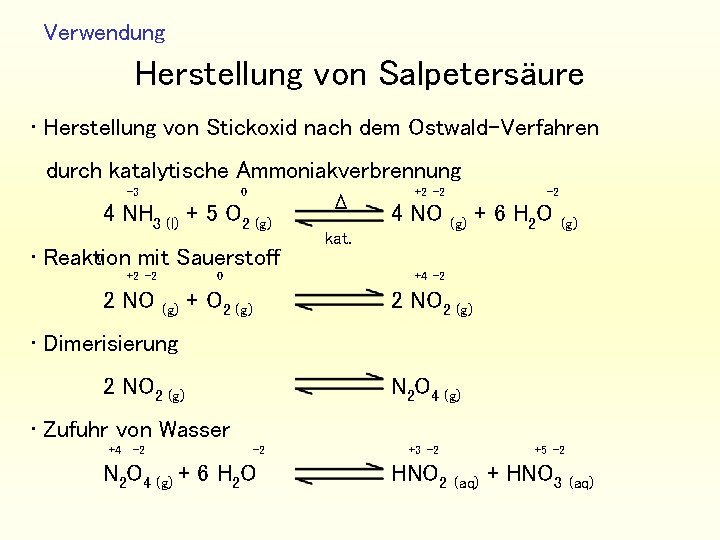
Verwendung Herstellung von Salpetersäure • Herstellung von Stickoxid nach dem Ostwald-Verfahren durch katalytische Ammoniakverbrennung -3 0 4 NH 3 (l) + 5 O 2 (g) 0 • Reaktion mit Sauerstoff +2 -2 2 NO (g) Δ +2 -2 4 NO kat. -2 (g) 0 +4 -2 + O 2 (g) 2 NO 2 (g) + 6 H 2 O (g) • Dimerisierung 2 NO 2 (g) N 2 O 4 (g) • Zufuhr von Wasser +4 -2 -2 N 2 O 4 (g) + 6 H 2 O +3 -2 HNO 2 +5 -2 (aq) + HNO 3 (aq)

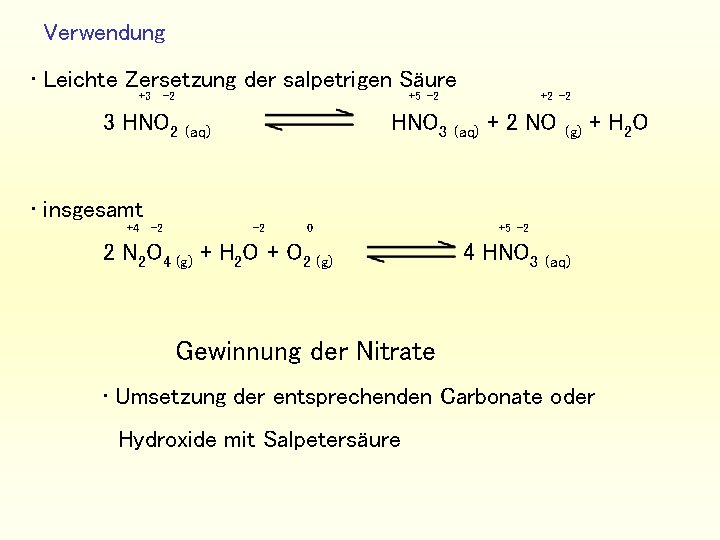
Verwendung • Leichte Zersetzung der salpetrigen Säure +3 -2 +5 -2 3 HNO 2 HNO 3 (aq) +2 -2 (aq) + 2 NO (g) + H 2 O • insgesamt +4 -2 -2 0 2 N 2 O 4 (g) + H 2 O + O 2 (g) +5 -2 4 HNO 3 (aq) Gewinnung der Nitrate • Umsetzung der entsprechenden Carbonate oder Hydroxide mit Salpetersäure

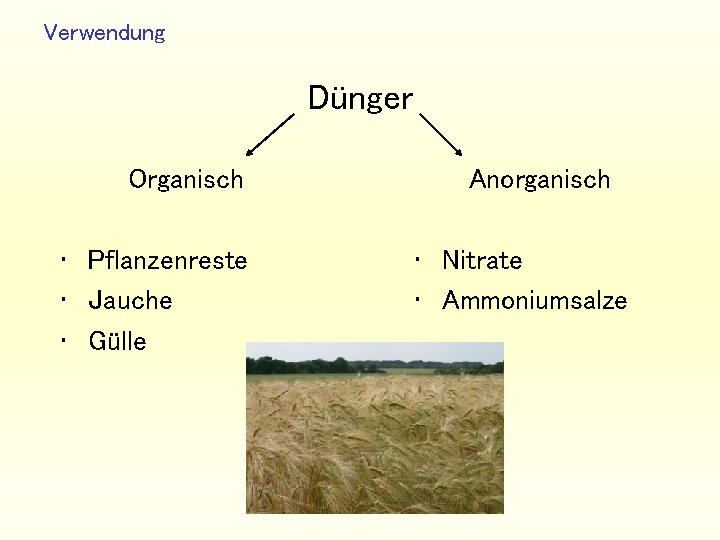
Verwendung Dünger Organisch • Pflanzenreste • Jauche • Gülle Anorganisch • Nitrate • Ammoniumsalze

Verwendung Demo 1 Auswirkung von Dünger auf das Wachstum von Keimlingen Dünger 1 Dünger 2 enthaltene Ionen: K+ (aq), Fe 3+ (aq), NH 4+ 2+ , Ca (aq) K+ (aq), Fe 3+ (aq), Ca 2+ PO 43 - (aq), SO 42 - (aq), Cl- (aq), NO 3 - (aq) PO 43 - (aq), SO 42 - (aq), Cl- (aq)

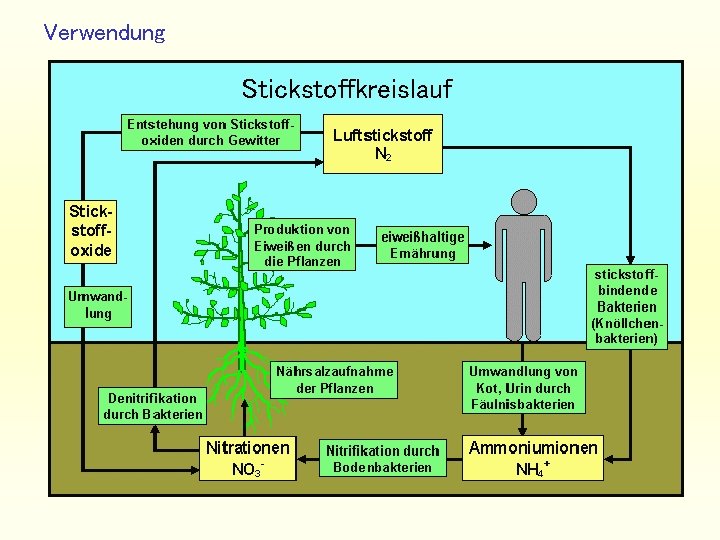
Verwendung Stickstoffkreislauf

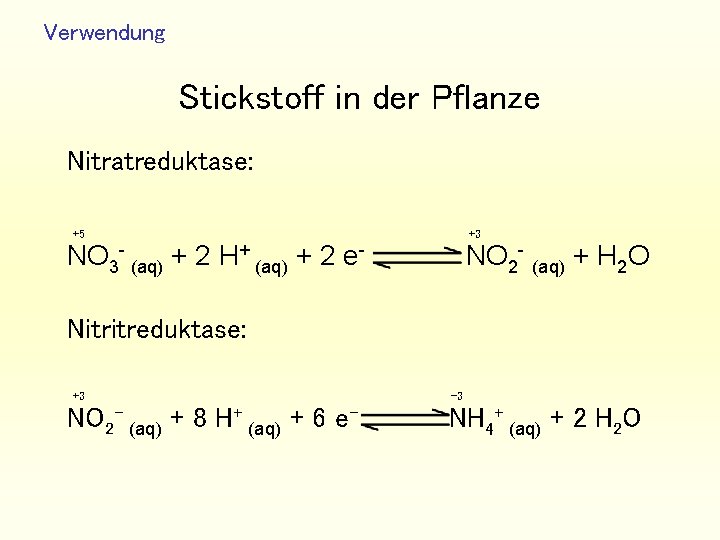
Verwendung Stickstoff in der Pflanze Nitratreduktase: +5 NO 3 - (aq) + 2 H+ (aq) + 2 e- +3 NO 2 - (aq) + H 2 O Nitritreduktase: +3 NO 2 - (aq) + 8 H+ (aq) + 6 e- -3 NH 4+ (aq) + 2 H 2 O

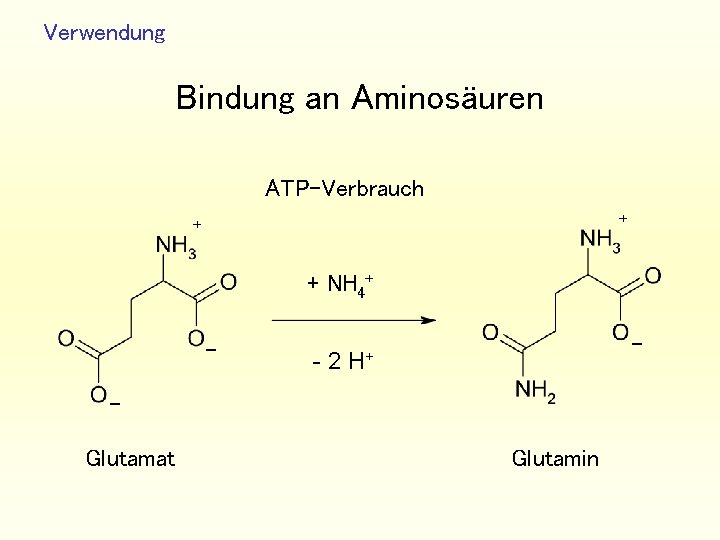
Verwendung Bindung an Aminosäuren ATP-Verbrauch + + + NH 4+ - - - 2 H+ Glutamat Glutamin

Verwendung Demo 2 Backen mit Hirschhornsalz

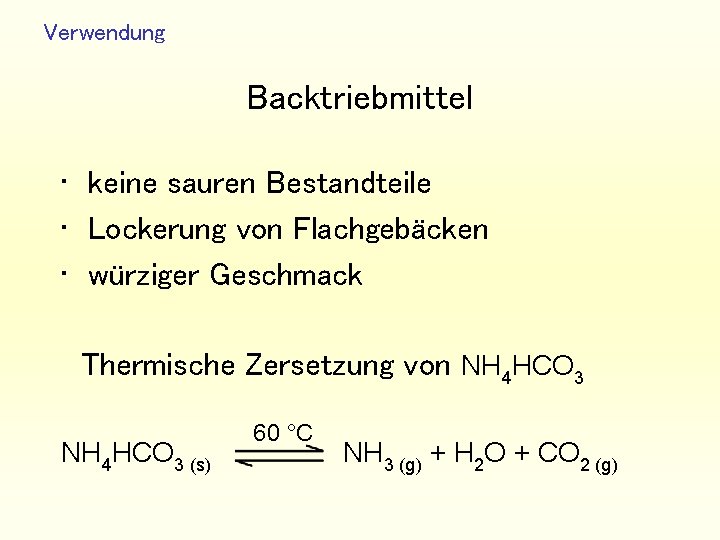
Verwendung Backtriebmittel • keine sauren Bestandteile • Lockerung von Flachgebäcken • würziger Geschmack Thermische Zersetzung von NH 4 HCO 3 60 °C NH 4 HCO 3 (s) NH 3 (g) + H 2 O + CO 2 (g)

Gliederung • Darstellung • Eigenschaften • Ammonium-Salze • Nachweise • Verwendung • Schulrelevanz

Schulrelevanz – G 9 • 8. 1. : • 8. 2. : • 10. 2. : • 11. 1. : • 13. 2. : Stoffe – Strukturen - Eigenschaften Die chemische Reaktion Säure, Laugen, Salze Herstellung von Ammoniak und wässrigen Ammoniaklösungen Stoffkreisläufe, Düngemittel Redoxreaktionen Katalyse Wahlthema: Komplexchemie Wahlthema: Angewandte Chemie

Ende
 Bauxitvorkommen
Bauxitvorkommen Gewerbesalz verwendung
Gewerbesalz verwendung Ladespeicher
Ladespeicher Webeleinstek verwendung
Webeleinstek verwendung Verwendung von ethen
Verwendung von ethen Naphtholorange indikator
Naphtholorange indikator Formaldehyd verwendung
Formaldehyd verwendung Verwendung salz
Verwendung salz Ammoniak herstellung
Ammoniak herstellung Svovlsur ammoniak til græsplænen
Svovlsur ammoniak til græsplænen Keilstrichformel wasser
Keilstrichformel wasser Was ist das
Was ist das Seilnacht ammoniak
Seilnacht ammoniak Schematische darstellung programm
Schematische darstellung programm Din 509
Din 509 Koeffizientenvergleich potenzreihe
Koeffizientenvergleich potenzreihe Mechatronik
Mechatronik Submissionsnummer
Submissionsnummer Unabhängige pufferzeit berechnen
Unabhängige pufferzeit berechnen Rekursive darstellung logistisches wachstum
Rekursive darstellung logistisches wachstum Objektorientierte aufbauorganisation
Objektorientierte aufbauorganisation Eis-prinzip von bruner
Eis-prinzip von bruner Stetige merkmale
Stetige merkmale Funktionsorientierte gliederung
Funktionsorientierte gliederung Gliederung gif
Gliederung gif Nietzsche vereinsamt
Nietzsche vereinsamt Gliederung des wortschatzes
Gliederung des wortschatzes Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung Naturwissenschaftliche erkenntnisgewinnung
Naturwissenschaftliche erkenntnisgewinnung Horizontale gliederung fachsprache
Horizontale gliederung fachsprache Gliederung foto
Gliederung foto Motivationsschreiben gliederung
Motivationsschreiben gliederung Vorgangsliste beispiel
Vorgangsliste beispiel Gutachterliche stellungnahme aufbau
Gutachterliche stellungnahme aufbau Definition autoritärer führungsstil
Definition autoritärer führungsstil Gliederung mathematik
Gliederung mathematik Projektstrukturplan gliederung
Projektstrukturplan gliederung Gliederung biografie
Gliederung biografie Anlagevermögen gliederung
Anlagevermögen gliederung Unversteuerte rücklagen definition
Unversteuerte rücklagen definition W-seminar bayern gliederung
W-seminar bayern gliederung Michel de certeau praktiken im raum
Michel de certeau praktiken im raum Vertikale gliederung fachsprache
Vertikale gliederung fachsprache Gliederung erörterung
Gliederung erörterung Klimawandel gliederung
Klimawandel gliederung Gliederung qualitative forschung
Gliederung qualitative forschung Gliederung facharbeit
Gliederung facharbeit überführungsfunktion
überführungsfunktion Leise begleitung text
Leise begleitung text Die bergpredigt gliederung
Die bergpredigt gliederung