AMINOACIDOS PROTEINAS ESTRUCTURA l AMINOACIDOS ESTANDAR l AMINOACIDOS















- Slides: 36

AMINOACIDOS/ PROTEINAS

ESTRUCTURA l AMINOACIDOS ESTANDAR l AMINOACIDOS NO ESTANDAR

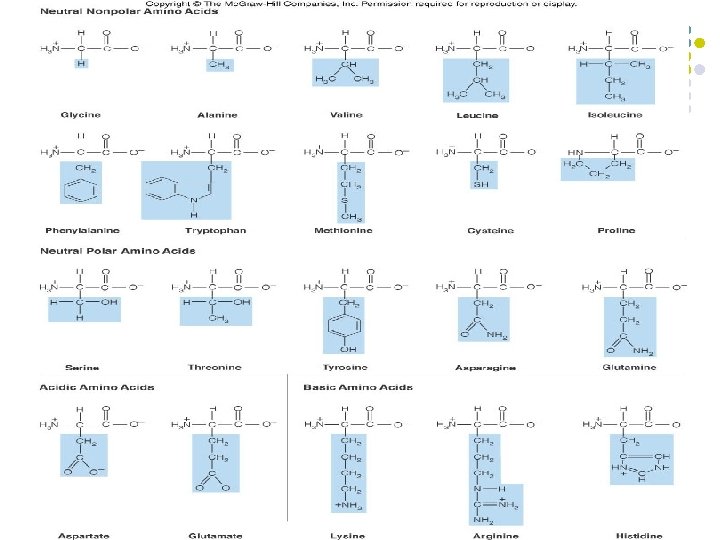
CLASES DE AMINOACIDOS l l 1) 2) 3) 4) La secuencia de aminoácidos determina la configuración tridimensional de cada proteína. Se clasifican de acuerdo con su capacidad para interaccionar con el agua. Apolares neutros Polares neutros Ácidos Básicos


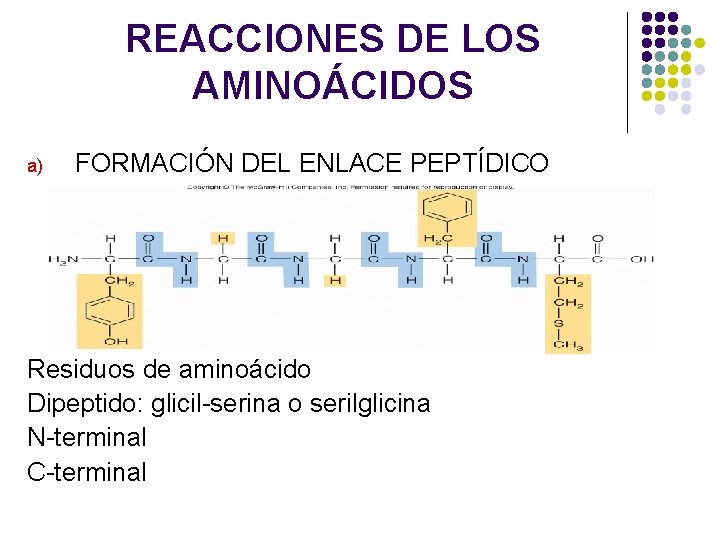
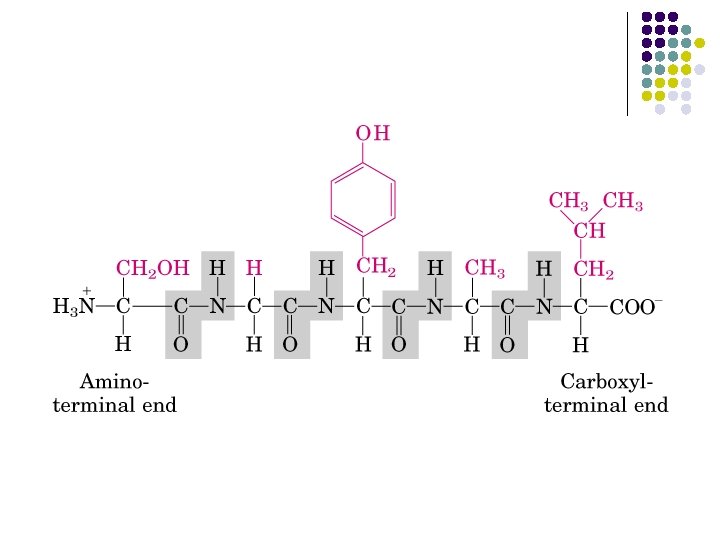
REACCIONES DE LOS AMINOÁCIDOS a) FORMACIÓN DEL ENLACE PEPTÍDICO Residuos de aminoácido Dipeptido: glicil-serina o serilglicina N-terminal C-terminal


PROTEÍNAS 1) 2) 3) 4) CATALISIS (enzimas) ESTRUCTURA (protección y sostén) MOVIMIENTO (participan en movimientos celulares: actina y tubulina) DEFENSA (protectoras: coagulación de la sangre, inmunoglobulinas)

PROTEÍNAS 5) REGULACION (unión de hormonas a receptores: modifican la función celular: insulina y glucagón) 6) TRANSPORTE (moléculas transportadoras de iones y moléculas: Hb, LDL, HDL, transferrina)

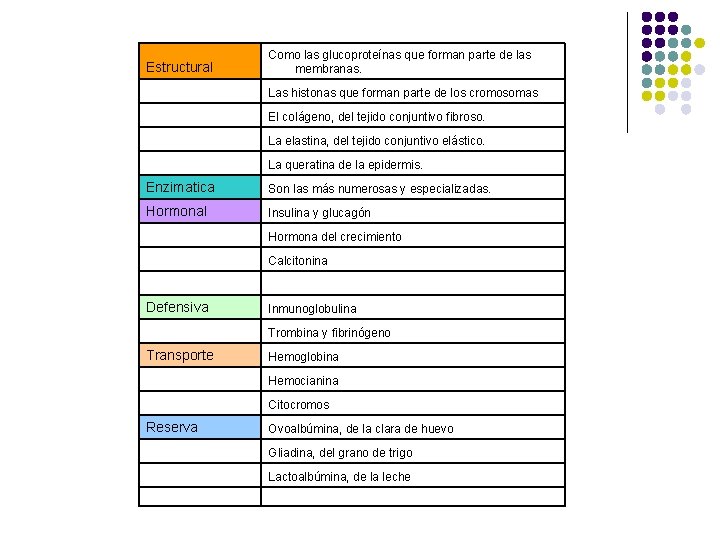
Estructural Como las glucoproteínas que forman parte de las membranas. Las histonas que forman parte de los cromosomas El colágeno, del tejido conjuntivo fibroso. La elastina, del tejido conjuntivo elástico. La queratina de la epidermis. Enzimatica Son las más numerosas y especializadas. Hormonal Insulina y glucagón Hormona del crecimiento Calcitonina Defensiva Inmunoglobulina Trombina y fibrinógeno Transporte Hemoglobina Hemocianina Citocromos Reserva Ovoalbúmina, de la clara de huevo Gliadina, del grano de trigo Lactoalbúmina, de la leche

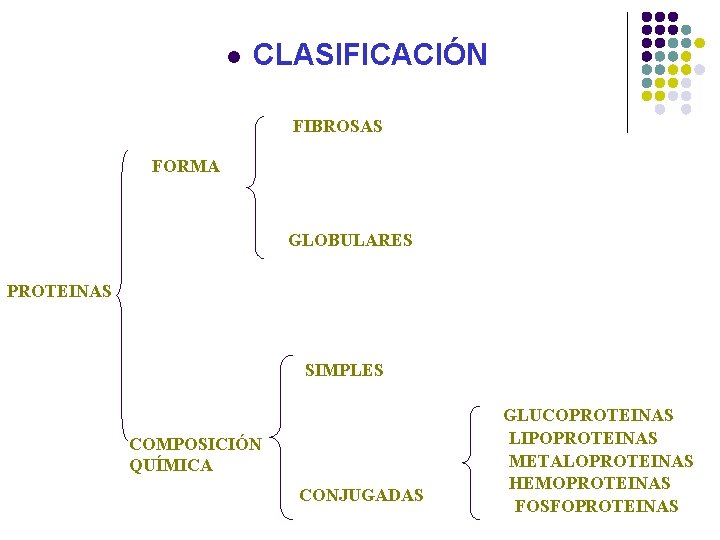
l CLASIFICACIÓN FIBROSAS FORMA GLOBULARES PROTEINAS SIMPLES COMPOSICIÓN QUÍMICA CONJUGADAS GLUCOPROTEINAS LIPOPROTEINAS METALOPROTEINAS HEMOPROTEINAS FOSFOPROTEINAS

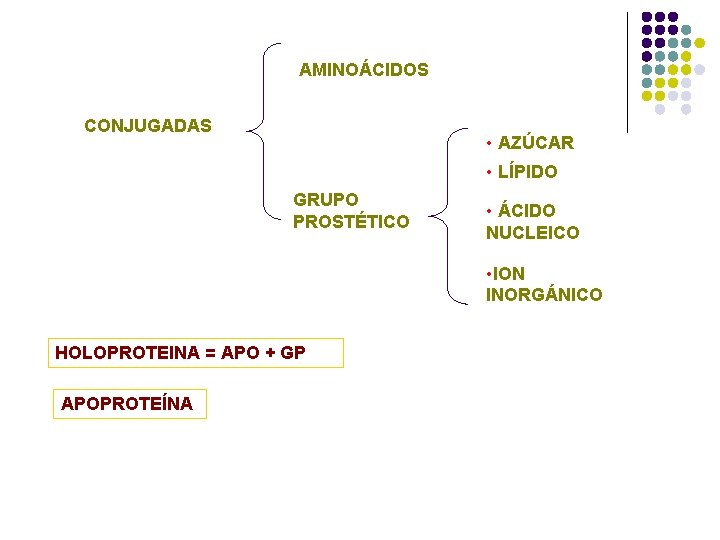
AMINOÁCIDOS CONJUGADAS • AZÚCAR • LÍPIDO GRUPO PROSTÉTICO • ÁCIDO NUCLEICO • ION INORGÁNICO HOLOPROTEINA = APO + GP APOPROTEÍNA

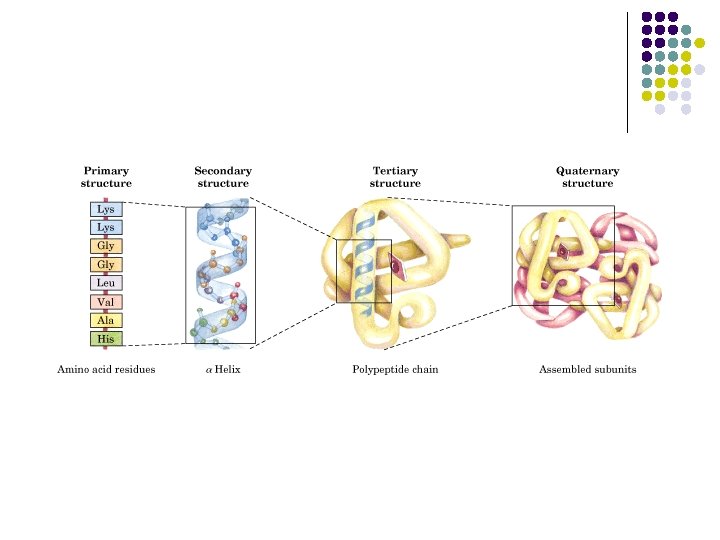
ESTRUCTURA PROTEICA a) b) c) d) ESTRUCTURA PRIMARIA ESTRUCTURA SECUNDARIA ESTRUCTURA TERCIARIA ESTRUCTURA CUATERNARIA


ESTRUCTURA l l l Secuencia de aminoácidos en la cadena polipeptídica Estructura tridimensional Papel funcional

ESTRUCTURA PRIMARIA l l Residuos invariables Mutaciones en estas regiones Mutaciones conservadoras: un aa semejante “leucina-isoleucina” Depranocitosis “enfermedades moleculares”

ESTRUCTURA PRIMARIA Hb A Val-His-Leu-Thr-Pro-Glu-Lysl Hb S Val-His-Leu-Thr-Pro-Val-Glu-Lys 1 2 3 4 5 6 7 8 Homocigotas Heterocigotas : “rasgo depranocítico” África Paludismo l

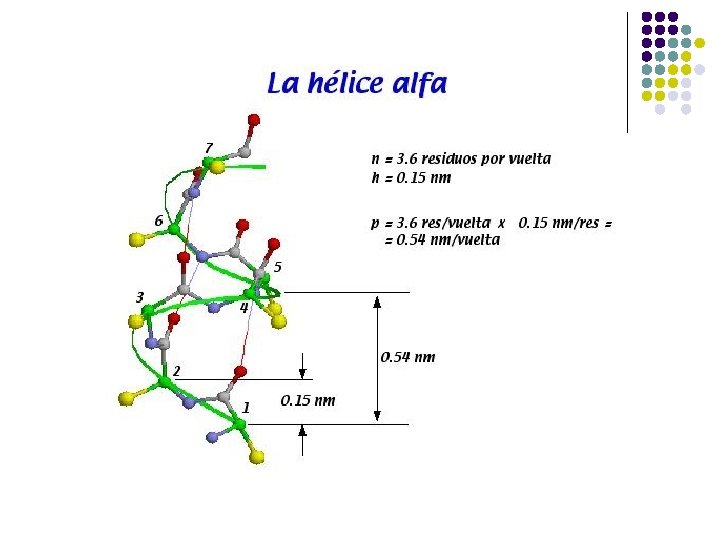
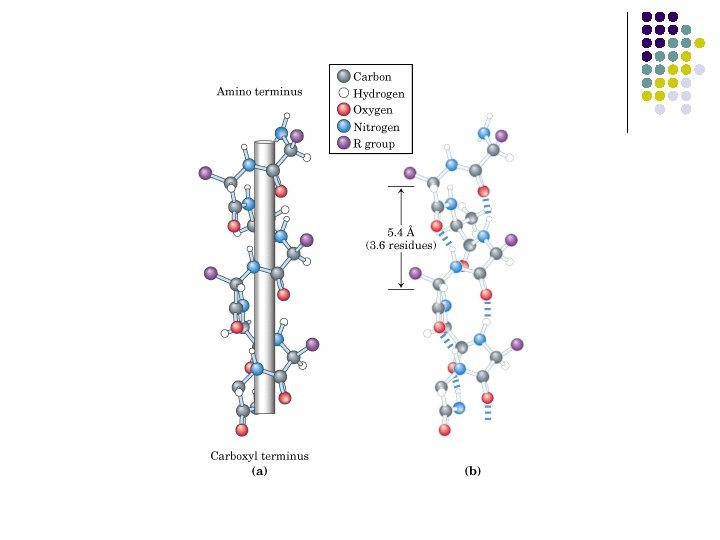
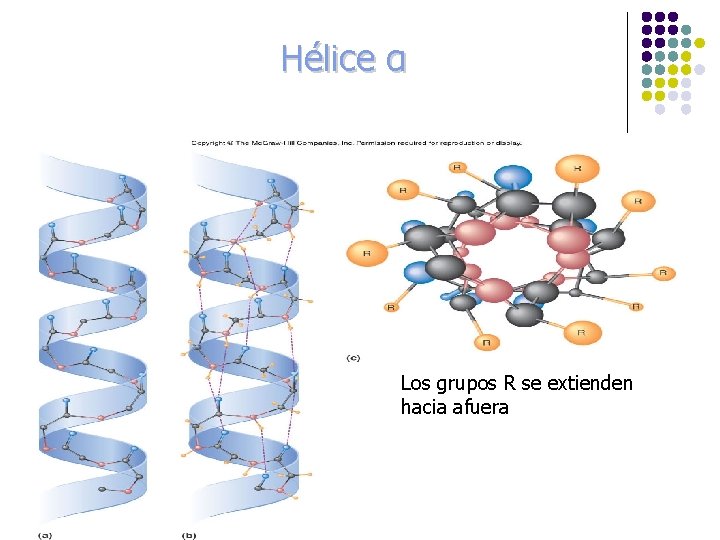
ESTRUCTURA l l l l Hélice α Lámina plegada β Puentes de H (carbonilo y N-H) Hélice α Estructura rígida Conformación helicoidal a la derecha N-H y carbonilo separados por 4 residuos



Hélice α Los grupos R se extienden hacia afuera

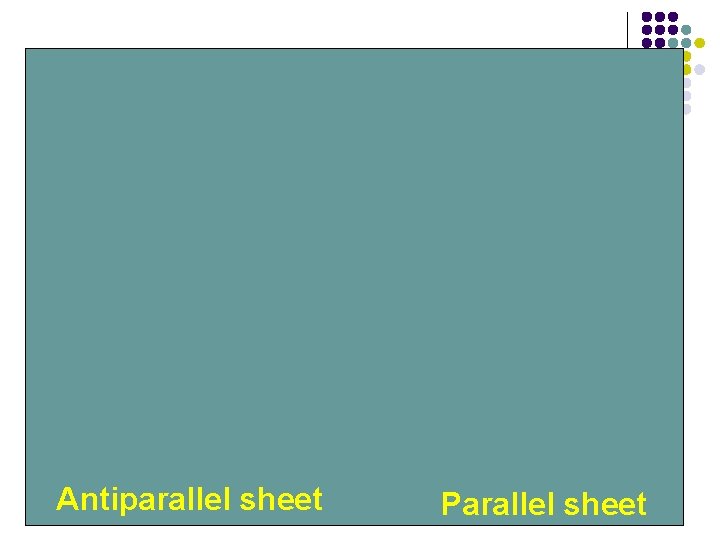
Lámina plegada β l l l Alineación de dos o más segmentos de las cadenas polipeptídicas Cadena β Extendida Puentes de H N-H y carbonilo de cadenas adyacentes Paralelas y antiparalelas

Antiparallel sheet Parallel sheet

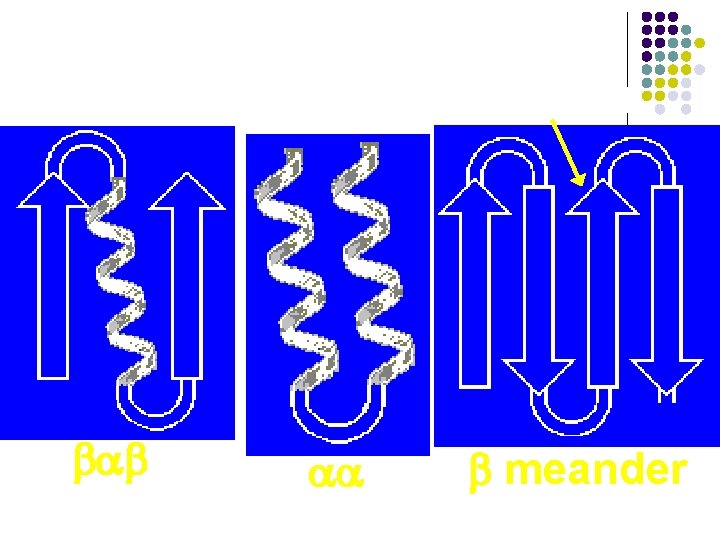
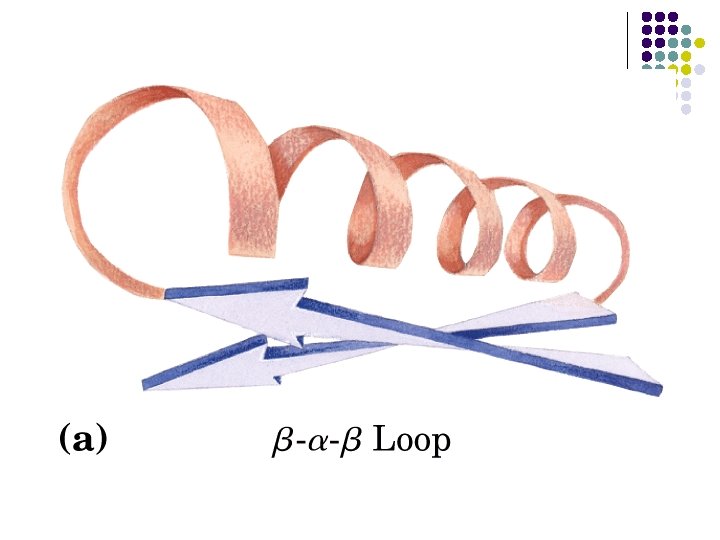
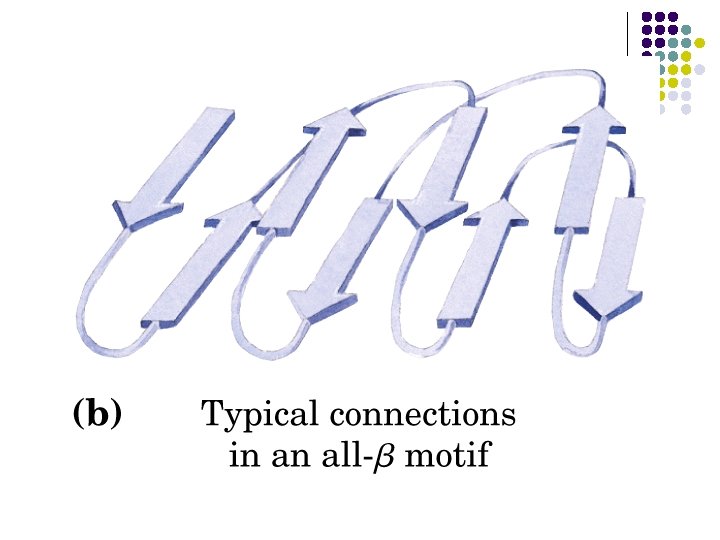
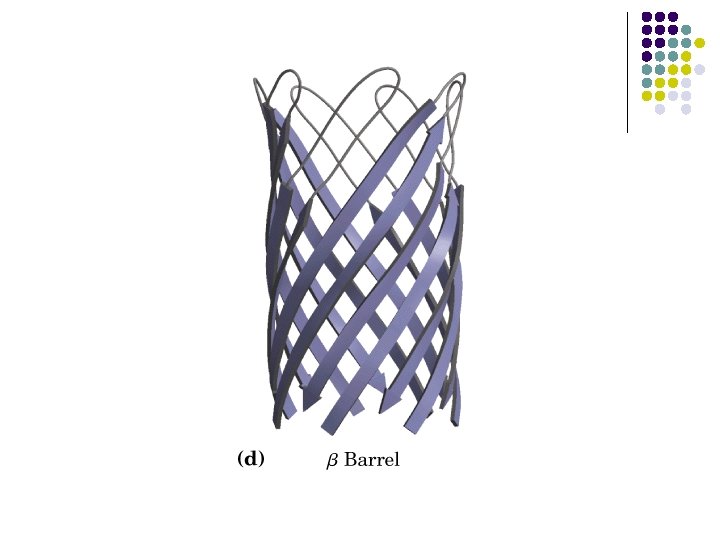
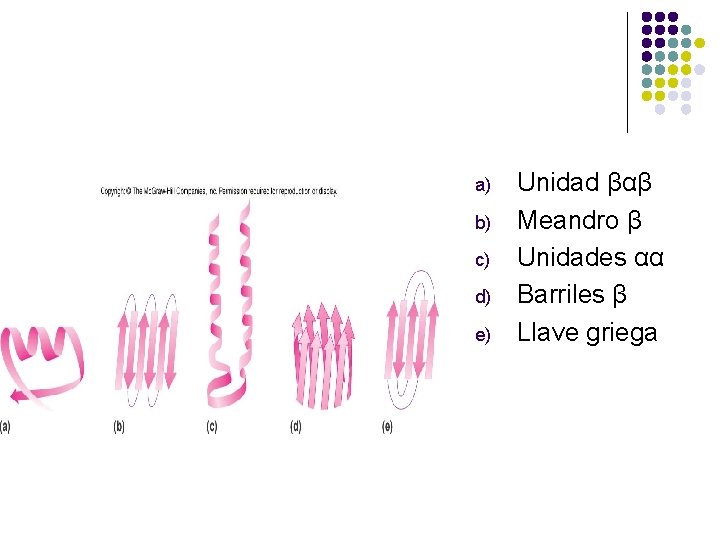
ESTRUCTURAS SUPERSECUNDARIAS l l l Combinaciones de estructuras secundarias Unidad βαβ Meandro β Unidades αα Barriles β Llave griega

Combinations of a helix and b sheet. bab aa b meander





a) b) c) d) e) Unidad βαβ Meandro β Unidades αα Barriles β Llave griega

ESTRUCTURA l l l Conformaciones tridimensionales Interacciones entre las cadenas laterales en la estructura primaria CARACTERISTICAS: Residuos distantes quedan cerca Las moléculas de H 2 O quedan excluidas Dominios

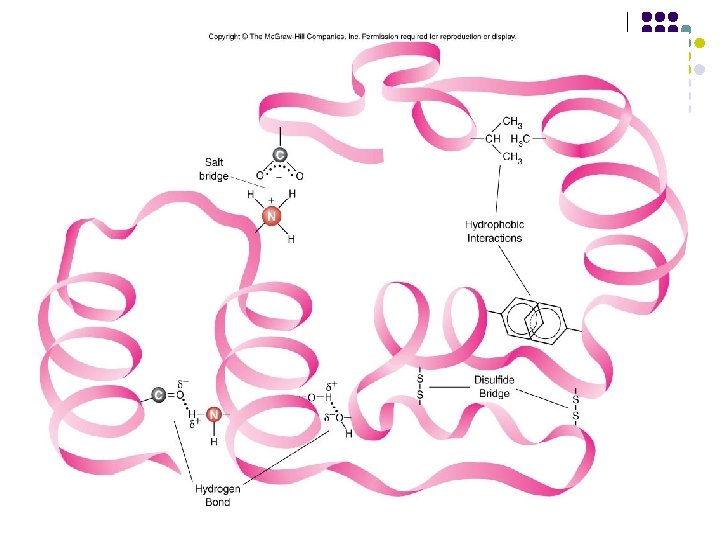
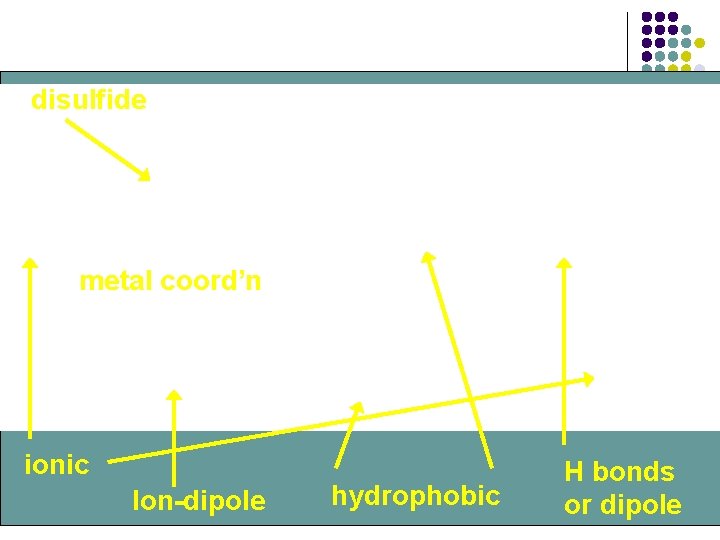
ESTRUCTURA TERCIARIA 1) 2) 3) 4) Interacciones hidrófobas Interacciones electrostáticas Enlaces hidrógeno Enlaces covalentes


disulfide metal coord’n ionic Ion-dipole hydrophobic H bonds or dipole

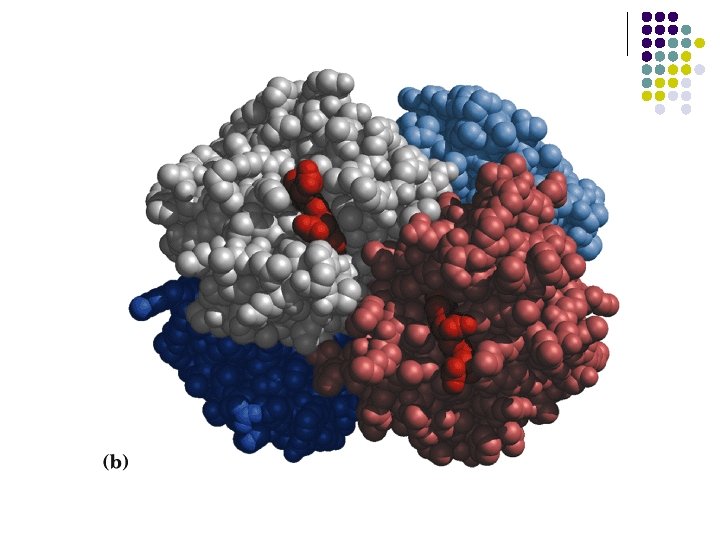
ESTRUCTURA l l l Es el resultado de interacciones no covalentes entre dos o más cadenas polipeptídicas Interacciones covalentes Interacciones no covalentes

