Amino asitler Ve zellikleri Amino asitler neden nemli
















































- Slides: 98

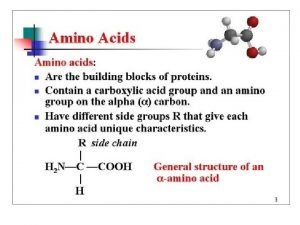
Amino asitler Ve özellikleri

Amino asitler neden önemli? Bu sıcak su kaynağında hayat olabilir mi?

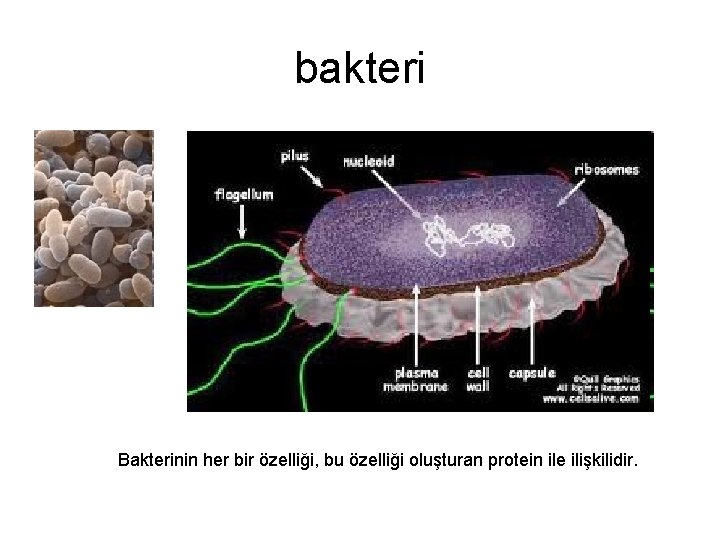
bakteri Bakterinin her bir özelliği, bu özelliği oluşturan protein ile ilişkilidir.

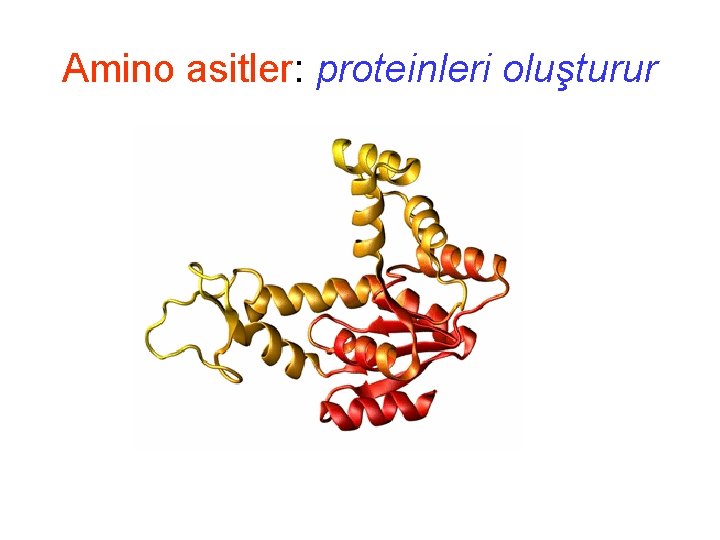
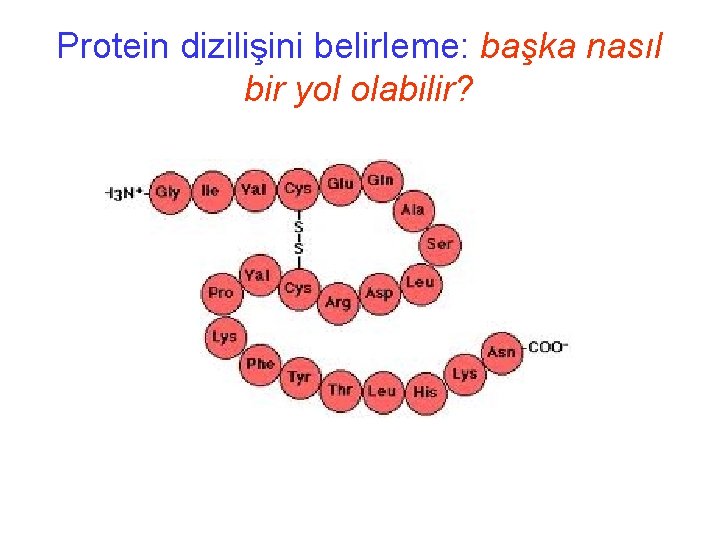
Amino asitler: proteinleri oluşturur

Amino asitler: proteinleri oluşturur

Proteinler: gıda olarak

Amino asitler neden önemli? • Yaşam, bir oyundur… 20 çeşit amino asitle oynanan bir oyun. . • 20 çeşit logo parçası ile yapılabilen şekiller bütünü • Canlılar: logo parçalarından özgün ve başarılı şekiller oluşturan ustalar. .

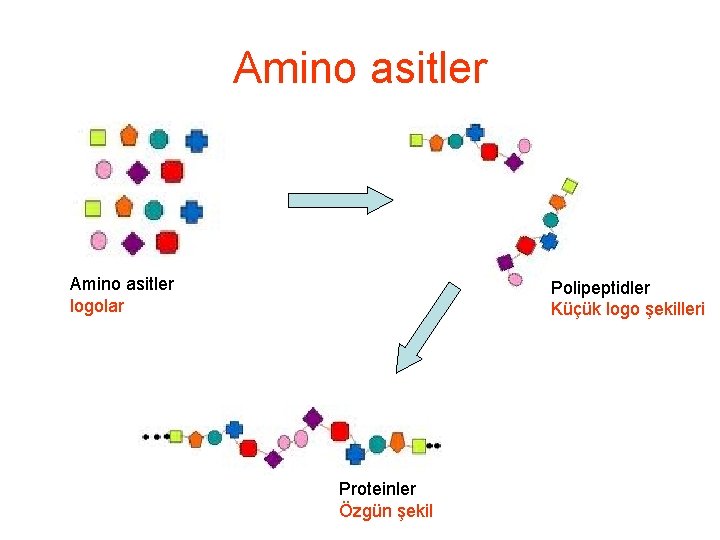
Amino asitler logolar Polipeptidler Küçük logo şekilleri Proteinler Özgün şekil

Amino asitler--- protein • Bütün canlılar aynı 20 çeşit amino asidi kullanarak proteinlerini oluştururlar • Bunlar standart veya yaygın amino asitlerdir • Buna rağmen olağanüstü farklı sayı ve çeşitte polipeptid üretilebilmektedir.


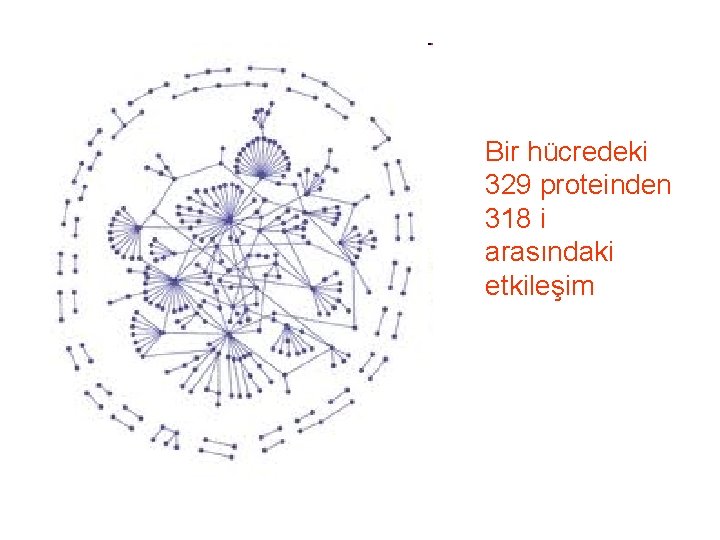
Bir hücredeki 329 proteinden 318 i arasındaki etkileşim

Proteinlerin işlevleri 1. Kataliz, metabolik tepkimeleri katalizlerler 2. Depo ve taşıma (ör miyoglobin ve hemoglobin O 2 , CO 2) 3. Yapı, şekil bütünlük (ör kas, aktin, miyosin) 4. Mekanik iş, hareket, flajella hareketi, kasılması. . ) 5. Bilgi dönüştürme (DNA kopyalanması, RNA üretimi) 6. Hormon ve hormon bağlanma yeri (reseptör) 7. Bağışıklık gibi özel işlevler, antikor, antibody 8. Sinirsel uyarıların aktarılması

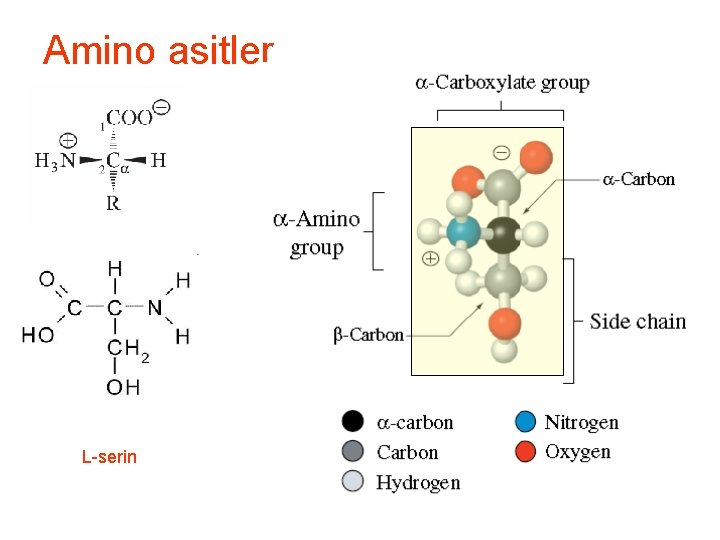
Amino asitler • Amino asitler amino grubu bağlanmış karboksilik asitlerdir. • ɑ (alfa) karbon atomuna bağlanmış amino ve karboksil grubu (eski yunan da bir zincirde karboksil grubun varsa, onun bağlandığı karbona alfa , ondan sonrakine beta. . . ) • Tüm amino asitler ɑ-amino asittir İsimler verilir

Amino asitler • • • Tüm amino asitler ɑ-amino asittir Bilinen isimleri vardır ör: alanin CH 3 -CH (NH 2)-COOH Sistematik ismi: 2 -aminopropanoik asit. Biyokimyacılar yaygın ismi kullanır, alanin

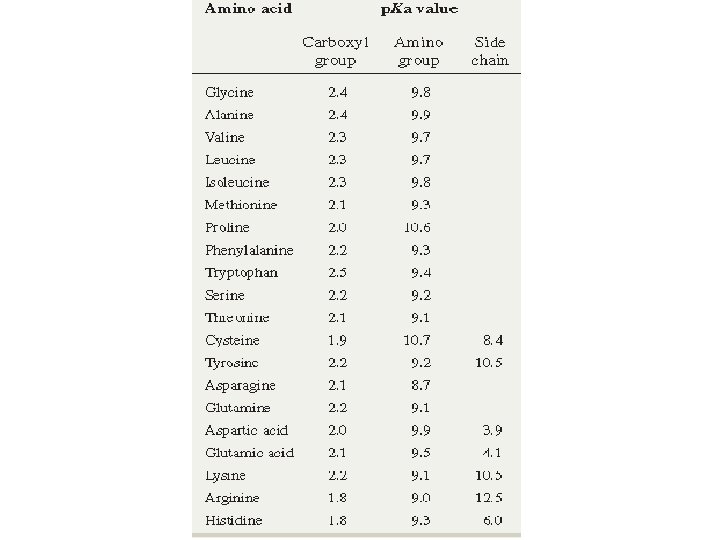
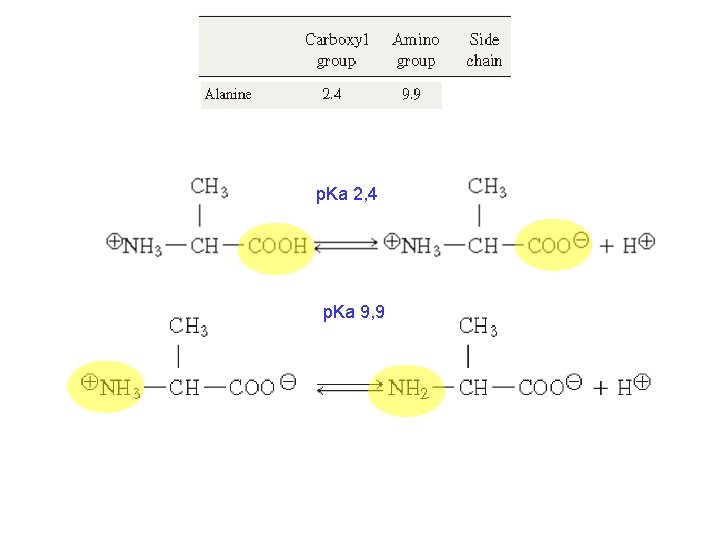
Amino asitler • Amino asit amino gruplarının p. Ka = 9 civarı iken karboksil grupların p. Ka = 3 civarındadır. • Hücre içi fizyolojik şartlar altında, (p. H 7 civarında), amino grupları (+) karboksil grupları (-) yüklüdür. • Yani amino asitler iki zıt kutuplu zayıf iyonik (zwitter ion) moleküllerdir L-amino asit

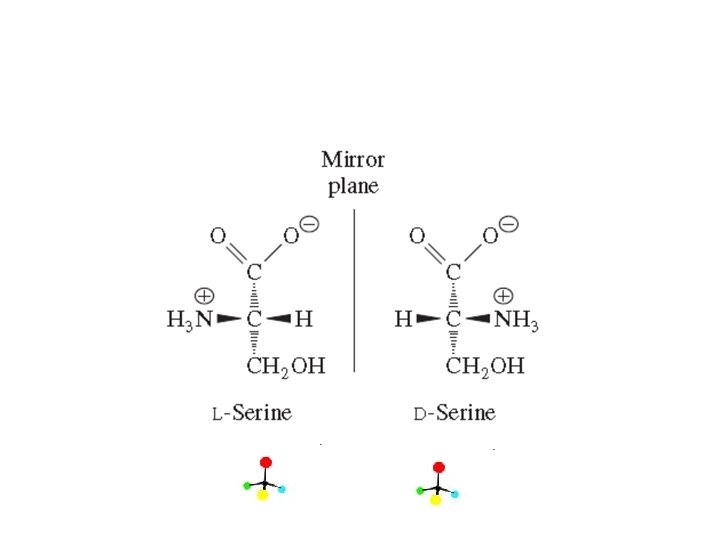
Amino asitler L-serin

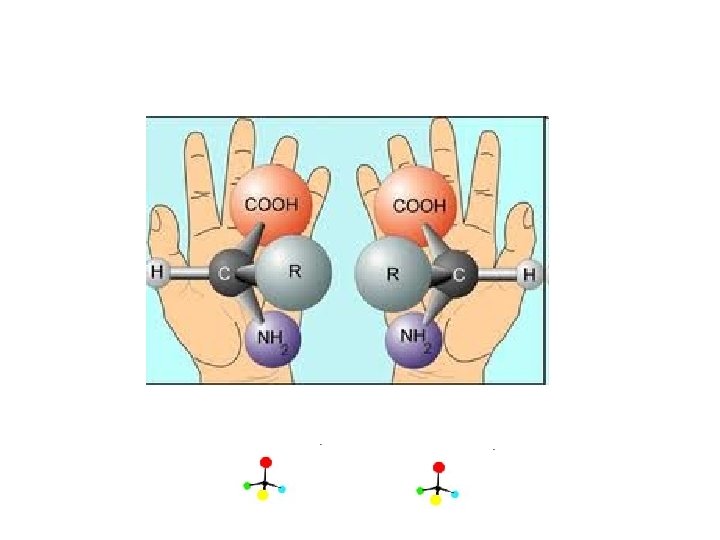
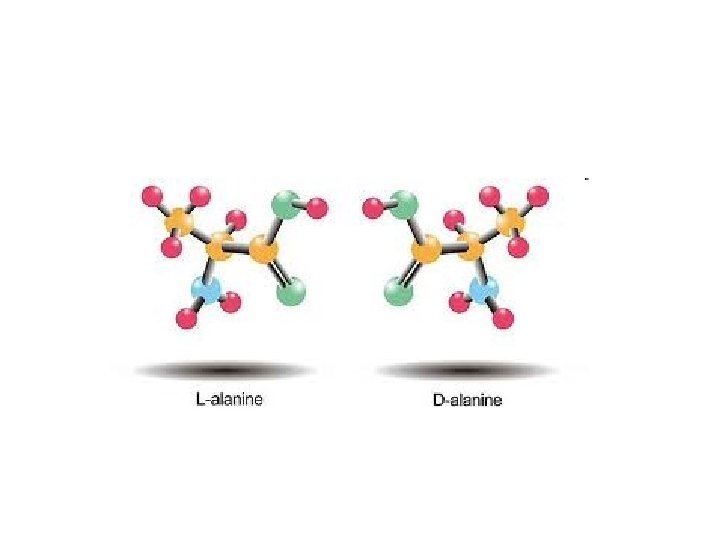
Amino asitler • Biri hariç (glisin) hepsi asimetrik karbon atomu içerir. • Asimetrik karbon atomu içeren moleküllerin, yada Kiral (chiral) moleküllerdir zira 4 değişik grup bağlanmıştır. • Glisinin yan grubunda H vardır, simetriktir. • 19 amino asidin steroizomerleri vardır (Stereoisomers) • Steroizomerler; aynı molekül yapısına sahip ancak uzayda duruşları, şekilleri farklı moleküllerdir. • Amino asit steroizomerleri birbirleri üzerine çakışmayan ayna yansımalarıdır ki böyle steroizomerlere enantiomer denir • Yaygın olarak birbirlerinin ayna yansıması bu amino asit çiftleri • D (dextro, Latin dexter, right, sağ) ve • L (levo, Latin laevus, left, sol).





Amino asitler • Steroizomer olarak çizmek için amino asidin karboksil grubu tepesine yazılır. • Yan gruplar aşağıya yazılır. • Amino grubu molekülün sağında kalıyorsa D- solunda kalıyorsa Lamino asittir. • Proteinlerde yalnızca Laminoasitler yer alır • Tabiatta birkaç yerde DAmino asit = L-Amino asit aminoasit karşımıza çıkar. • O nedenle alanin denince kastedilen L-alanin dir.

Amino asitler • Tüm canlılarda aynı standart aminoasitlerin olması, tüm canlıların ortak bir atadan geldiğinin yada akraba olduklarının delilidir. • 4 milyar yıl önce dünyada ilk yaşam belirtileri başladığında, D ve L biçimlerinin karışımının olduğu ve yine Meteorlarda ve yıldızlarda hem L hem de D aminoasit kalıntıları bulunmuş • Neden L- biçimi canlılar tarafından tercih edilmiş bilinmemektedir

Amino asitler: Moleküler Yapıları • 20 çeşit amino asit • Sadece yan gruplar farklı • Yan grupları benzer özelliklere sahip olmaya göre gruplandırılabilir • Nonpolar veya hidrofobik yan gruba sahip olanlar • Hidrofilik olanlar (Polar veya nötr p. H da iyonlaşabilen gruba sahip olanlar) 5 tanesi oldukça hidrofobik (mavi) iken 7 tanesi oldukça hidrofilik (kırmızı) • Kimyasal gruplarına göre: alifatik, aromatik, kükürt içeren, alkol, bazik, asidik, ve amid içerenler olarak gruplandırılır • Yan grubun özellikleri molekülün üç boyutlu biçimini ve proteinin şeklini belirliyor • Ör: Hidrofobik yan grupların çoğu proteinin iç kısımlarında yer alıyor bu nedenle proteine yumaksı yuvarlak bir yığın biçimi kazanmasına neden oluyor

Amino asitler: Alifatic R Grup Doymuş alifatik yan gruplar

Amino asitler: Glisin, Gly, G • Glisin (Gly, G) en küçük amino asittir. • Yan grup sadece H atomu vardır • Kiral değildir streoizomeri yoktur • 2 tane hidrojen olması glisini azcık hidrofobik yapar • Yan grubu en küçük olduğundan en küçük yerlere sığar Glisin

Amino asitler: A, V, L ve I • Alanin, valin, lösin, and izolösin su ile uyumsuz (su sevemeyen) yan gruplarından dolayı proteinlerin biçimsel mimarilerinin oluşmasında ve kararlı olarak tutulmasında önemli göreve sahiptirler • Alanin hariç oldukça hidrofobiktirler

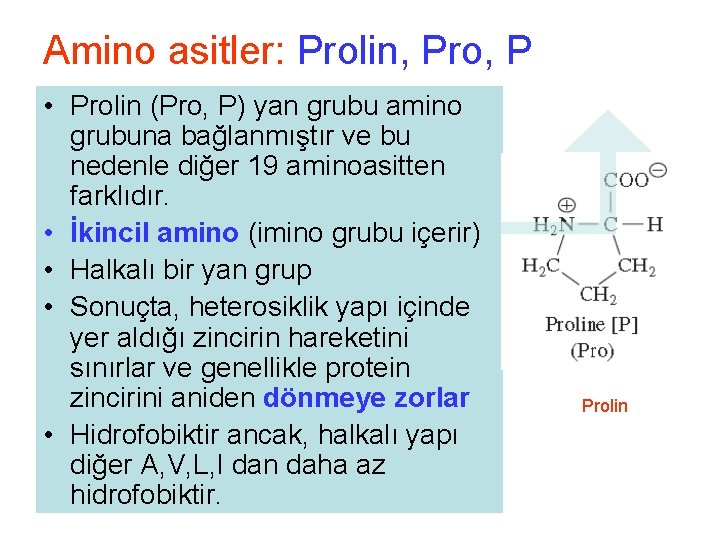
Amino asitler: Prolin, Pro, P • Prolin (Pro, P) yan grubu amino grubuna bağlanmıştır ve bu nedenle diğer 19 aminoasitten farklıdır. • İkincil amino (imino grubu içerir) • Halkalı bir yan grup • Sonuçta, heterosiklik yapı içinde yer aldığı zincirin hareketini sınırlar ve genellikle protein zincirini aniden dönmeye zorlar • Hidrofobiktir ancak, halkalı yapı diğer A, V, L, I dan daha az hidrofobiktir. Prolin

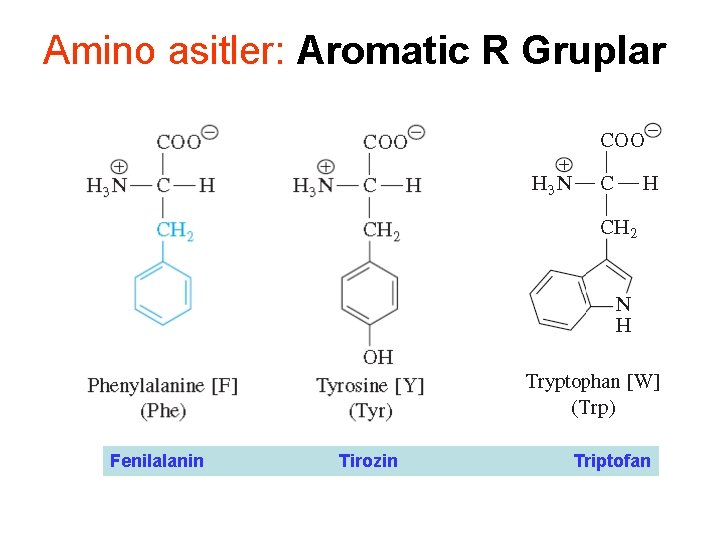
Amino asitler: Aromatic R Gruplar Fenilalanin Tirozin Triptofan

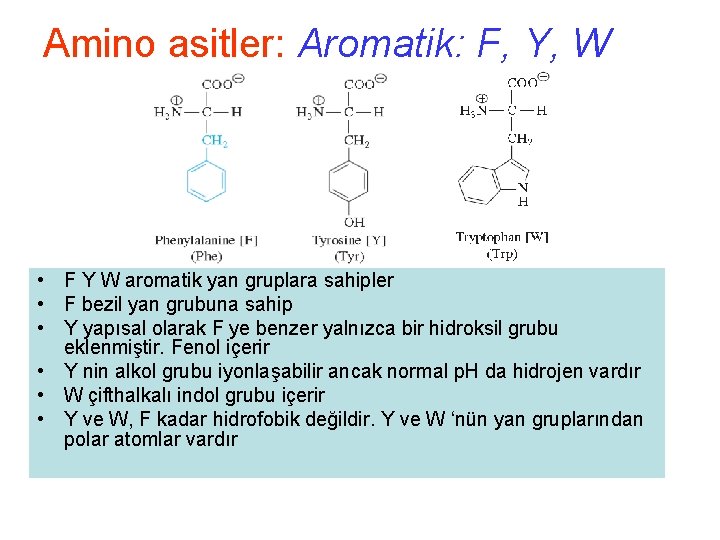
Amino asitler: Aromatik: F, Y, W • F Y W aromatik yan gruplara sahipler • F bezil yan grubuna sahip • Y yapısal olarak F ye benzer yalnızca bir hidroksil grubu eklenmiştir. Fenol içerir • Y nin alkol grubu iyonlaşabilir ancak normal p. H da hidrojen vardır • W çifthalkalı indol grubu içerir • Y ve W, F kadar hidrofobik değildir. Y ve W ‘nün yan gruplarından polar atomlar vardır

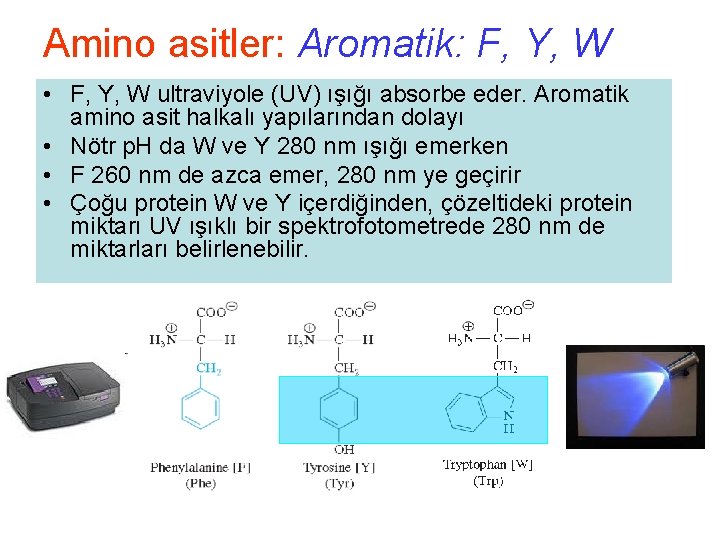
Amino asitler: Aromatik: F, Y, W • F, Y, W ultraviyole (UV) ışığı absorbe eder. Aromatik amino asit halkalı yapılarından dolayı • Nötr p. H da W ve Y 280 nm ışığı emerken • F 260 nm de azca emer, 280 nm ye geçirir • Çoğu protein W ve Y içerdiğinden, çözeltideki protein miktarı UV ışıklı bir spektrofotometrede 280 nm de miktarları belirlenebilir.

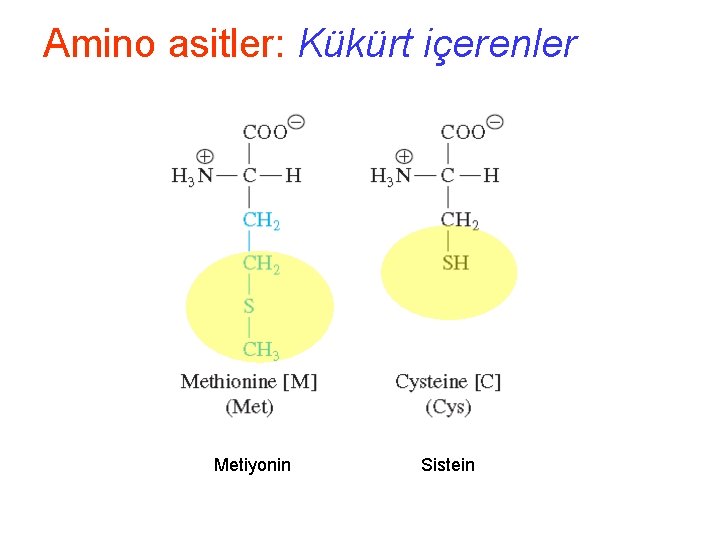
Amino asitler: Kükürt içerenler Metiyonin Sistein

Amino asitler: Kükürt içerenler: M • Metiyonin (Met, M) ve Sistein (Cys, C) kükürt içerir • Metiyonin hidrofobik metil thioether grubu içerir o nedenle oldukça hidrofobiktir. • Başlangıç nükleotidi nedeniyle (AUG) Metiyonin daima protein zincirinin ilk aminoasididir.

Amino asitler: Kükürt içerenler: C • Sistein, Alanine benzer ancak H atomu S ile yer değiştirmiştir. • Sistein biraz hidrofobiktir ancak – SH sülfidril grubu nedeniyle oldukça reaktiftir. • Sülfidril grubu polarize olabilir ve zayıf H bağı kurar • Sülfidril grubu zayıf asidiktir, H kaybederek tamamen iyonlaşabilir negatif yüklü tiolat iyonu haline gelir

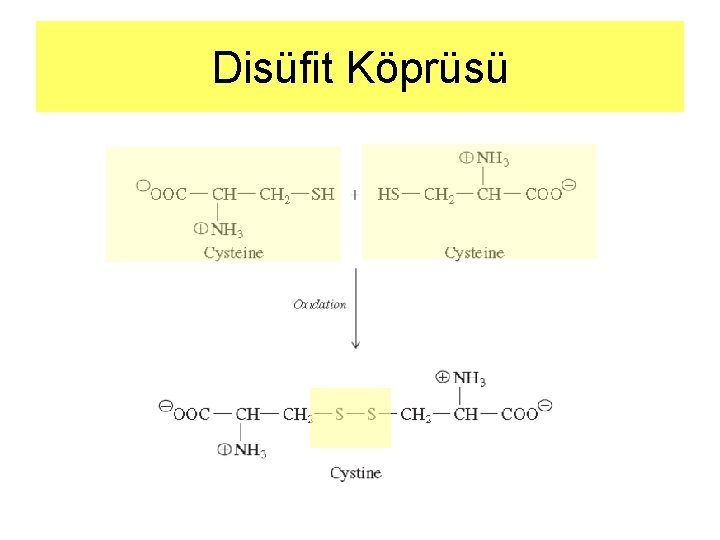
Disüfit Köprüsü

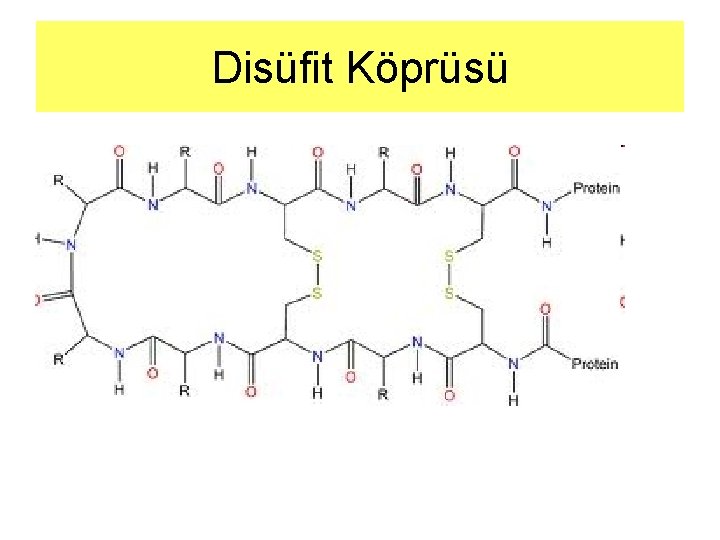
Disüfit Köprüsü

Disüfit Köprüsü

Amino asitler: Disülfit Köprüsü • Disülfit köprüsü ile bir araya gelmiş iki sistein molekülüne Sistin (cystine) denir • Proteinler parçalandığında açığa çıkar • Okside olan iki sistein birbirlerine böyle bağlanabilir • Alkali p. H da kolaylıkla okside olurlar • -SH grupları düşük p. H larda iyonlaşmışlardır • Protein içerisinde –S-S- bağı kurabilmek için yakın bulunmalıdırlar • -S-S- köprüleri protein içinde sonradan oluşan tek kovalent bağdır. • Protein mimarisinin farklı bölümlerini kelepçe gibi birbirlerine tutuşturur, mimariye dayanıklılık kazandırır • Pekçok hücre dışına sentezlenen protein –S-Sköprüleri içerir. • Protein yapısına özellikle sıcaklığa karşı dayanım kazandırırlar.

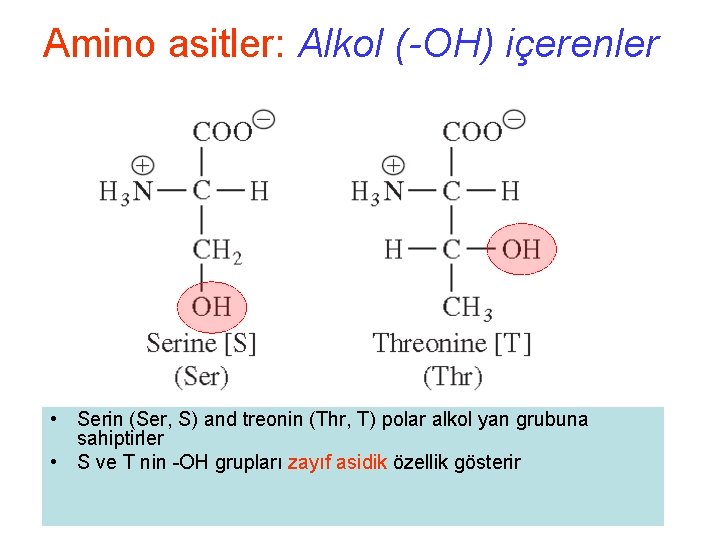
Amino asitler: Alkol (-OH) içerenler • Serin (Ser, S) and treonin (Thr, T) polar alkol yan grubuna sahiptirler • S ve T nin -OH grupları zayıf asidik özellik gösterir

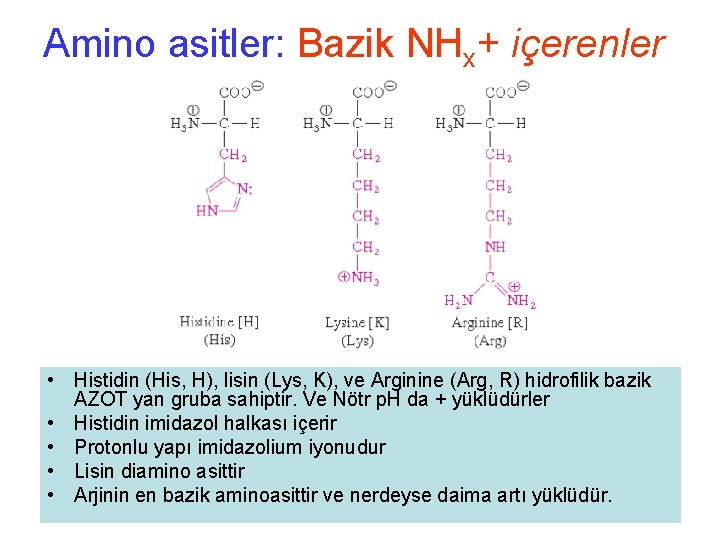
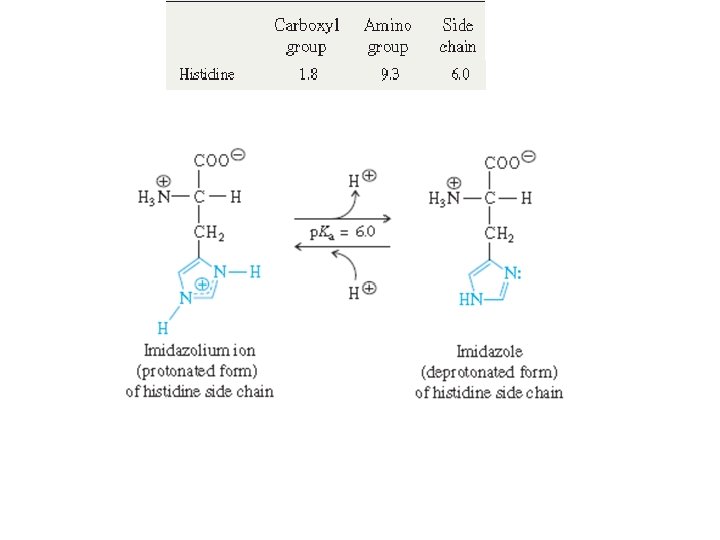
Amino asitler: Bazik NHx+ içerenler • Histidin (His, H), lisin (Lys, K), ve Arginine (Arg, R) hidrofilik bazik AZOT yan gruba sahiptir. Ve Nötr p. H da + yüklüdürler • Histidin imidazol halkası içerir • Protonlu yapı imidazolium iyonudur • Lisin diamino asittir • Arjinin en bazik aminoasittir ve nerdeyse daima artı yüklüdür.

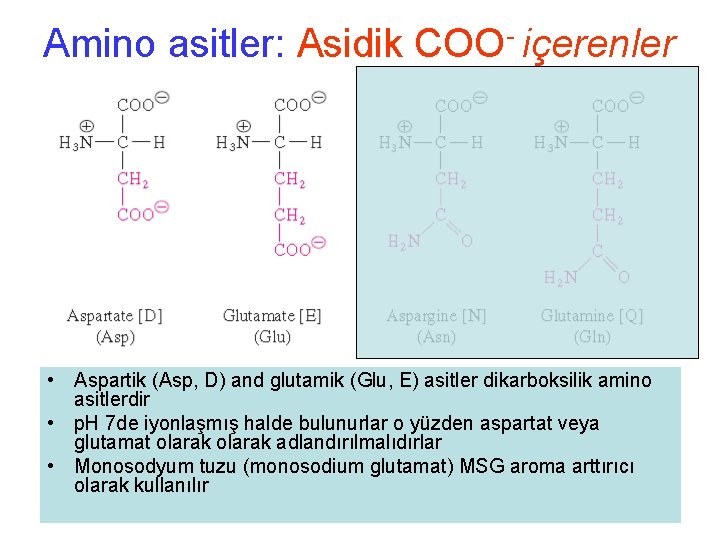
Amino asitler: Asidik COO- içerenler • Aspartik (Asp, D) and glutamik (Glu, E) asitler dikarboksilik amino asitlerdir • p. H 7 de iyonlaşmış halde bulunurlar o yüzden aspartat veya glutamat olarak adlandırılmalıdırlar • Monosodyum tuzu (monosodium glutamat) MSG aroma arttırıcı olarak kullanılır

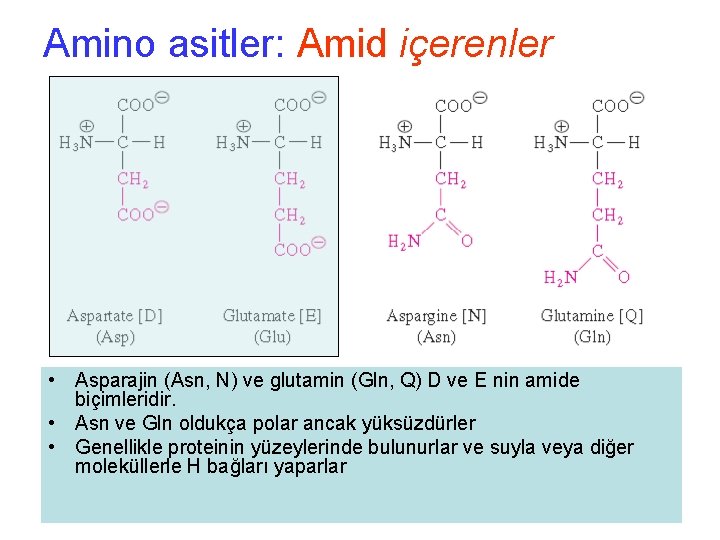
Amino asitler: Amid içerenler • Asparajin (Asn, N) ve glutamin (Gln, Q) D ve E nin amide biçimleridir. • Asn ve Gln oldukça polar ancak yüksüzdürler • Genellikle proteinin yüzeylerinde bulunurlar ve suyla veya diğer moleküllerle H bağları yaparlar

Burada Kaldık

Amino asitler: Hidrofobiklik • Amino asidi lipid katmanından su katmanına taşınmasının serbest enerji değişiminin ölçüsüne hidrofobisite indeksi denir (kj/mol)

Amino asitler: Hidrofobiklik Hidrofobik Hidrofilik Az Hidrofobik

Amino asitler: İyonlaşma • Amino asit amino gruplarının p. Ka = 9 civarı iken karboksil grupların p. Ka = 3 civarındadır. • Hücre içi fizyolojik şartlar altında, (p. H 7 civarında), amino grupları (+) karboksil grupları (-) yüklüdür.


p. Ka 2, 4 p. Ka 9, 9


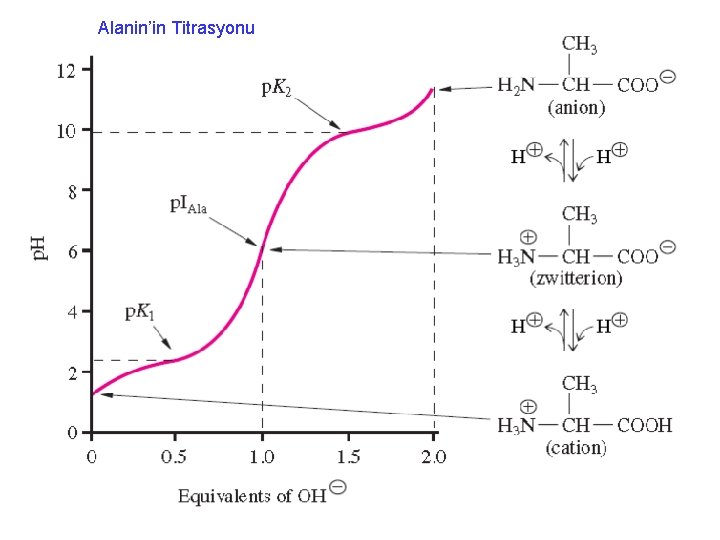
Alanin’in Titrasyonu

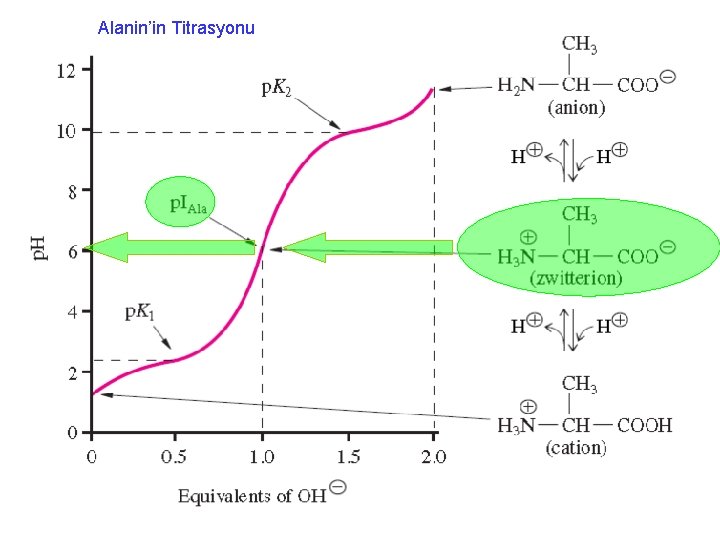
İzoelektrik notka (p. I) • İzo, eşit, dengede demek • İzo elektrik nokta, elektrik yüklerinin dengelendiği yani nokta demektir. • İzoelektrik nokta, NET yükün SIFIR olduğu noktadır.

Alanin’in Titrasyonu

İzoelektrik notka • p. KCOOH=2, 4 • p. KNH 2 =9, 9 p. H 6, 15 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 8, 15 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 4, 15 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir?



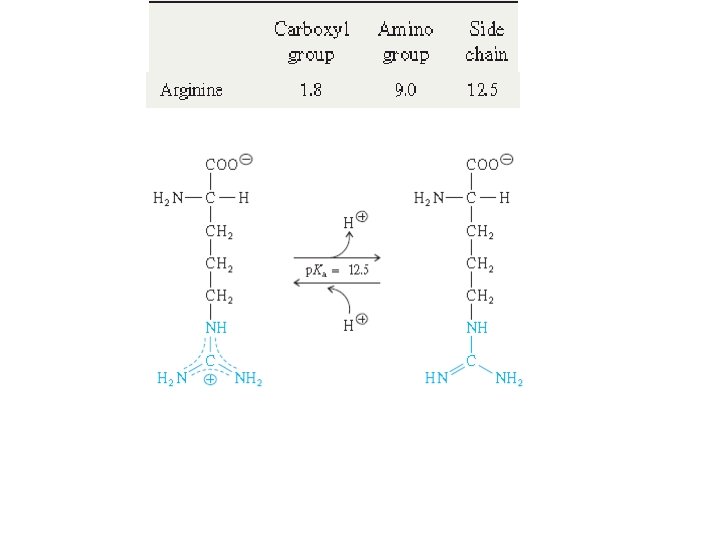
İzoelektrik notka: Histidin • p. KCOOH=1, 8 • p. KNH 2 =9, 3 • p. KR =6, 0 p. H 7, 65 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 3, 55 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 9, 75 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir?


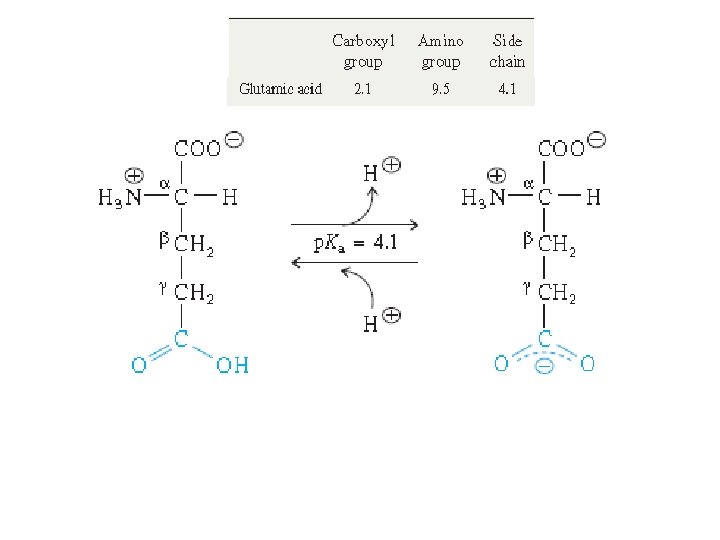
İzoelektrik notka: Glu • p. KCOOH=2, 1 • p. KNH 2 =9, 5 • p. KR COOH =4, 1 p. H 5, 1 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 4, 1 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir? p. H 3, 1 de bu aminoasit çözeltisindeki aminoasitlerin net yükü nedir?


Amino asitler: Peptid bağ oluşumu • İki amino asit birleşerek peptid bağı veya amid bağı oluşturur • Kondensasyon tipi birleşme, su çıkar • Birinci aminoasidin ɑ-karboksil grubu ile diğer amino asidin ɑamino grubu birleşerek • Bu tip bir kondensasyon tepkimesi sulu ortamda kendiliğinden gerçekleşmez • Amino ve karboksil grupları iyon olduğu halde amid halde artık iyonik değildir. Alanin Serin Alaninilserin

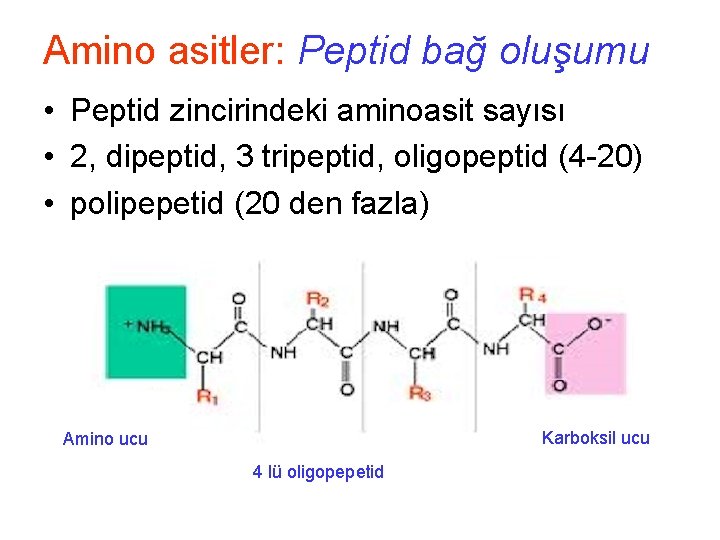
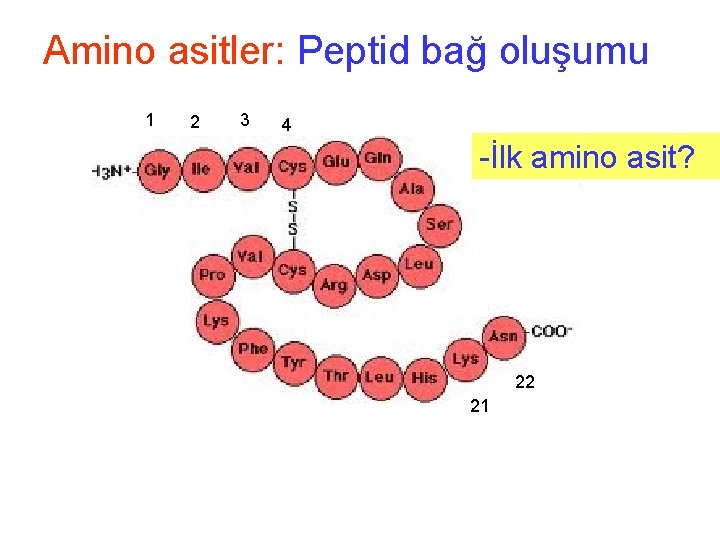
Amino asitler: Peptid bağ oluşumu • Peptid zincirindeki aminoasit sayısı • 2, dipeptid, 3 tripeptid, oligopeptid (4 -20) • polipepetid (20 den fazla) Karboksil ucu Amino ucu 4 lü oligopepetid

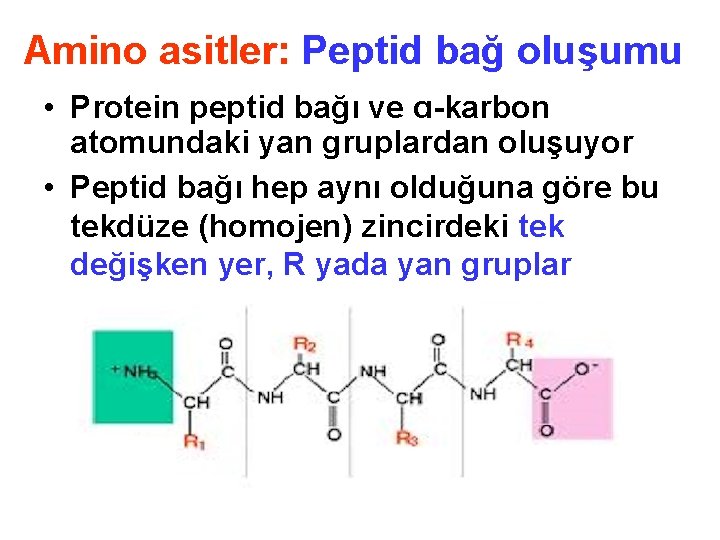
Amino asitler: Peptid bağ oluşumu • Protein peptid bağı ve ɑ-karbon atomundaki yan gruplardan oluşuyor • Peptid bağı hep aynı olduğuna göre bu tekdüze (homojen) zincirdeki tek değişken yer, R yada yan gruplar

Amino asitler: Peptid bağ oluşumu 1 2 3 4 -İlk amino asit? 22 21

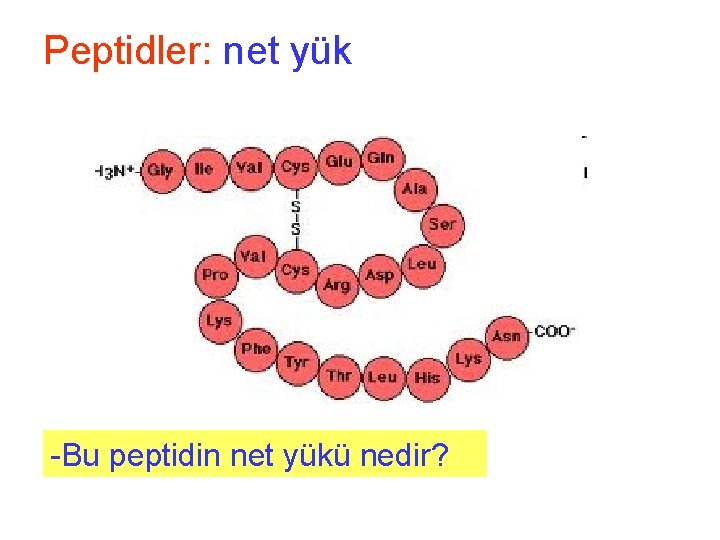
Peptidler: net yük -Bu peptidin net yükü nedir?

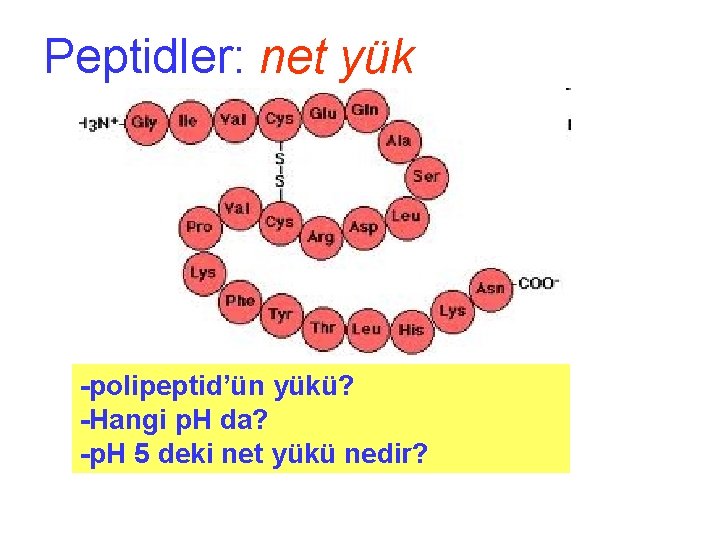
Peptidler: net yük -polipeptid’ün yükü? -Hangi p. H da? -p. H 5 deki net yükü nedir?

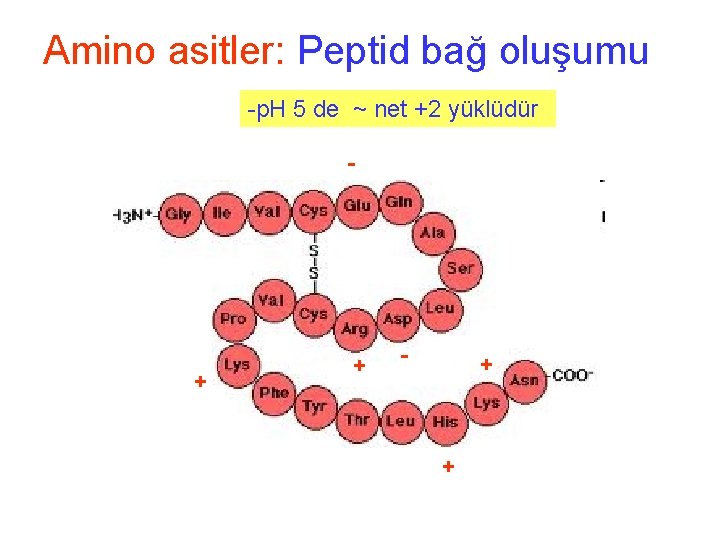
Amino asitler: Peptid bağ oluşumu -p. H 5 de ~ net +2 yüklüdür - + +


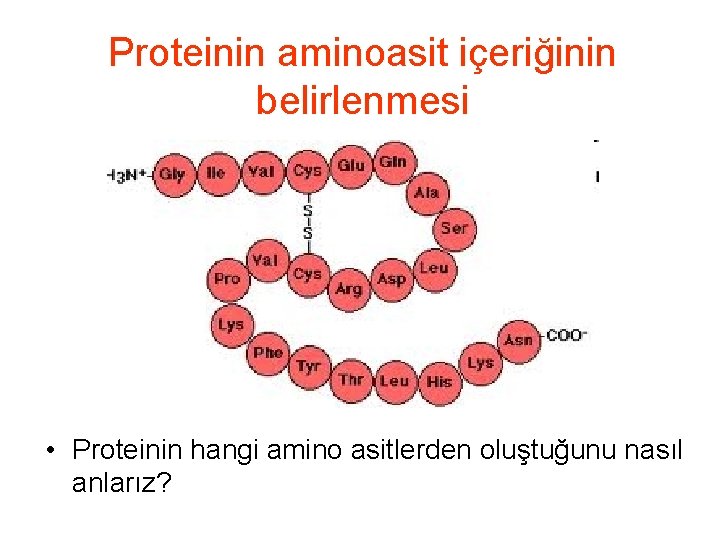
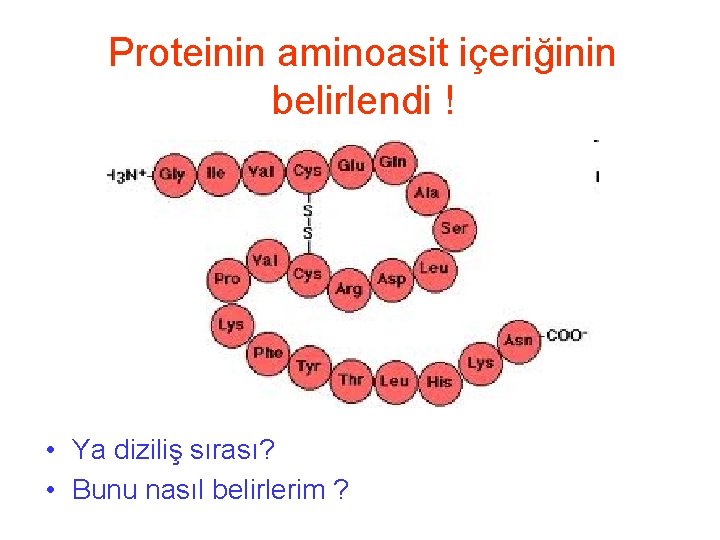
Proteinin aminoasit içeriğinin belirlenmesi • Proteinin hangi amino asitlerden oluştuğunu nasıl anlarız?

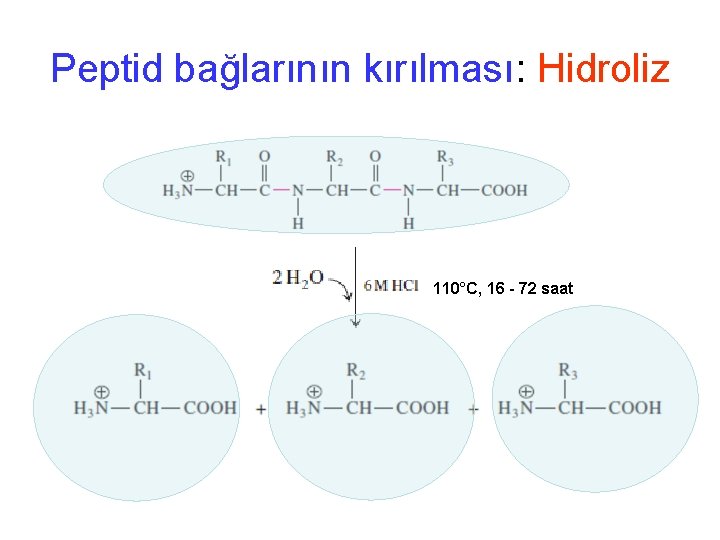
Proteinin aminoasit içeriğinin belirlenmesi • Proteini saflaştır, ortamda tek bir çeşit protein olması lazım • Amino asit içeriğini belirlemek için peptid bağlarının kırılması ve aminoasitlerin tek ayrılması gerekli • Normal olarak asitle peptid bağları kırılabilir. • Protein----6 M HCl---Amino asitler • Ortamdaki aminoasitler kormotoğrafik olarak hem birbirlerinden ayrıştırılır hem de oranları belirlenir • Amino asit analizi

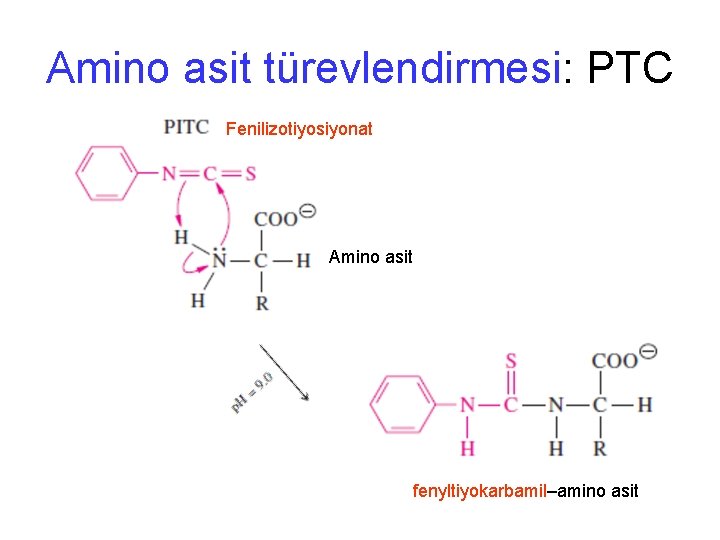
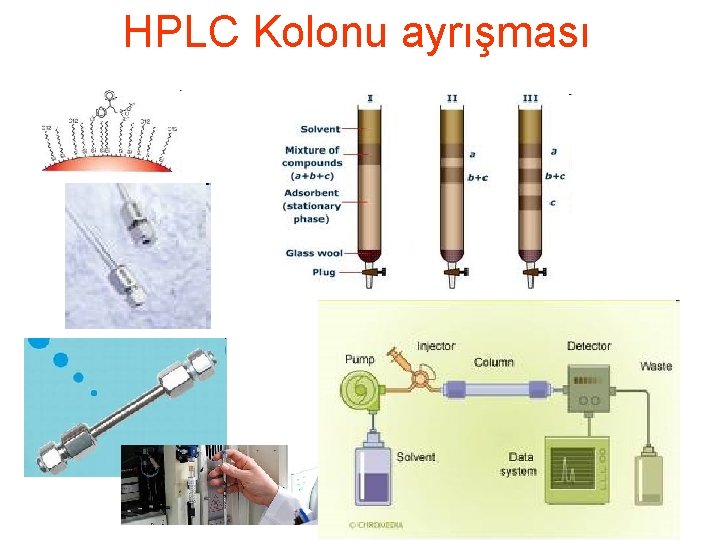
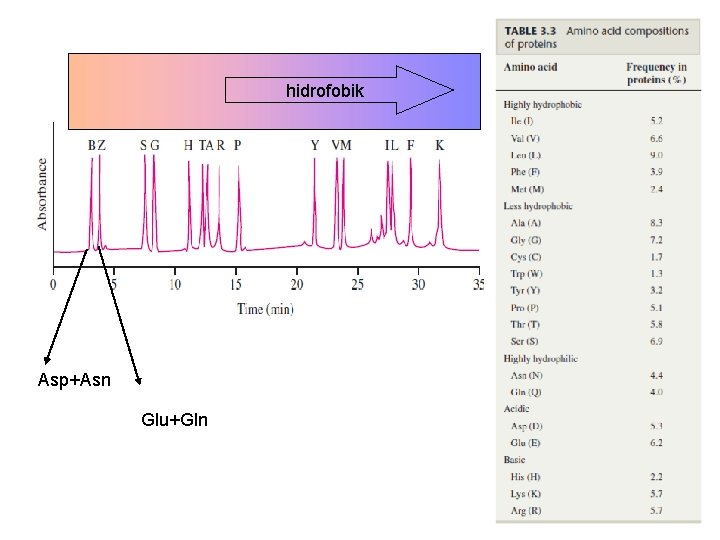
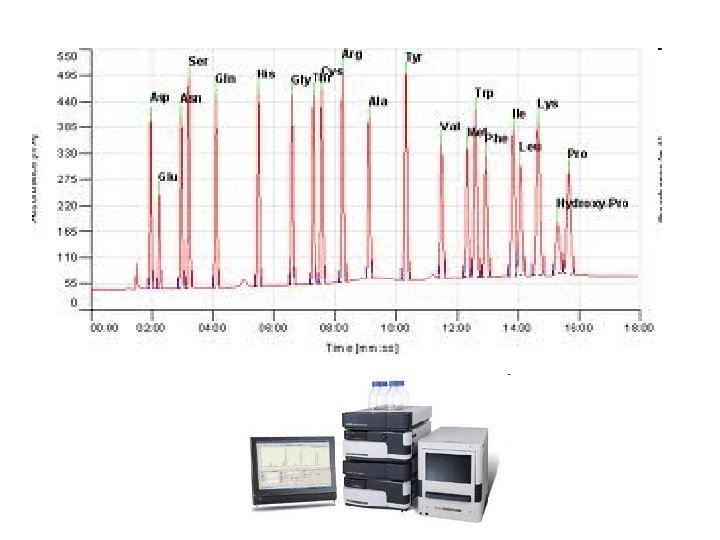
Proteinin aminoasit içeriğinin belirlenmesi • Amino asit analizi 1. Parçalanmış protein 2. fenilizotiosiyanat (phenylisothiocyanate)(PITC) p. H 9. 0 muamele edilirse feniltiokarbomil (PTC)–amino asit türevi oluşur 3. Bu amino asit türevleri HPLC de kısa zincirli hidrokarbon bağlanmış silika kolonunda ayrıştırılır, hidrofobikliklerine göre kolonda birbirlerinden ayrıştırılır 4. Kolondan çıkan amino asit türevlerinin kons. göre sinyal üretilir, UV detektörü ile 254 nm dalga boyunda sinyaller grafik (peak) olarak zaman karşı elde edilir. 5. Her bir amino asit farklı zamanlarda geleceğinden birbirlerinden farklı pikler (farklı amino asitler) ve amino asit konsantrasyonuna göre pik alanı (veya yüksekliği) belirir. 6. Kolondan bilinen amino asit türevlerinin geldiği zaman ve verilen konsantrasyona göre ürettiği grafik alanından yararlanılarak, bilinmeyen amino asitlerin neler olduğu ve konsantrasyonları belirlenir.

Peptid bağlarının kırılması: Hidroliz 110°C, 16 - 72 saat

Amino asit türevlendirmesi: PTC Fenilizotiyosiyonat Amino asit fenyltiyokarbamil–amino asit

HPLC Kolonu ayrışması

hidrofobik Asp+Asn Glu+Gln


Proteinin aminoasit içeriğinin belirlendi ! • Ya diziliş sırası? • Bunu nasıl belirlerim ?

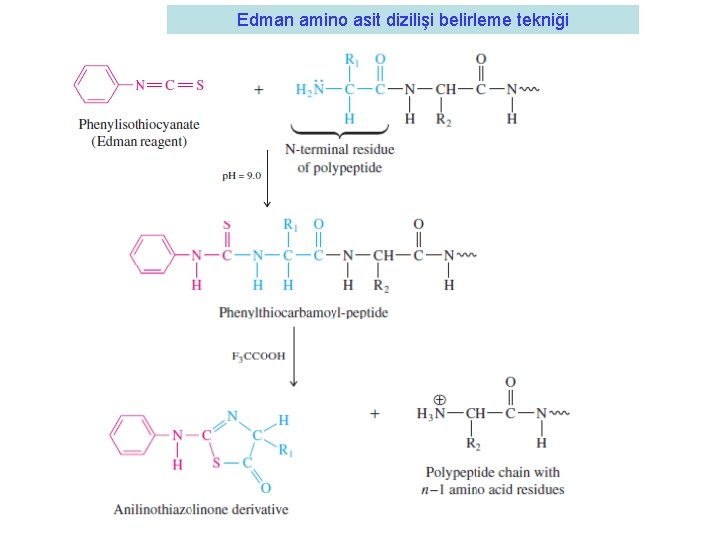
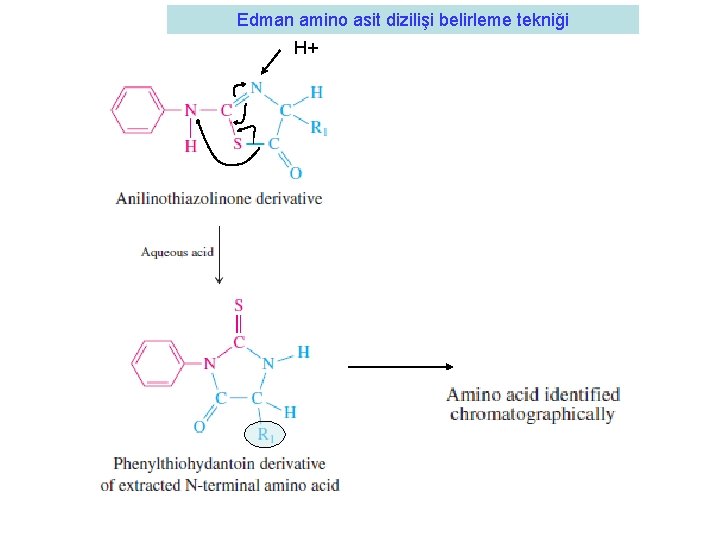
Proteindeki amino asit diziliş sırasının belirlenmesi • 1950 Pehr Edman bir teknik geliştirdi • Proteini Fenilizotiyosiyonat (PITC) kullanarak amino grubundan tek kırarak belirledi • Burada PITC ile sadece amino ucu tepkimeye girmektedir • Feniltiokarbamil-peptid türevi oluşmaktadır. • Bu madde anhidroz bir asitle muamele edildiğinde (örnek olarak trifluoroasetik asit) amino ucundan kırılmaktadır. Anilinotiazolinon türevi oluşmaktadır. • Bu madde ekstrakte edilirek (butil klorit ile) geri kalan peptidten ayrılır ve be olduğu belirlenir.

Edman amino asit dizilişi belirleme tekniği

Edman amino asit dizilişi belirleme tekniği H+

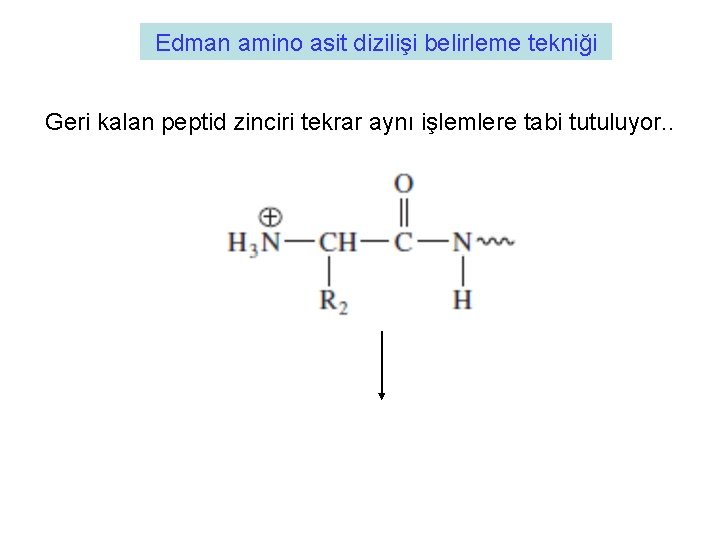
Edman amino asit dizilişi belirleme tekniği Geri kalan peptid zinciri tekrar aynı işlemlere tabi tutuluyor. .

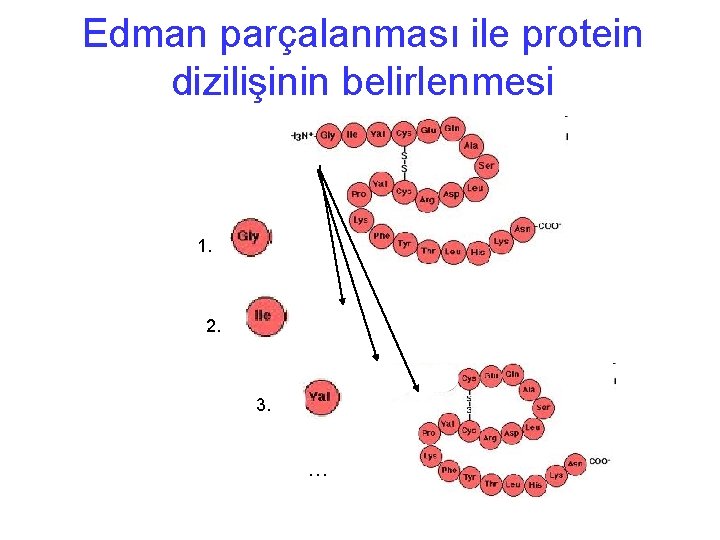
Edman parçalanması ile protein dizilişinin belirlenmesi 1. 2. 3. …

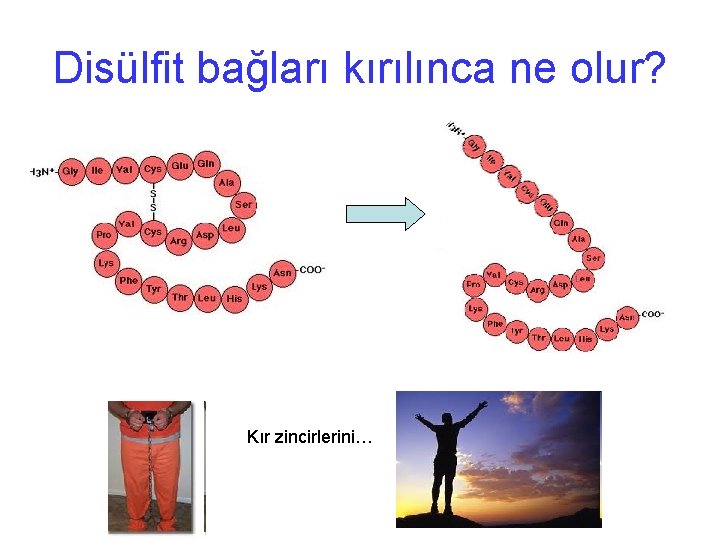
Disülfit bağları kırılınca ne olur? Kır zincirlerini…

Protein dizilişini belirleme: Edman parçalanması • Protein zincirindeki disülfit bağlantıları tiol içeren moleküllerle kırılabilir. • 2 -merkaptoetanol en sıklıkla kullanılır • Sisteinler oksijen varlığında tekrar oksitlenerek – S-S- bağı oluşturmasın diye kapatılmalıdır. • Alkilleme: Ör iodoasetat ile Skarboksimetilsistein lere dönüştürülür • Edman parçalanması yolu ile çok pikomol düzeyindeki proteinlerin bile amino asit dizilişleri belirlenebilir. • Ancak zincir uzadıkça işler karışmaya başlayabilir

Diziliş sırasını belirlemede Edman yöntemine nasıl yardımcı olabiliriz?

Proteazlarla büyük protein molekülü küçük peptidlere ayrılabilir proteaz

Protein dizilişini belirleme: Proteaz parçalaması • Proteinleri parçalayan enzimlerle proteinleri küçültebiliriz. • Proteazlar proteindeki peptid bağlarını parçalar • Çeşitli proteazlar proteini farklı noktalardan keserler • Bu parçacıklar tek Edman parçalanması ile amino asit dizilişleri belirlenir. • Sonra tüm protein parçaları bir araya getirilir • Tripsin, lys ve arginine yan grupları arasından proteini kırar • Staphylococcus aureus V 8 proteazı Glu ve Asp yan gruplarının yanından keser • Kimotripsin, aromatik veya hidrofobik yan grupların yanından keser (Phe, Tyr, Trp gibi)

Protein dizilişini belirleme: Proteaz parçalaması

Protein dizilişini belirleme: başka nasıl bir yol olabilir?

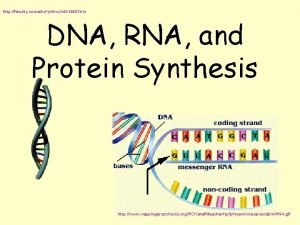
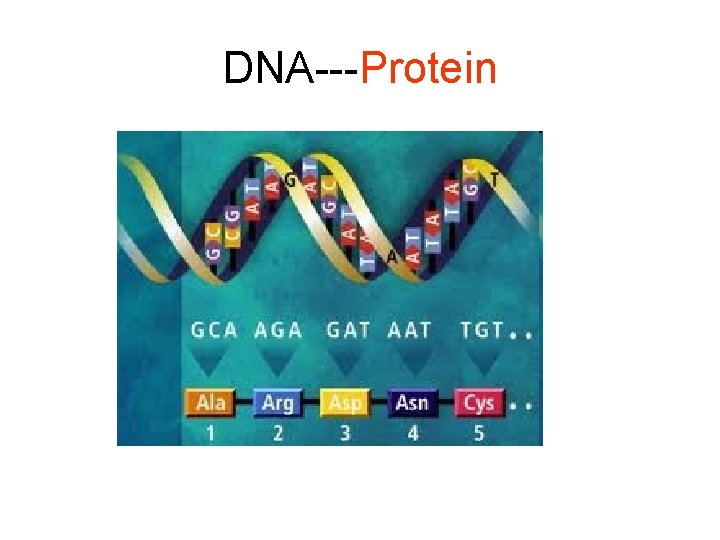
DNA---Protein


DNA--Protein • Doğrudan protein zincirinin belirlenmesine ek olarak • Dolaylı olarak DNA veya Gen dizilişinden protein zinciri çıkarılabilir • Ör: Triptofan aminoasidi yeri ve miktarı doğrudan bulunabilir • Yine Asp ve Asn yerleri belirlenebilir • Nasıl? • Tek bir kodonla belirleniyor. • Diğer aminoasitler birden fazla kodonla belirlenebildiğinden olasılıklar söz konusu oluyor • Sonradan değiştirilen amino asitler belirlenemiyor • Veya zincirin bir kısmı sonradan kesilerek uzaklaştırılmış ise gen de yararlanarak protein zinciri sadece ham olarak belirlenebiliyor

Frederick Sanger • 1953 Frederick Sanger bir proteinin (insulin) protein dizilişini bulduğu için 1956 da Nobel Ödülünü aldı • 1980 Yılında DNA’nın zincir sıralamasını belirleme yöntemi geliştirdiği için 2. Nobel ödülünü aldı. Frederick Sanger (1918– )

Proteinler Bugün… • Binlercesinin dizilişi belirlendi, • Binlercesinin 3 boyutlu biçimsel mimarisi belirlendi, • Veri tabanı oluşturuldu,

Protein Data Bank


Protein dizilişini belirlemek Neler sağlar?

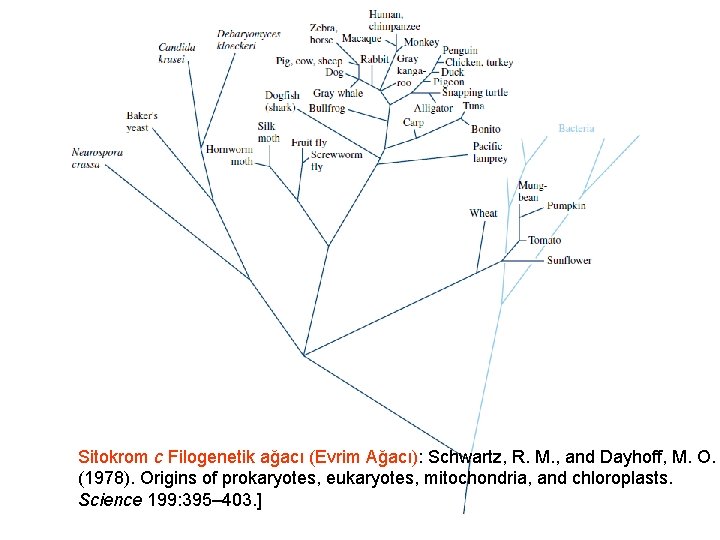
Protein dizilişi • • Aynı protein bir çok canlıda belirlendi Bunlar birbiriyle kıyaslandığında Bunların tarihsel akrabalıkları ortaya çıktı Protein zincir benzerliğinden yola çıkarak türler birbiriyle ilişkilendirildi • Daha sonra yaşamın ağacı oluşturuldu. . • Farklılıklardan yararlanarak ne tür özellikler kazanıldığı veya kaybedildiği belirlendi

Sitokrom c Filogenetik ağacı (Evrim Ağacı): Schwartz, R. M. , and Dayhoff, M. O. (1978). Origins of prokaryotes, eukaryotes, mitochondria, and chloroplasts. Science 199: 395– 403. ]
 Zellikleri
Zellikleri Lizin serum plazma
Lizin serum plazma Ornitin protein
Ornitin protein Arjinin indol yapısı
Arjinin indol yapısı Pirüvat oluşturan amino asitler
Pirüvat oluşturan amino asitler Nonstandart amino asitler
Nonstandart amino asitler Esansiyel aminoasit nedir
Esansiyel aminoasit nedir Standart dışı amino asitler nelerdir
Standart dışı amino asitler nelerdir Alifatik yan zincirli amino asitler
Alifatik yan zincirli amino asitler Valin lösin izolösin metabolizması
Valin lösin izolösin metabolizması Lizin titrasyon eğrisi
Lizin titrasyon eğrisi Nemli yer priz tesisatı
Nemli yer priz tesisatı Gökyüzüne yakın yerlerde meydana gelen hava olayları
Gökyüzüne yakın yerlerde meydana gelen hava olayları Bazların özellikleri
Bazların özellikleri Asitler ve bazlar kavram haritası
Asitler ve bazlar kavram haritası Zayıf bazlar nelerdir
Zayıf bazlar nelerdir Zayıf asit kuvvetli baz titrasyonu
Zayıf asit kuvvetli baz titrasyonu Suda çözündüğünde iyonu veren maddelere baz denir
Suda çözündüğünde iyonu veren maddelere baz denir Karboksil grubu asit mi
Karboksil grubu asit mi 8.sınıf kuralları ortaokul
8.sınıf kuralları ortaokul Vnyz
Vnyz Rektoraji nedir
Rektoraji nedir Iklimlendirmenin temel unsurları
Iklimlendirmenin temel unsurları Koku duyusu neden talamusa uğramaz
Koku duyusu neden talamusa uğramaz Rektal tüp uygulama basamaklari
Rektal tüp uygulama basamaklari Yüksek sıcaklığın neden olduğu rahatsızlıklar
Yüksek sıcaklığın neden olduğu rahatsızlıklar Neden staj yapmak istiyorsunuz sorusuna cevap
Neden staj yapmak istiyorsunuz sorusuna cevap Toplam talep formülü
Toplam talep formülü Kapbis neden açılmıyor
Kapbis neden açılmıyor Tomurcuklanma ile üreme
Tomurcuklanma ile üreme Siyaset felsefesi
Siyaset felsefesi Omurgalılarda sinir şeridi
Omurgalılarda sinir şeridi Ayran yapmanın algoritması
Ayran yapmanın algoritması Immünfiksasyon elektroforezi neden yapılır
Immünfiksasyon elektroforezi neden yapılır Namaz çeşitleri
Namaz çeşitleri Eşek ağılda mı yaşar
Eşek ağılda mı yaşar Yüksek sıcaklığın neden olduğu rahatsızlıklar
Yüksek sıcaklığın neden olduğu rahatsızlıklar Güneş'e neden çıplak gözle bakmamalıyız
Güneş'e neden çıplak gözle bakmamalıyız Uzun dönem arz eğrisi
Uzun dönem arz eğrisi Araba tekerleği neden pürüzlü bir maddedir
Araba tekerleği neden pürüzlü bir maddedir Istiklal marşımıza neden saygı göstermeliyiz
Istiklal marşımıza neden saygı göstermeliyiz Sevr antlaşması neden gecikti
Sevr antlaşması neden gecikti Taşeli platosu neden seyrek nüfusludur
Taşeli platosu neden seyrek nüfusludur Peygamberler neden insanlar arasından seçilmiştir
Peygamberler neden insanlar arasından seçilmiştir Mesleki cilt hastalığına neden olan fiziksel faktörler
Mesleki cilt hastalığına neden olan fiziksel faktörler Q sınıflandırma ölçeği
Q sınıflandırma ölçeği Hedeflerimizi neden söylememeliyiz
Hedeflerimizi neden söylememeliyiz Dilara kaman
Dilara kaman Eba dyned
Eba dyned Nem sıcaklık ilişkisi
Nem sıcaklık ilişkisi Bilgisayar ağları nerelerde kullanılır
Bilgisayar ağları nerelerde kullanılır Peygamberler neden insanlardan seçilmiştir
Peygamberler neden insanlardan seçilmiştir Serveti fünun dergisinin kapatılmasına neden olan olay
Serveti fünun dergisinin kapatılmasına neden olan olay Kinezyoloji ne demek
Kinezyoloji ne demek Neden istiklal marşı yazılmasına gerek duyuldu
Neden istiklal marşı yazılmasına gerek duyuldu Kodlamaya başlamadan önce neden algoritma hazırlıyoruz
Kodlamaya başlamadan önce neden algoritma hazırlıyoruz Kan şekeri değerleri
Kan şekeri değerleri Glop termometre nedir
Glop termometre nedir Işyeri bağıl nem oranı
Işyeri bağıl nem oranı Ifikan
Ifikan Hiyanet i vataniye kanunu neden çıkarılmıştır
Hiyanet i vataniye kanunu neden çıkarılmıştır 23 mayıs 1919 sultanahmet mitingi neden yapıldı
23 mayıs 1919 sultanahmet mitingi neden yapıldı Amino group and carboxyl group
Amino group and carboxyl group Amino acid chart
Amino acid chart Biomedical importance of amino acids
Biomedical importance of amino acids Wikipedia amino acids
Wikipedia amino acids Amino acid derivative hormones
Amino acid derivative hormones Klasifikasi asam amino
Klasifikasi asam amino Role of glycine
Role of glycine Transdeamination of amino acids
Transdeamination of amino acids Amino acid polar
Amino acid polar Dehydration synthesis of amino acids
Dehydration synthesis of amino acids Amino acid substitution matrix
Amino acid substitution matrix Glutamate oxidative deamination
Glutamate oxidative deamination Assessment to service planning asam ladder
Assessment to service planning asam ladder Chemsheets
Chemsheets Materialet termostabile
Materialet termostabile B-pleated sheet
B-pleated sheet How to determine the amino acid sequence
How to determine the amino acid sequence Grupo amino
Grupo amino Urea cycle definition in biochemistry
Urea cycle definition in biochemistry Protein absorption
Protein absorption Soltech ltd
Soltech ltd Glutamate isoelectric point
Glutamate isoelectric point Materialet termostabile
Materialet termostabile Titration curve of amino acids
Titration curve of amino acids Acetylated amino group
Acetylated amino group In pku which amino acid becomes conditionally essential
In pku which amino acid becomes conditionally essential Amino acid chart
Amino acid chart Ninhydrin test for amino acids
Ninhydrin test for amino acids Ketogenic amino acids
Ketogenic amino acids Properties of amino acids
Properties of amino acids Serylglycyltyrosylalanylleucine
Serylglycyltyrosylalanylleucine Sp hybridization of nitrogen
Sp hybridization of nitrogen Nucleotide to amino acid
Nucleotide to amino acid Amino acid classification
Amino acid classification 64 amino acids
64 amino acids Soft bender rods
Soft bender rods Maple syrup urine disease amino acid
Maple syrup urine disease amino acid