Alltagsrelevante Redoxreaktionen Chemie Fachreferat 31 Mrz 2008 Gliederung























- Slides: 23

Alltagsrelevante Redoxreaktionen Chemie Fachreferat, 31. März 2008

Gliederung: o Redoxreaktionen n o Die Verbrennung n n n o Begriffsklärung Redoxreaktionen in der Geschichte Ablauf einer Redoxreaktion Vorraussetzungen Verlauf & Arten der Verbrennung Beispiel: Korrosion von Eisen Der Hochofenprozess n n Aufbau und Ablauf chemischer Prozess

Redoxreaktion: Begriffe o Oxidation Elektronenabgabe; der oxidierte Stoff besitzt eine höhere Oxidationszahl o Reduktion Elektronenaufnahme; der reduzierte Stoff besitzt eine niedrigere Oxidationszahl

Redoxreaktion: Begriffe o Oxidationsmittel ist derjenige Stoff der Elektronen aufnimmt und somit die Oxidation ermöglicht o Reduktionsmittel ist derjenige Stoff der Elektronen abgibt und somit die Reduktion ermöglicht

Redoxreaktion: Begriffe o Redoxvorgang Oxidation und Reduktion sind miteinander gekoppelt und laufen gleichzeitig ab o Oxidationszahlen geben Auskunft über den “Oxidationszustand” eines Stoffes

Oxidationszahlen: Regeln 1. EN Partner < OZ < EP Partner 2. Im Grundzustand Oxidationszahl 0 3. Stellung im PSE 1. 2. 3. Halogene -1 Sauerstoff -2 Alkalimetalle +1

Oxidationszahlen: Regeln 4. Ionenladung = Oxidationszahl 1. 2. 5. Cl⁻ -1 Mg²⁺ +2 Summe OZ = Ionenladung 1. SO₄²⁻ S = +6, O₄ = -2

Redoxreaktionen: Geschichte o Oxidation n o Sauerstoffübertragung Reduktion n Metall aus Metalloxid gewinnen

Redoxreaktion: Ablauf o Oxidation A → A⁺ + e⁻ n o Reduktion B + e⁻ → B⁻ n o Stoff A gibt als Reduktionsmittel (Donator) ein Elektron ab Das Elektron wird vom Oxidationsmittel (Akzeptor) B aufgenommen Redoxreaktion A + B → A⁺ + B⁻ n Stoff A gibt ein Elektron an Stoff B ab

Die Verbrennung o o Oxidation verläuft exotherm Abgabe von Licht, Wärme und flüchtigen Stoffen Verbrennungsgeschwindigkeit und Entzündungstemperatur sind wichtige Parameter

Verbrennung: Entzündungstemperaturen o Beispiele Stoff ϑ in °C Benzin 200 - 300 Heizöl 650 Holz 300

Verbrennung: Verbrennungswärme o Beispiele Stoff Q in KJ Holz (1 kg) 12 000 Erdgas (1 m³) 38 000 Magnesium (1 kg) 14 950 Kupfer (1 kg) 2 000

Verbrennung: Vorraussetzungen o o o Brennbares Material Oxidationsmittel Richtige Mengenverhältnis Gute Vermischung von Material und Oxidationsmittel Katalysator kann beschleunigen oder erst ermöglichen

Verbrennung: Arten o Explosion (schlagartige Verbrennung) n n Plötzlicher Temperatur- und Druckanstieg Volumenausdehnung Freisetzung von großen Energiemengen Entstehung einer Druckwelle

Mehlstaubexplosion

Verbrennung: Arten o Vollständige Verbrennung n Entstehung von Feuer mit Flammenerscheinung

Verbrennung: Arten o Unvollständige Verbrennung n n n Geringe Sauerstoffzufuhr Niedrige Verbrennungstemperatur Entstehung von giften Gasen wie Kohlenmonoxid CO oder polyzyklische aromatische Kohlenwasserstoffe (PAK)

Verbrennung: Arten o Die langsame Verbrennung n n n Bildung einer Metalloxidschicht Verläuft ohne Feuererscheinung Unterhalb der Entzündungstemperatur

Verbrennung: Korrosion o Definition Die von der Oberfläche ausgehende Zerstörung von Werkstoffen durch unbeabsichtigte chemische bzw. elektrochemische Reaktionen mit Stoffen aus der Umwelt bezeichnet man als Korrosion

Verbrennung: Korrosion

Der Hochofenprozess 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Wind (Cowpern) Schmelzzone Kohlungszone Reduktionszone Trocken- und Vorwärmezone Rohstoffeinfüllung Ausströmendes Gichtgas Säule aus Erz, Koks und Kalkstein Schlackentfernung Roheisenentnahme Gichtgasauslass

Der Hochofenprozess Hochofen Brausenstein (1736) Hochofen der Dillinger Hütte

Vielen Dank für die Aufmerksamkeit http: //redox. gironimo. org/
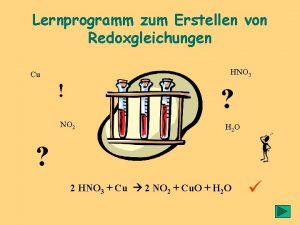
 Redoxreaktion gleichungen
Redoxreaktion gleichungen Redoxgleichungen übungen
Redoxgleichungen übungen 2008 2008
2008 2008 Leise begleitung zusammenfassung
Leise begleitung zusammenfassung Gliederung der bergpredigt
Gliederung der bergpredigt Gliederung in niveaus
Gliederung in niveaus Gliederung biographie
Gliederung biographie Divisionale organisation
Divisionale organisation Gliederung gif
Gliederung gif Apollinisch dionysisch schelling
Apollinisch dionysisch schelling Fachtext definition
Fachtext definition Gliederung des wortschatzes
Gliederung des wortschatzes Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung Deduktive gliederung
Deduktive gliederung Gliederung foto
Gliederung foto Motivationsschreiben gliederung
Motivationsschreiben gliederung Psychologisches gutachten aufbau
Psychologisches gutachten aufbau Gliederung definition
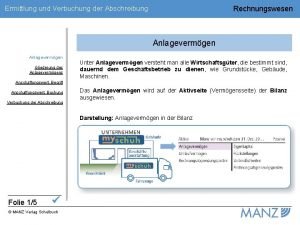
Gliederung definition Gliederung anlagevermögen
Gliederung anlagevermögen Fallstudie gliederung beispiel
Fallstudie gliederung beispiel Gliederung mathematik
Gliederung mathematik Projektstrukturplan gliederung
Projektstrukturplan gliederung Gliederung biografie
Gliederung biografie Klimawandel gliederung
Klimawandel gliederung