Alkil Halida adalah senyawasenyawa yang mengandung halogen yang


















- Slides: 38

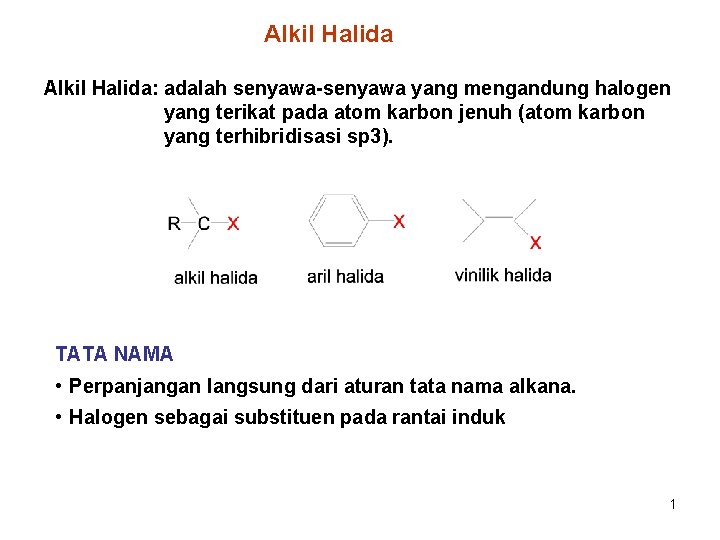
Alkil Halida: adalah senyawa-senyawa yang mengandung halogen yang terikat pada atom karbon jenuh (atom karbon yang terhibridisasi sp 3). TATA NAMA • Perpanjangan langsung dari aturan tata nama alkana. • Halogen sebagai substituen pada rantai induk 1

ATURAN PENAMAAN • Perpanjangan langsung dari aturan tata nama alkana. • Halogen sebagai substituen pada rantai induk 1. Cari dan beri nama rantai induk (rantai utama). Rantai induk adalah rantai karbon terpanjang yang mengandung halogen. 2. Beri nama rantai induk. Penomoran dimulai dari ujung terdekat dengan substituen pertama. 5 -Bromo-2, 4 -dimetilheptana 2 -Bromo-4, 5 -dimetilheptana 2

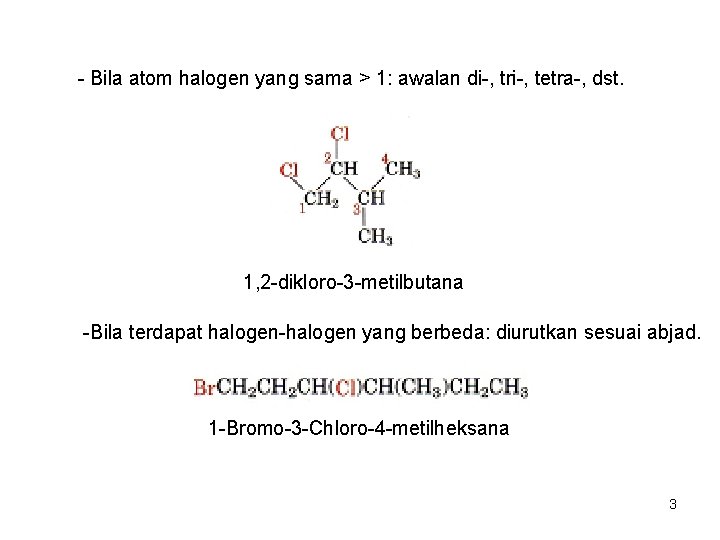
- Bila atom halogen yang sama > 1: awalan di-, tri-, tetra-, dst. 1, 2 -dikloro-3 -metilbutana -Bila terdapat halogen-halogen yang berbeda: diurutkan sesuai abjad. 1 -Bromo-3 -Chloro-4 -metilheksana 3

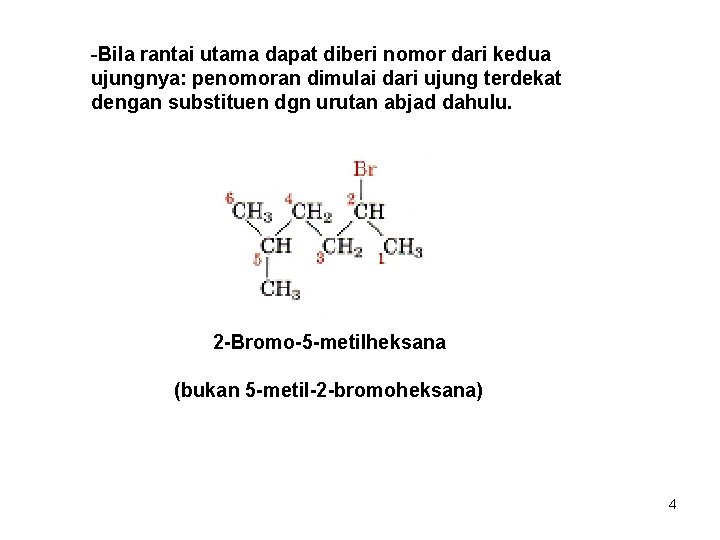
-Bila rantai utama dapat diberi nomor dari kedua ujungnya: penomoran dimulai dari ujung terdekat dengan substituen dgn urutan abjad dahulu. 2 -Bromo-5 -metilheksana (bukan 5 -metil-2 -bromoheksana) 4

KLASIFIKASI ALKIL HALIDA Berdasarkan jumlah atom karbon yang terikat pada atom karbon yang mengandung halogen. • Metil halida (CH 3 X): • Alkil halida primer (1 o): Sebuah karbon yang terikat pada karbon C-X. CH 3 CH 2 – CH 2 X 3. Alkil halida sekunder (2 o): Dua karbon terikat pada karbon C-X. CH 3 CH 2 – CHX | CH 3 4. Alkil halida tersier (3 o): Tiga karbon terikat pada karbon C-X. CH 3 | H 3 C – X | CH 3 5

STRUKTUR ALKIL HALIDA Ikatan C-X (karbon-halogen) : overlap antara orbital hibrid sp 3 C dengan orbital halogen C mempunyai geometri tetrahedral dengan sudut ikatan ± 109 o. ↓ Halogen lebih elektronegatif dibanding karbon: Ikatan C – X akan terpolarisasi: elektron ikatan ditarik lebih ke arah halogen (x) dibanding ke arah karbon (c) Karbon bermuatan positif parsial dan halogen negatif parsial ( -) + C - X Karena atom karbon terpolarisasi positif, maka alkil halida adalah suatu elektrofil. ELEKTROFIL (= suka elektron) : yaitu suatu reagen yang miskin elektron (electron-poor) dan dapat membentuk ikatan dengan menerima sepasang elektron dari suatu reagen yang kaya elektron(elektron-rich-reagent). 6

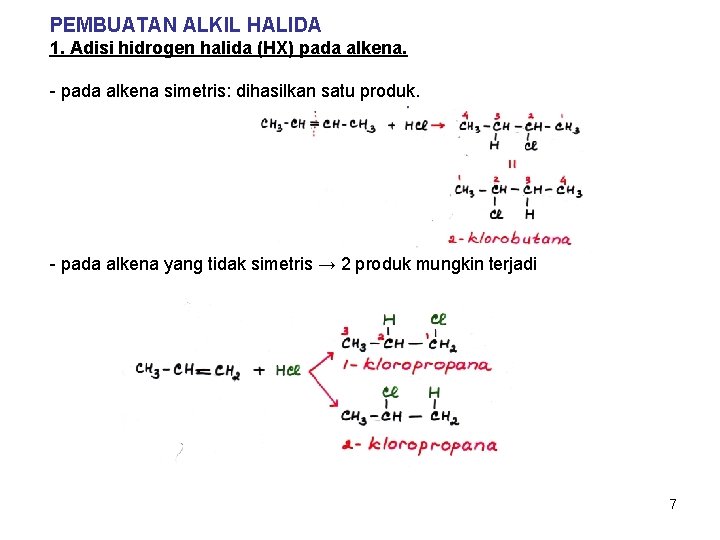
PEMBUATAN ALKIL HALIDA 1. Adisi hidrogen halida (HX) pada alkena. - pada alkena simetris: dihasilkan satu produk. - pada alkena yang tidak simetris → 2 produk mungkin terjadi 7

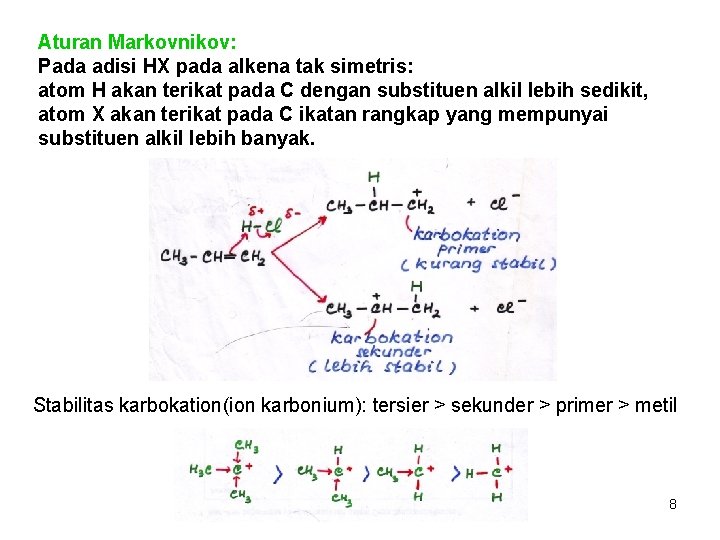
Aturan Markovnikov: Pada adisi HX pada alkena tak simetris: atom H akan terikat pada C dengan substituen alkil lebih sedikit, atom X akan terikat pada C ikatan rangkap yang mempunyai substituen alkil lebih banyak. Stabilitas karbokation(ion karbonium): tersier > sekunder > primer > metil 8

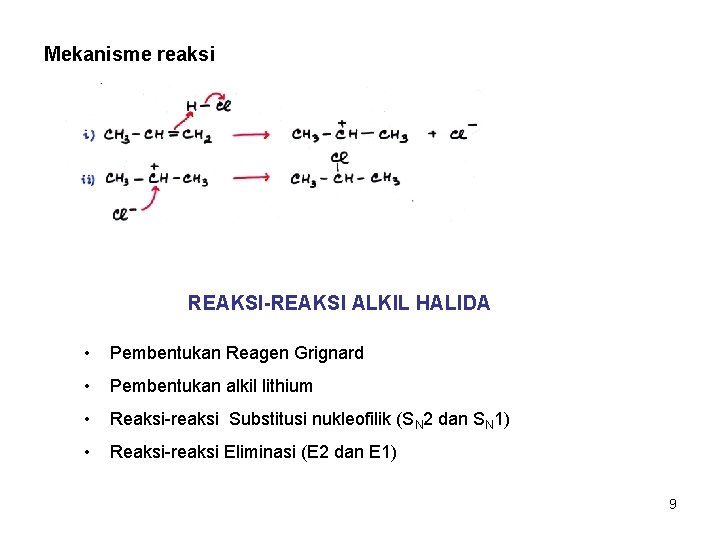
Mekanisme reaksi REAKSI-REAKSI ALKIL HALIDA • Pembentukan Reagen Grignard • Pembentukan alkil lithium • Reaksi-reaksi Substitusi nukleofilik (SN 2 dan SN 1) • Reaksi-reaksi Eliminasi (E 2 dan E 1) 9

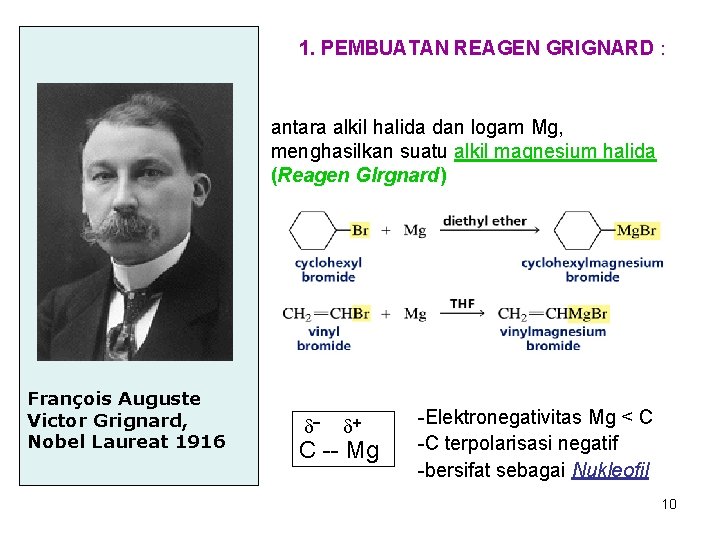
1. PEMBUATAN REAGEN GRIGNARD : antara alkil halida dan logam Mg, menghasilkan suatu alkil magnesium halida (Reagen GIrgnard) François Auguste Victor Grignard, Nobel Laureat 1916 C -- Mg -Elektronegativitas Mg < C -C terpolarisasi negatif -bersifat sebagai Nukleofil 10

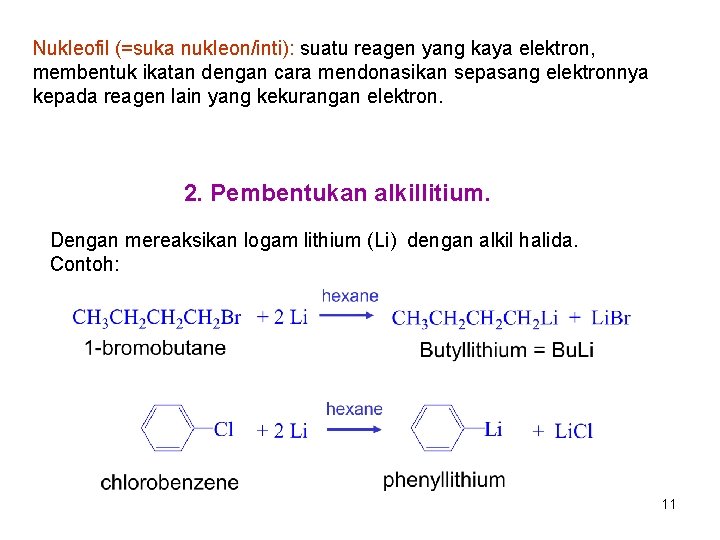
Nukleofil (=suka nukleon/inti): suatu reagen yang kaya elektron, membentuk ikatan dengan cara mendonasikan sepasang elektronnya kepada reagen lain yang kekurangan elektron. 2. Pembentukan alkillitium. Dengan mereaksikan logam lithium (Li) dengan alkil halida. Contoh: 11

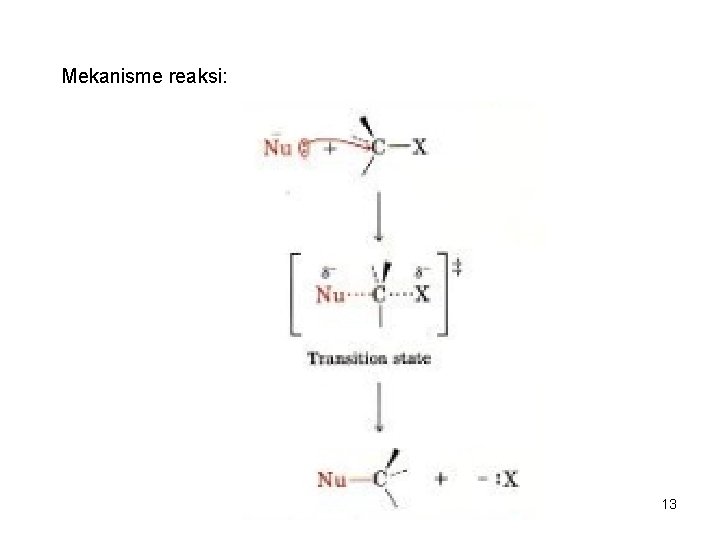
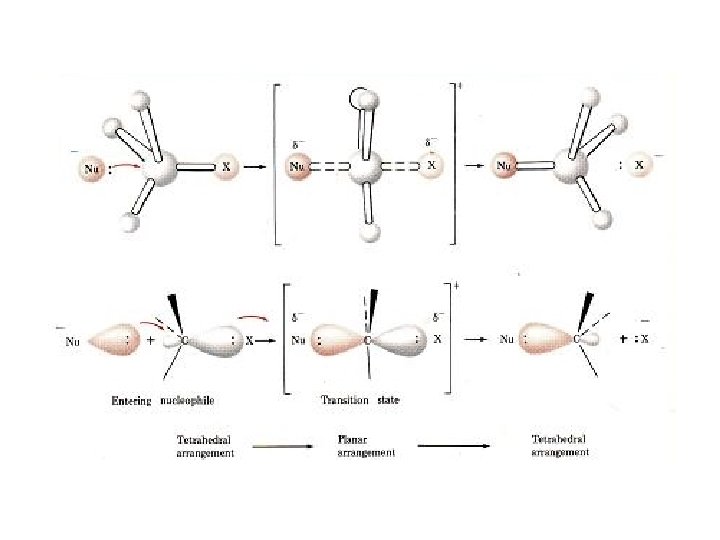
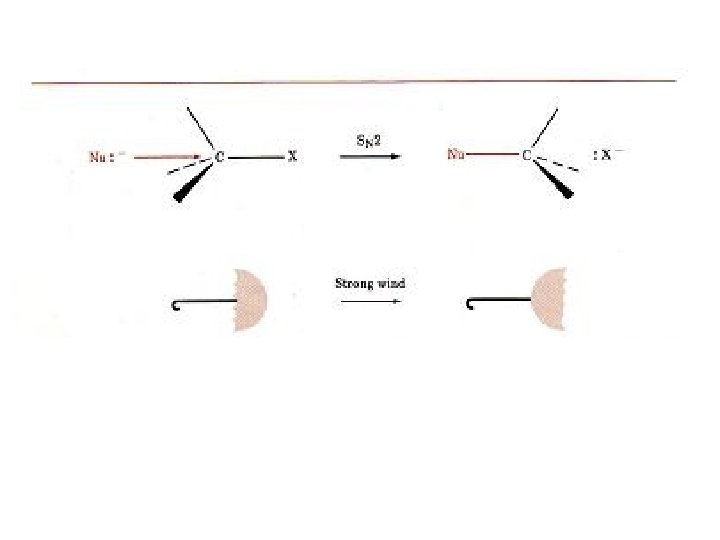
REAKSI SUBSTITUSI NUKLEOFILIK dan REAKSI ELIMINASI = Reaksi antara alkil halida dengan suatu nukleofil • Reaksi substitusi nukleofilik terjadi melalui 2 mekanisme: SN 2 dan SN 1. • Reaksi eliminasi juga dapat terjadi melalui 2 mekanisme: E 2 dan E 1 3. REAKSI SN 2 (Reaksi substitusi nukleofilik bimolekuler). • Bimolekuler, berarti 2 molekul (nukleofil dan alkil halida) keduanya terlibat dalam suatu step (tahap) penentu laju reaksi. - Mengikuti kinetike reaksi order kedua, laju reaksi = k [RX] [Nu: - ] Ciri reaksi: - serangan nukleofil dari arah ‘belakang’ - reaksi berjalan satu step, tanpa intermediate -Terjadi inversi konfigurasi (Inversi Walden) 12

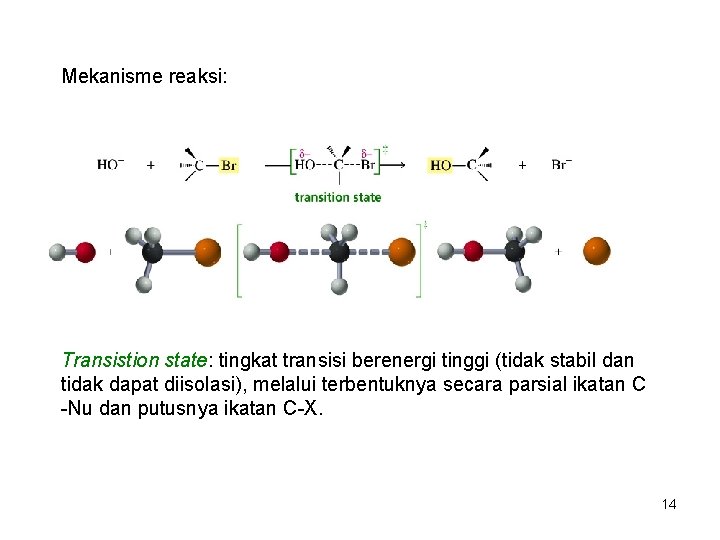
Mekanisme reaksi: 13

Mekanisme reaksi: Transistion state: tingkat transisi berenergi tinggi (tidak stabil dan tidak dapat diisolasi), melalui terbentuknya secara parsial ikatan C -Nu dan putusnya ikatan C-X. 14



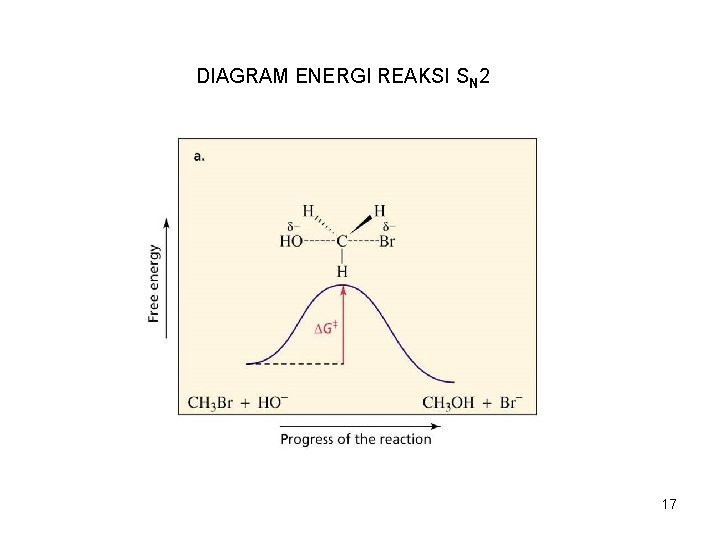
DIAGRAM ENERGI REAKSI SN 2 17

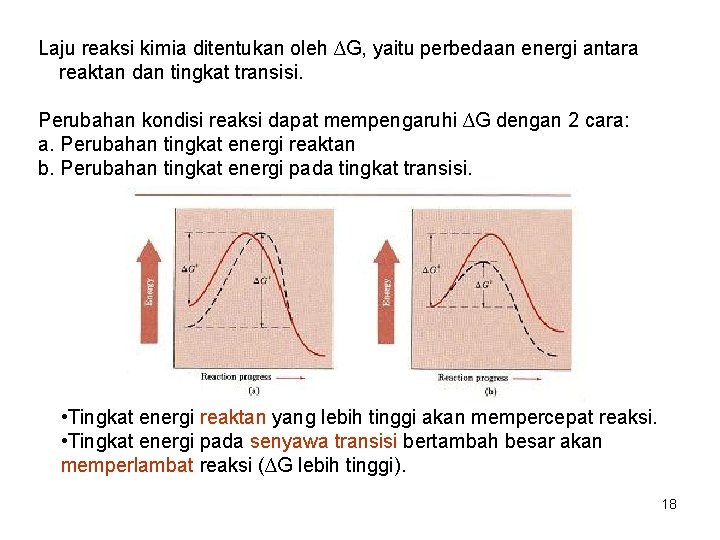
Laju reaksi kimia ditentukan oleh ∆G, yaitu perbedaan energi antara reaktan dan tingkat transisi. Perubahan kondisi reaksi dapat mempengaruhi ∆G dengan 2 cara: a. Perubahan tingkat energi reaktan b. Perubahan tingkat energi pada tingkat transisi. • Tingkat energi reaktan yang lebih tinggi akan mempercepat reaksi. • Tingkat energi pada senyawa transisi bertambah besar akan memperlambat reaksi (∆G lebih tinggi). 18

HAL–HAL YANG BERPENGARUH PADA REAKSI SN 2 : 1. Hambatan sterik 2. Reaktivitas nukleofil 3. Reaktivitas ‘Leaving group’(= gugus pergi) 4. Solven 1. Hambatan sterik • Hambatan sterik mempengaruhi kemudahan nukelofil untuk mendekati substrat • Semakin besar subtituen, semakin terlindungi atom karbon reaksi makin 19 lambat

20

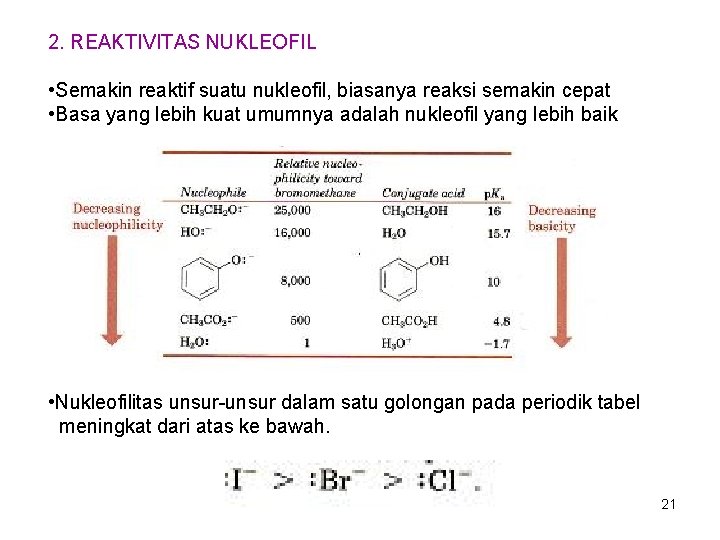
2. REAKTIVITAS NUKLEOFIL • Semakin reaktif suatu nukleofil, biasanya reaksi semakin cepat • Basa yang lebih kuat umumnya adalah nukleofil yang lebih baik • Nukleofilitas unsur-unsur dalam satu golongan pada periodik tabel meningkat dari atas ke bawah. 21

3. REAKTIVITAS ‘LEAVING GROUP’ Basa yang lemah (anion yang diturunkan dari asam yang kuat merupakan ‘Leaving group’ yang kuat. 22

4. EFEK SOLVEN • Reaksi SN 2 berjalan lambat dalam solven protik (hidroksilik), seperti H 2 O, R-OH (alkohol), dsb. • Protik solven menurunkan reaktivitas kebanyakan nukleofil melalui ikatan hidrogen (hidrogen bonding), yang akan menstabilkan nukleofil ( sehingga E ↓ → dan ∆G ↑) kurang reaktif. Anion (nukleofil) yang tersolvasi 23

Sebaliknya, solven aprotik (nonhidroksilik) yang polar akan meningkatkan efektivitas nukleofil, dan reaksi SN 2 akan berjalan lebih cepat. Beberapa contoh solven aprotik polar: • Asetonitril (CH 3 – C≡N) • Dimentil sulfoksida (CH 3)2 SO • Dimentilformamide [(CH 3)2 NCHO)] 24

__ aprotik solven ---- protik solven

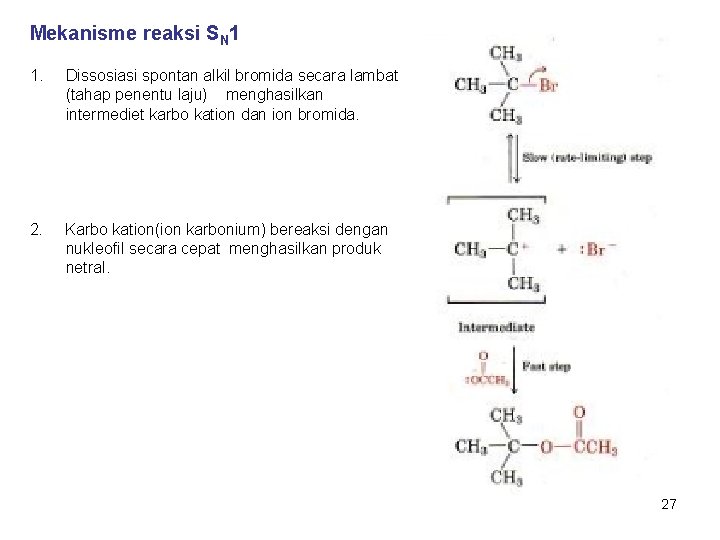
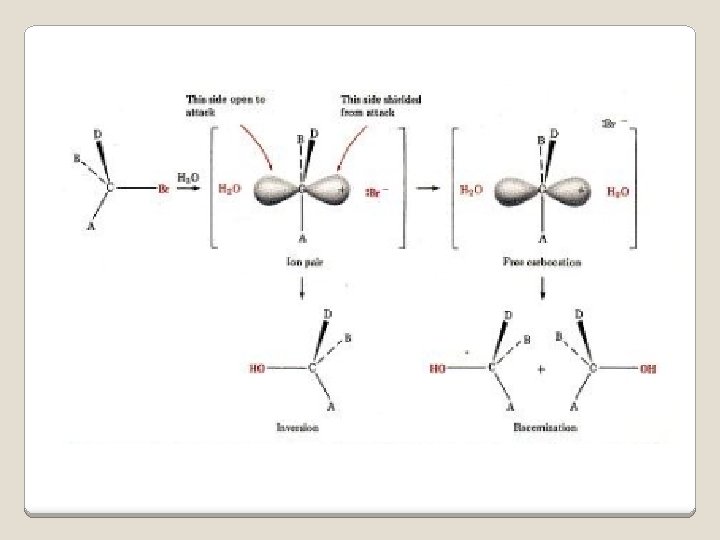
REAKSI SN 1 • Unimolekuler, hanya satu molekul yang terlibat dalam step (tahap) penentu laju. | • Reaksi SN 1 mengikuti kinetika reaksi orde pertama, laju reaksi = K [RX] • Dalam reaksi SN 1, ‘Leaving group’ secara spontan terdissosiasi menghasilkan karbokation (ion karbonium), diikuti serangan yang cepat dari nukleofil (reaksi 2 step) • Terjadi rasemisasi konfigurasi pada atom karbon Reaksi SN 1 kebanyakan terjadi pada substrat tersier. Intermediet(=zat antara = zantara) adalah suatu molekul stabil, dapat diisolasi yang terbentuk pada proses reaksi. A+B→C→D+E C = intermediet. 26

Mekanisme reaksi SN 1 1. Dissosiasi spontan alkil bromida secara lambat (tahap penentu laju) menghasilkan intermediet karbo kation dan ion bromida. 2. Karbo kation(ion karbonium) bereaksi dengan nukleofil secara cepat menghasilkan produk netral. 27



HAL-HAL YANG BERPENGARUH PADA REAKSI SN 1 1. Substrat Semakin stabil intemediet karbonation, semakin cepat reaksi SN 1. Urutan stabilitas ion karbonium Benzyl ≈ Allyl > tersier > sekunder > primer > karbonium metil Karbokation benzyl dan allyl terstabilkan oleh efek resonansi. Urutan stabilitas karbokation tersier, sekunder, primer dan karbonium metil adalah : 30

2. Leaving group(gugus pergi) Semakin baik Leaving group, akan semakin cepat reaksi SN 1. I: - > Br: - > Cl: - > H 2Ö: Reaksi SN 1 sering dilakukan dibawah kondisi asam, dan air netral akan dilepas sebagai leaving group. Pada kasus ini, alkohol akan terprotonasi dan melepaskan air untuk membentuk ion karbonium. 31

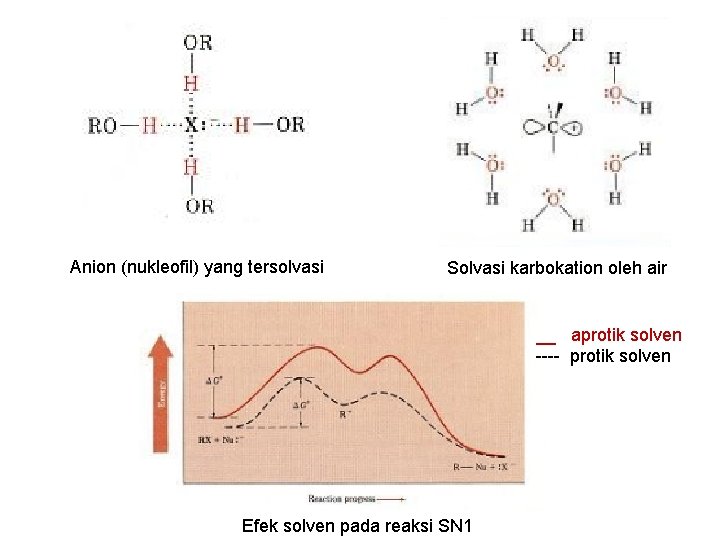
3. NUKLEOFIL Berbeda dengan reaksi SN 2 dalam reaksi SN 1, nukleofil tidak memainkan peranan utama. Mengapa? ? Karena nukleofil tidak terlibat dalam tahap penentu laju reaksi. Mis: pada reaksi t-butil alkhol → t-butil klorida, laju reaksinya sama, apakah X nya Cl, Br atau I. 4. SOLVENT Solven dapat mempengaruhi laju reaksi. • Beberapa solven berinteraksi dengan ion karbonium dan menstabilkannya. Akibatnya, ∆G akan turun dan reaksi berjalan lebih cepat. • Solven, mis: air dan metanol adalah bagus untuk mensovasi ion karbonium, • non polar solvent, seperti hidrokarbon jelek dalam mensolvasi ion. 32

Anion (nukleofil) yang tersolvasi Solvasi karbokation oleh air __ aprotik solven ---- protik solven Efek solven pada reaksi SN 1

Alasan pengaruh solven pada reaksi SN 1 dan SN 2 berbeda. Pada SN 2, reaksi berjalan dengan cepat dalam polar aprotik solven, dan berjalan lebih lambat dalam protik solven, ( energi ground-state dari nukleofil yang menyerang diturunkan oleh adanya solvasi yang menyebabkan naiknya ∆G) Pada reaksi SN 1, reaksi berjalan baik pada polar protik soven, karena tingkat energi transition-state lebih diturunkan dibanding energi groundstate dari nukleofil. 34

REAKSI ELIMINASI ALKIL HALIDA 2 macam reaksi yang mungkin terjadi bila suatu nukleofil (basa Lewis) menyerang alkil halida : 1. Reagen menyerang atom karbon dan menggantikan halida(x) → SN 1 & SN 2 2. Reagen menyerang hidrogen dan membebaskan HX untuk membentuk alkena. → E 1 & E 2 REAKSI E 2 (= Reaksi Eliminasi Bimolekuler) Pada banyak hal, analog dengan reaksi SN 2 Reaksi E 2 mengikuti kinetika orde kedua karena baik nukleofil(basa) dan alkil halida terlibat dalam tahap penentu laju. Laju reaksi = K [ RX ] [ basa ] Reaksi E 2 merupakan reaksi satu tahap tanpa terbentuk intermediet. 35

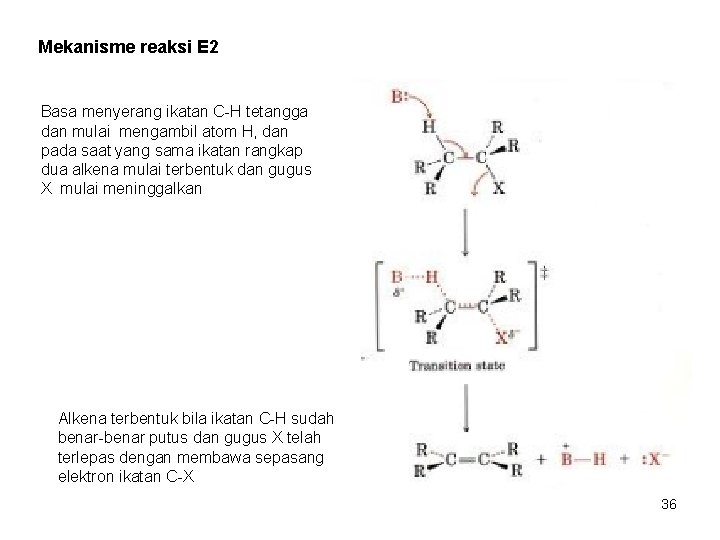
Mekanisme reaksi E 2 Basa menyerang ikatan C-H tetangga dan mulai mengambil atom H, dan pada saat yang sama ikatan rangkap dua alkena mulai terbentuk dan gugus X mulai meninggalkan Alkena terbentuk bila ikatan C-H sudah benar-benar putus dan gugus X telah terlepas dengan membawa sepasang elektron ikatan C-X 36

REAKSI E 1 (= Reaksi Eliminasi Unimolekuler) Pada banyak hal, analog dengan reaksi SN 1 Reaksi E 1 mengikuti kinetika orde kedua karena baik nukleofil (basa) dan alkil halida terlibat dalam tahap penentu laju. Laju reaksi = K [ RX ] Reaksi E 2 merupakan reaksi dua tahap melalui terbentuknya intermediet ion karbonium. 37

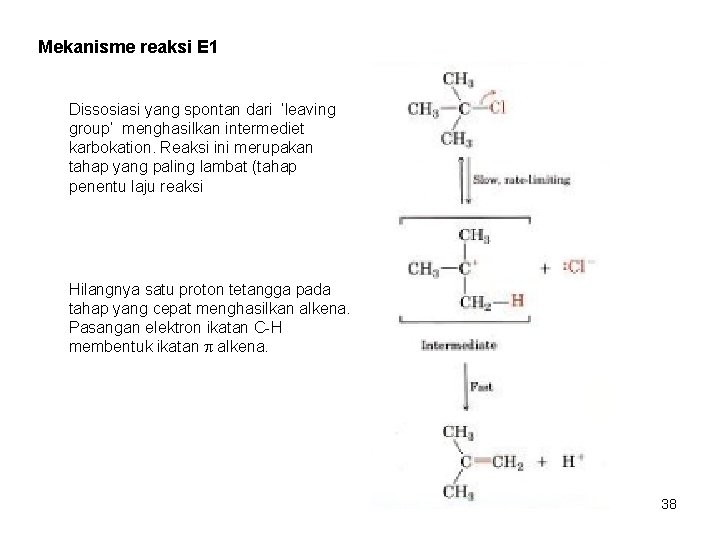
Mekanisme reaksi E 1 Dissosiasi yang spontan dari ‘leaving group’ menghasilkan intermediet karbokation. Reaksi ini merupakan tahap yang paling lambat (tahap penentu laju reaksi Hilangnya satu proton tetangga pada tahap yang cepat menghasilkan alkena. Pasangan elektron ikatan C-H membentuk ikatan alkena. 38
 Reaksi alkil halida
Reaksi alkil halida Penamaan alkil halida
Penamaan alkil halida Reaksi
Reaksi Alkil halida
Alkil halida Adalah
Adalah Kalimat yang menggunakan kata kajian adalah
Kalimat yang menggunakan kata kajian adalah Teknologi bahan penyegar
Teknologi bahan penyegar Contoh minuman nourishing
Contoh minuman nourishing Gunakan 3 cara yang berbeda dalam menamai sudut
Gunakan 3 cara yang berbeda dalam menamai sudut Paragraf merupakan bagian dari sebuah
Paragraf merupakan bagian dari sebuah Metil halida
Metil halida Pelarut organik dan anorganik
Pelarut organik dan anorganik Senyawa halogen adalah
Senyawa halogen adalah Golongan gas mulia
Golongan gas mulia Bulky bases
Bulky bases Senyawa turunan alkana
Senyawa turunan alkana Harmful irritant (bahaya iritasi)
Harmful irritant (bahaya iritasi) Benzensulfonska kiselina
Benzensulfonska kiselina Alkil halojenür
Alkil halojenür Alkil dihalida
Alkil dihalida Struktur etil propilamina
Struktur etil propilamina Bagian inti sel yang mengandung pembawa sifat keturunan
Bagian inti sel yang mengandung pembawa sifat keturunan Bilangan yang mengandung pecahan
Bilangan yang mengandung pecahan Kata hubung perbandingan
Kata hubung perbandingan Contoh berita yang mengandung news value
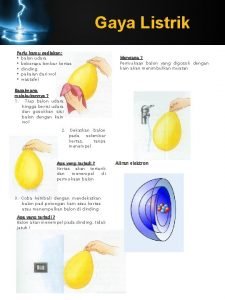
Contoh berita yang mengandung news value Balon yang digosok pada kain mengandung gaya
Balon yang digosok pada kain mengandung gaya Soal tekanan zat padat
Soal tekanan zat padat Organ yang berfungsi membuang sampah mengandung nitrogen
Organ yang berfungsi membuang sampah mengandung nitrogen Suatu simpul yang tidak mengandung ruas disebut
Suatu simpul yang tidak mengandung ruas disebut Kuda purba
Kuda purba Definisi algoritma adalah
Definisi algoritma adalah Period 2, atomic mass 11
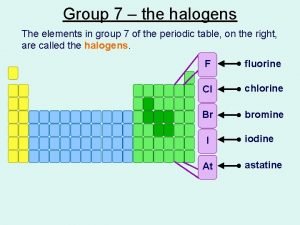
Period 2, atomic mass 11 Where are the halogens
Where are the halogens Halogen kapalného skupenství
Halogen kapalného skupenství Halogens electronic structure
Halogens electronic structure Halogen atomic radius
Halogen atomic radius ჰალოგენები
ჰალოგენები Why does the reactivity decrease in group 7
Why does the reactivity decrease in group 7 Uv licht terrarium
Uv licht terrarium