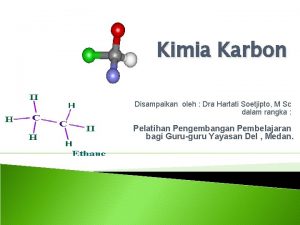
ALKENA Rumus Umum Cn H 2 n Alkena












![Isomer pertautan (linkage isomer) : SCN- vs : NCS- [Mn(SCN)(CO)5] : NO 2 - Isomer pertautan (linkage isomer) : SCN- vs : NCS- [Mn(SCN)(CO)5] : NO 2 -](https://slidetodoc.com/presentation_image_h/b22a1a879d6faea935ec99215a11ab7f/image-25.jpg)




![ISOMER GEOMETRIK [ ISOMER CIS-TRANS] • Isomer ini khusus terjadi pada senyawa alkena yang ISOMER GEOMETRIK [ ISOMER CIS-TRANS] • Isomer ini khusus terjadi pada senyawa alkena yang](https://slidetodoc.com/presentation_image_h/b22a1a879d6faea935ec99215a11ab7f/image-32.jpg)





- Slides: 45

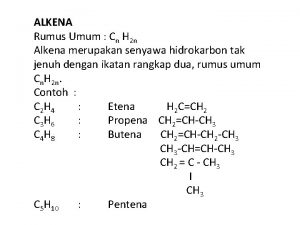
ALKENA Rumus Umum : Cn H 2 n Alkena merupakan senyawa hidrokarbon tak jenuh dengan ikatan rangkap dua. Contoh : C 2 H 4 : Etena H 2 C=CH 2 C 3 H 6 : Propena CH 2=CH-CH 3 C 4 H 8 : Butena CH 2=CH-CH 2 -CH 3 CH 3 -CH=CH-CH 3 CH 2 = C - CH 3 I CH 3 C 5 H 10 : Pentena

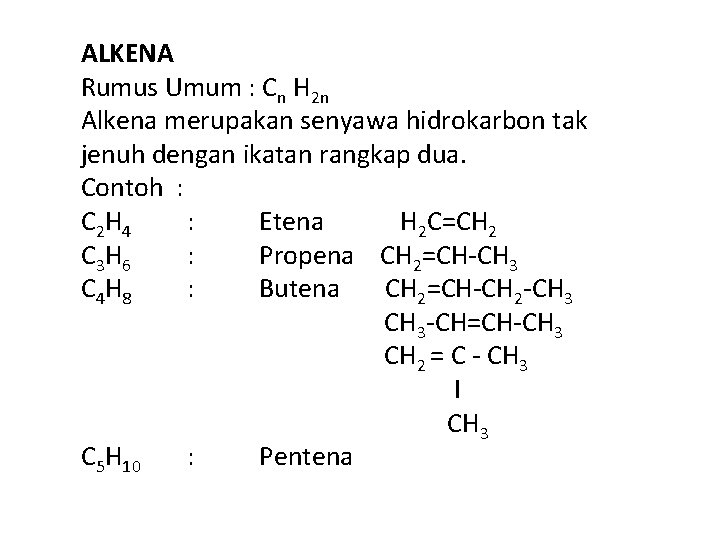
ALKANA Cn. H 2 n+2 IKATAN TUNGGAL ALKENA Cn. H 2 n IKATAN RANGKAP CH 4 metana - ALKUNA Cn. H 2 n-2 IKATAN RANGKAP TIGA - C 2 H 6 etana C 2 H 4 etena C 2 H 2 etuna C 3 H 8 C 3 H 6 propana propena C 3 H 4 propuna

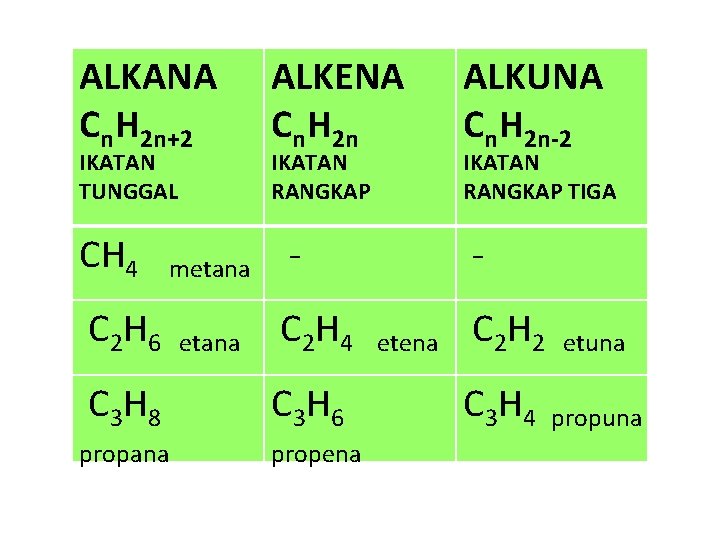
Tata Nama Alkena: 1. Rantai utama harus terpanjang dan mengandung ikatan rangkap. 2. Penomoran pada rantai C utama dimulai dari ujung yang terdekat dengan ikatan rangkap. 3. Rantai utama diberi nama sesuai nama alkana tetapi berakhiran ena. 4. Jika pada alkena terdapat dua atau tiga ikatan rangkap, maka pada nama diberi akhiran diena atau triena. Contoh: C 4 H 8 memiliki 3 isomer struktur H 2 C = CH – CH 2– CH 3 1 -butena H 3 C - CH = CH– CH 3 2 -butena H 2 C = C – CH 3 2 -metilpropena I CH 3

Jika dalam satu molekul terdapat lebih dari satu gugus fungsi, maka dalam penamaannya perlu memperhatikan deret prioritas gugus fungsi. Gugus fungsi yang prioritasnya lebih tinggi digunakan sebagai induk, sementara yang lainnya dianggap sebagai cabang (substituen). Berikut ini urutan prioritas gugus fungsi senyawa organik. COOH>COOC>COX>CONR 2>CN>COH>COOH>>SH>NR 2 > C=C > C≡C

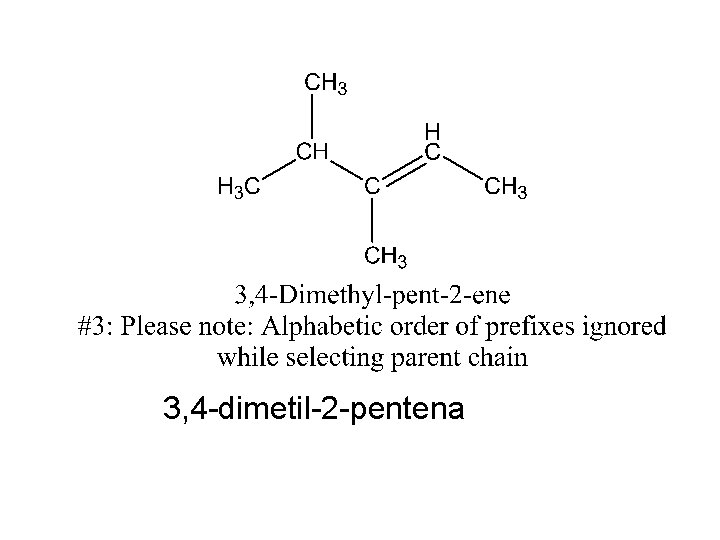
3, 4 -dimetil-2 -pentena

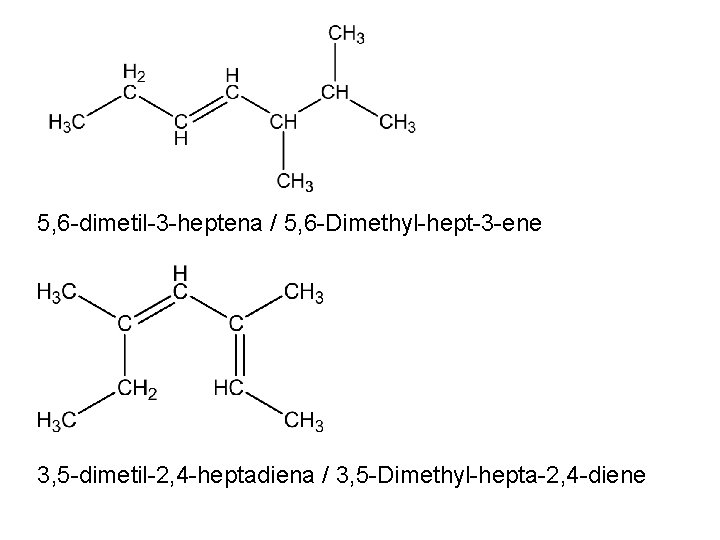
5, 6 -dimetil-3 -heptena / 5, 6 -Dimethyl-hept-3 -ene 3, 5 -dimetil-2, 4 -heptadiena / 3, 5 -Dimethyl-hepta-2, 4 -diene

Rangka Struktur Posisi Fungsi Isomer Geometri Ruang Optis

1. Isomer rantai /rangka = isomer yang disebabkan kerangka karbon yang berbeda (rumus molekul sama, rantai induk berbeda) 2. Isomer posisi = isomer yang disebabkan perbedaan letak dari gugus fungsi pada rantai induk (rumus molekul dan rantai induk sama tetapi letak cabang/gugus fungsi beda) 3. Isomer Fungsi = isomer yang disebabkan perbedaan gugus fungsi. 4. Isomer Geometri = isomer yang disebabkan perbedaan letak atom(gugus atom) yang sama dalam ruang. syarat : a. Rantai induknya memiliki atom C yang berikatan rangkap (-C=C-) b. Pada atom C berikatan rangkap mengikat 2 atom/gugus atom yang berbeda.

ISOMER FUNGSI disebabkan perbedaan gugus fungsi (bagian yang reaktifnya berbeda) Gugus fungsi= * Atom/gugusan atom yang menentukan sifat senyawa * Bagian yang reaktif dari senyawa tersebut Contoh 1. Alkena dengan sikloalkana Cn. H 2 n 2. Alkuna dengan alkadiena dan sikloalkena Cn. H 2 n-2

Stereoisomer = Senyawa berlainan yang memiliki struktur sama, tetapi berbeda dalam hal penataan atom-atom dalam ruangan. Isomer Geometri: disebabkan perbedaan arah /orientasi gugus-gugus tertentu dalam molekul dengan struktur yang sama. 4. Isomer Geometri pada alkena= Isomer yang disebabkan perbedaan letak atom/gugus atom yang sama disekitar atom C yang berikatan rangkap. syarat : a. Rantai induknya memiliki atom C yang berikatan rangkap (-C=C-) b. Pada atom C berikatan rangkap mengikat 2 atom/gugus atom yang berbeda. 5. Isomer optik = isomer yang disebabkan perbedaan dalam memutar cahaya terpolarisasi.

Monokromator Cahaya polikromatik Sampel Cahaya Monokromatik 0 o 180 o


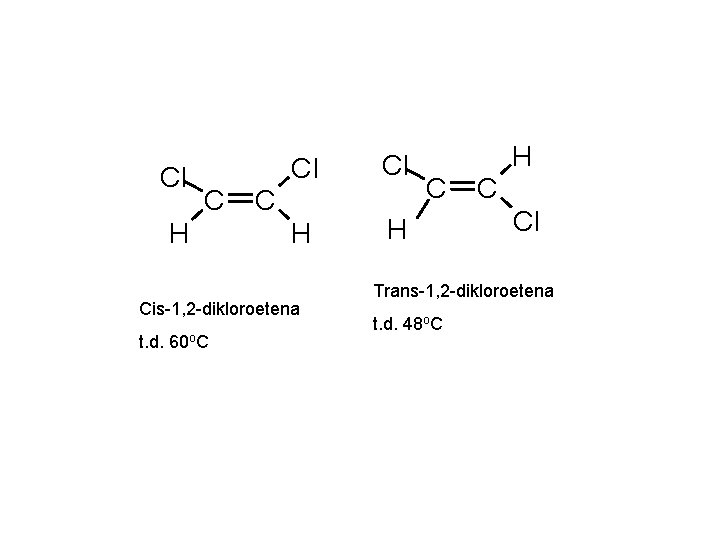
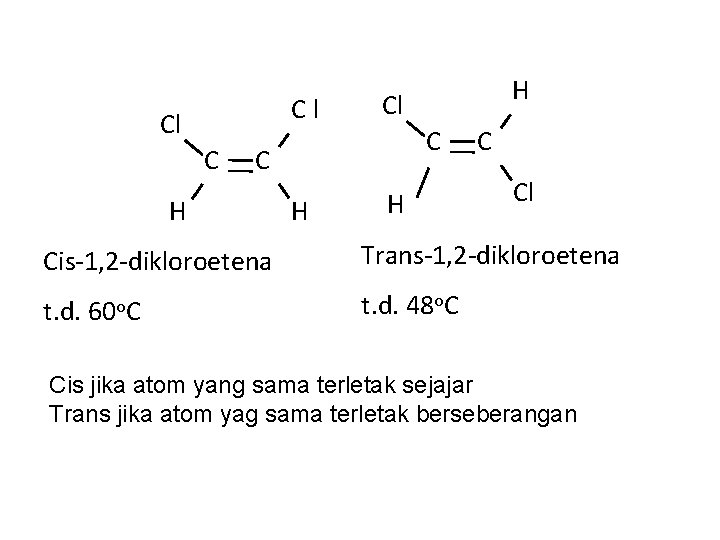
Cl C H Cl Cl H H C Cis-1, 2 -dikloroetena t. d. 60 o. C H C C Cl Trans-1, 2 -dikloroetena t. d. 48 o. C

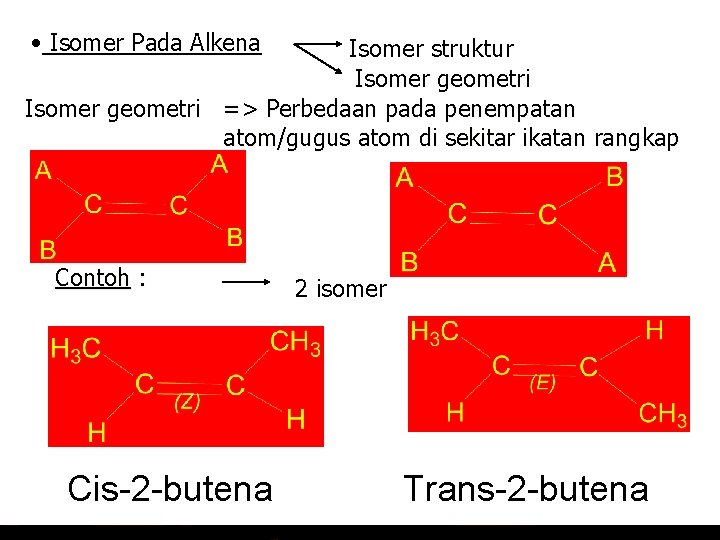
• Isomer Pada Alkena Isomer struktur Contoh : Isomer struktur Isomer geometri => Perbedaan pada posisi ikatan rangkap, posisi cabang atau karena perbedaan kerangka atom C Senyawa dengan rumus C 4 H 8 1. 1 -butena 2. 2 -butena 1 -butena 3. 2 -metilpropena

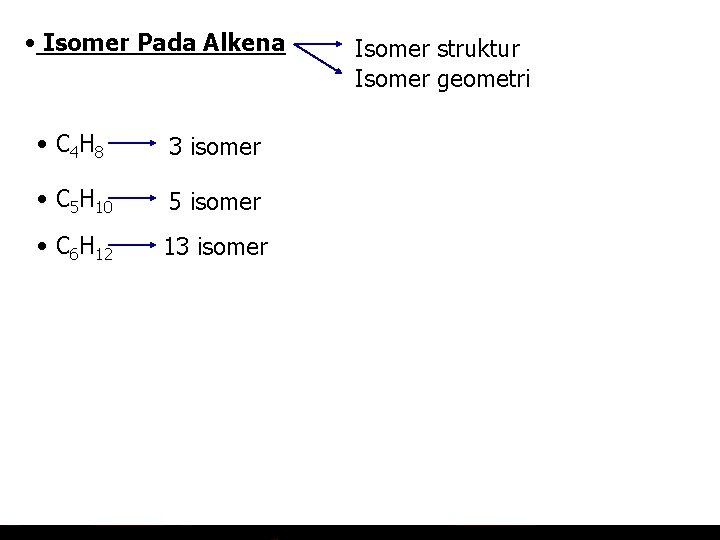
• Isomer Pada Alkena • C 4 H 8 3 isomer • C 5 H 10 5 isomer • C 6 H 12 13 isomer Isomer struktur Isomer geometri


Isomer Pada Alkena Isomer pada alkena bisa terjadi karena perbedaan rantai karbonnya (Isomer rantai / kerangka) atau perbedaan letak ikatan rangkapnya (Isomer posisi) dan isomer geometri. Apa yang dimaksud dengan stereoisomer (Isomer Ruang)? Dalam stereoisomer, atom yang menghasilkan isomer berada posisi yang sama namun memiliki pengaturan keruangan yang berbeda. Stereoisomer meliputi isomer geometri dan isomer optik. Isomer Geometrik (cis / trans) Bagaimana isomer geometrik muncul Isomer ini muncul saat anda melakukan rotasi tertentu dalam molekul.

• Isomer Pada Alkena Isomer struktur Isomer geometri => Perbedaan pada penempatan atom/gugus atom di sekitar ikatan rangkap Cis (Z) Contoh : Trans (E) 2 -butena 2 isomer Cis-2 -butena trans-2 -butena Trans-2 -butena

Syarat: punya ikatan rangkap C=C yang masing-masing mengikat dua atom atau gugus atom yang berbeda H 3 C H C C C l H 3 C Cl TIDAK ADA ISOMER GEOMETRI C Cl H ADA ISOMER GEOMETRI

Cl Cl H H C Cl Cis-1, 2 -dikloroetena Trans-1, 2 -dikloroetena t. d. 60 o. C t. d. 48 o. C Cis jika atom yang sama terletak sejajar Trans jika atom yag sama terletak berseberangan

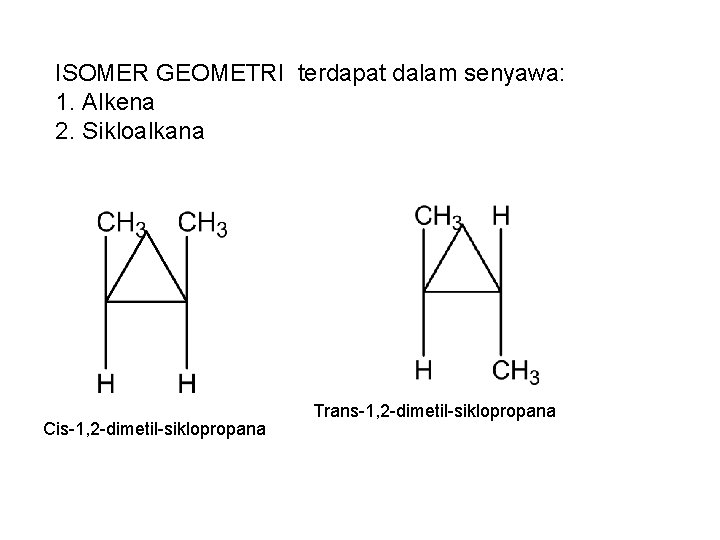
ISOMER GEOMETRI terdapat dalam senyawa: 1. Alkena 2. Sikloalkana Cis-1, 2 -dimetil-siklopropana Trans-1, 2 -dimetil-siklopropana

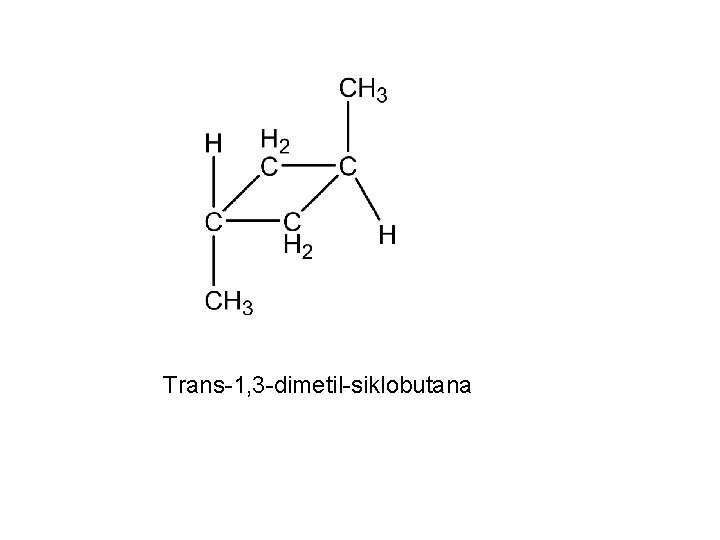
Trans-1, 3 -dimetil-siklobutana


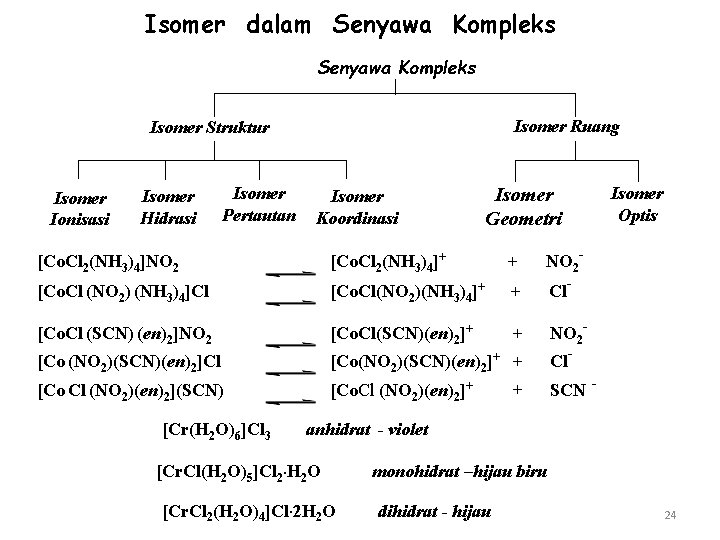
Isomer dalam Senyawa Kompleks Isomer Ruang Isomer Struktur Isomer Ionisasi Isomer Hidrasi Isomer Pertautan Isomer Koordinasi Isomer Geometri [Co. Cl 2(NH 3)4]NO 2 [Co. Cl 2(NH 3)4]+ + NO 2 - [Co. Cl (NO 2) (NH 3)4]Cl [Co. Cl(NO 2)(NH 3)4]+ + Cl- [Co. Cl (SCN) (en)2]NO 2 [Co. Cl(SCN)(en)2]+ + NO 2 - [Co (NO 2)(SCN)(en)2]Cl [Co(NO 2)(SCN)(en)2]+ + [Co Cl (NO 2)(en)2](SCN) [Co. Cl (NO 2)(en)2]+ [Cr(H 2 O)6]Cl 3 + Isomer Optis Cl- SCN - anhidrat - violet [Cr. Cl(H 2 O)5]Cl 2. H 2 O [Cr. Cl 2(H 2 O)4]Cl. 2 H 2 O monohidrat –hijau biru dihidrat - hijau 24
![Isomer pertautan linkage isomer SCN vs NCS MnSCNCO5 NO 2 Isomer pertautan (linkage isomer) : SCN- vs : NCS- [Mn(SCN)(CO)5] : NO 2 -](https://slidetodoc.com/presentation_image_h/b22a1a879d6faea935ec99215a11ab7f/image-25.jpg)
Isomer pertautan (linkage isomer) : SCN- vs : NCS- [Mn(SCN)(CO)5] : NO 2 - vs : ONO- [Co(NO 2)(NH 3)5]Cl 2 vs [Mn(NCS)(CO)5] vs [Co(ONO)(NH 3)5]Cl 2 Isomer koordinasi. [Co(NH 3)6]Cl 3 + K 3[Cr(CN)6] [Co(NH 3)6][Cr(CN)6] + 3 KCl [Cr(NH 3)6]Cl 3 + K 3[Co(CN)6] [Cr(NH 3)6][Co(CN)6] + 3 KCl [Cu(NH 3)4][Pt. Cl 4] vs [Pt(NH 3)4][Cu. Cl 4] [Co(NH 3)6][Cr(NO 2)6] vs [Cr(NH 3)6][Co(NO 2)6] [Cr(NH 3)6][Cr(SCN)6] vs [Cr(SCN)2(NH 3)4][Cr(SCN)4(NH 3)2] 25

Isomer Geometri (a) (c) (d) =M (b) Isomer : cis- (a) dan cis- (c) dan Cl NH 3 Co NH 3 trans-(b) trans- (d) + NH 3 Cl =L H 3 N NH 3 Co Cl (e) (f) Isomer fac- (e) dan mer- (f) ML 3 X 3 ML 2 X 2 ML 4 X 2 + NH 3 Cl =X NH 3 Cl Cl NH 3 cis- [Co. Cl 2(NH 3)4]+ dan trans-Co. Cl 2(NH 3)4]+ Ir NH 3 Cl Cl Ir NH 3 fac- dan mer- [Ir. Cl 3(NH 3)3] 26

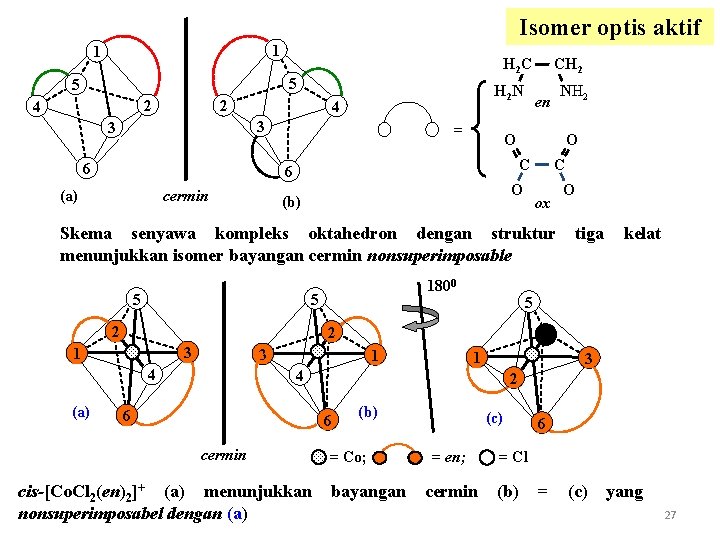
Isomer optis aktif 1 1 H 2 C 5 5 2 4 4 2 H 2 N 4 3 3 6 = cermin NH 2 en O O C 6 (a) CH 2 O (b) C ox Skema senyawa kompleks oktahedron dengan struktur menunjukkan isomer bayangan cermin nonsuperimposable 5 5 2 3 1 1 1 4 6 cis-[Co. Cl 2(en)2]+ (a) menunjukkan nonsuperimposabel dengan (a) 3 2 6 cermin kelat 4 3 4 tiga 5 2 4 (a) 1800 O (b) = Co; bayangan (c) = en; cermin 6 = Cl (b) = (c) yang 27

1800 Me Ph Me Me O O Be O O Me O Be Ph Ph (a) O 1800 O O Ph (b) cermin Me Ph Bentuk geometri tetrahedron (a) kompleks [M(benzoilacac)2], M = Be dan Zn, bayangan cerminnya (b) = (c) yang tidak setangkup dengan (a) O O Me O Be O (c) Ph 28

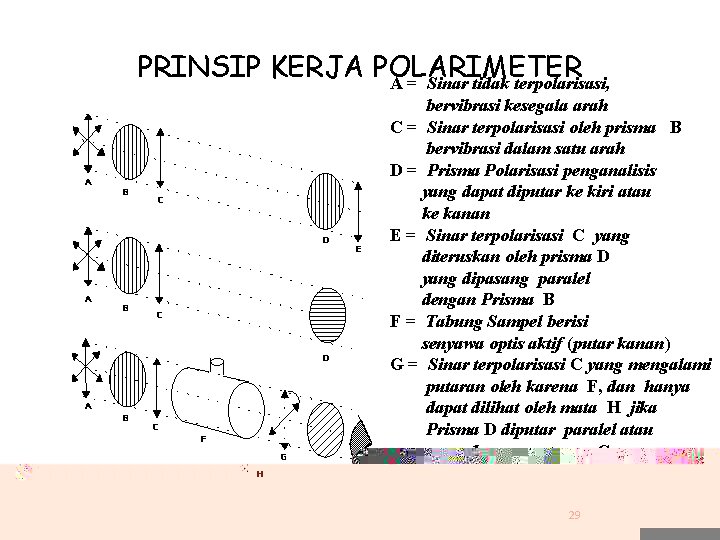
PRINSIP KERJA POLARIMETER A = Sinar tidak terpolarisasi, A B C D A B E C D A B C F G D bervibrasi kesegala arah C = Sinar terpolarisasi oleh prisma B bervibrasi dalam satu arah D = Prisma Polarisasi penganalisis yang dapat diputar ke kiri atau ke kanan E = Sinar terpolarisasi C yang diteruskan oleh prisma D yang dipasang paralel dengan Prisma B F = Tabung Sampel berisi senyawa optis aktif (putar kanan) G = Sinar terpolarisasi C yang mengalami putaran oleh karena F, dan hanya dapat dilihat oleh mata H jika Prisma D diputar paralel atau sama dengan putaran G H 29


![ISOMER GEOMETRIK ISOMER CISTRANS Isomer ini khusus terjadi pada senyawa alkena yang ISOMER GEOMETRIK [ ISOMER CIS-TRANS] • Isomer ini khusus terjadi pada senyawa alkena yang](https://slidetodoc.com/presentation_image_h/b22a1a879d6faea935ec99215a11ab7f/image-32.jpg)
ISOMER GEOMETRIK [ ISOMER CIS-TRANS] • Isomer ini khusus terjadi pada senyawa alkena yang memiliki struktur : o Δ C 1 = C 2 Δ ♥ C 1 = mengikat gugus yang berbeda C 2 = mengikat gugus yang berbeda gugus yang dikiri harus sama dengan gugus yang ada dikanan.

bila gugus yang sama sepihak : bentuk cis bila gugus yang sama berseberangan : bentuk trans • Selidiki apakah senyawa berikut memiliki isomer cis-trans ? a. 2 - butena b. 2 -metil 2 -butena c. 2, 3 dimetil 1 - pentena d. 3 - heksena e. 4, 4 - dimetil 2 - pentena

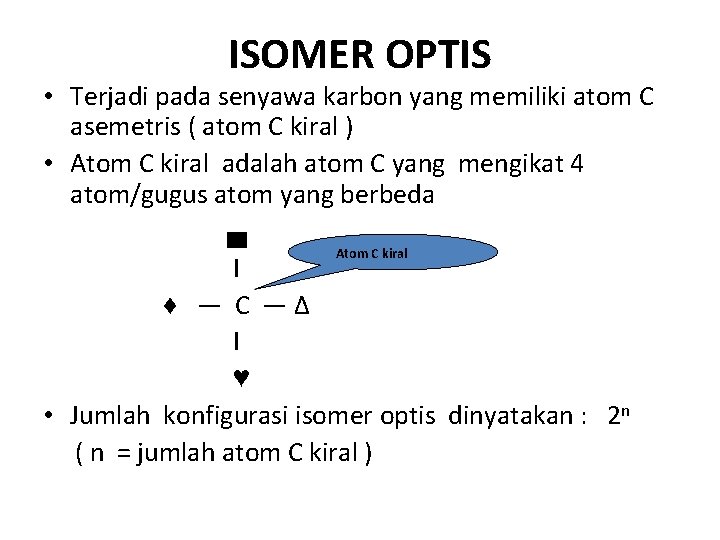
ISOMER OPTIS • Terjadi pada senyawa karbon yang memiliki atom C asemetris ( atom C kiral ) • Atom C kiral adalah atom C yang mengikat 4 atom/gugus atom yang berbeda ▄ Atom C kiral I ♦ ― C ― Δ I ♥ • Jumlah konfigurasi isomer optis dinyatakan : 2 n ( n = jumlah atom C kiral )

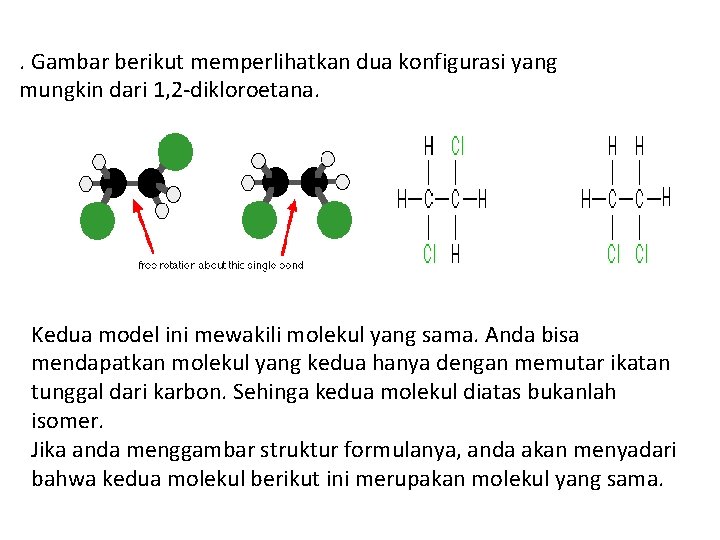
. Gambar berikut memperlihatkan dua konfigurasi yang mungkin dari 1, 2 -dikloroetana. Kedua model ini mewakili molekul yang sama. Anda bisa mendapatkan molekul yang kedua hanya dengan memutar ikatan tunggal dari karbon. Sehinga kedua molekul diatas bukanlah isomer. Jika anda menggambar struktur formulanya, anda akan menyadari bahwa kedua molekul berikut ini merupakan molekul yang sama.

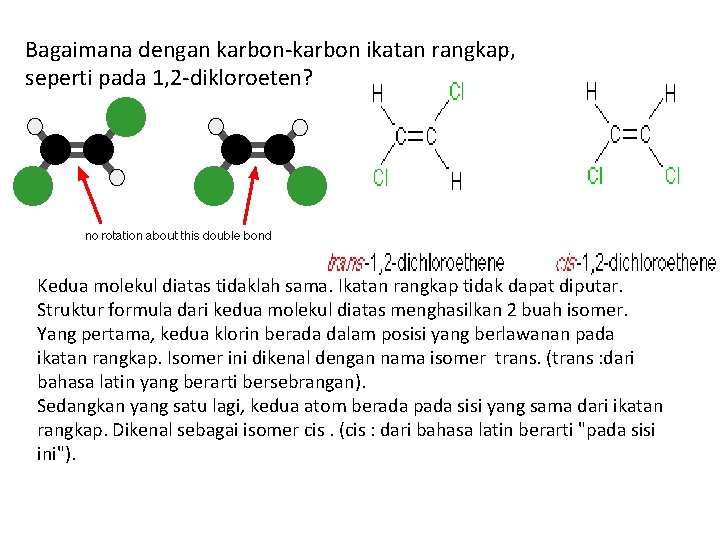
Bagaimana dengan karbon-karbon ikatan rangkap, seperti pada 1, 2 -dikloroeten? Kedua molekul diatas tidaklah sama. Ikatan rangkap tidak dapat diputar. Struktur formula dari kedua molekul diatas menghasilkan 2 buah isomer. Yang pertama, kedua klorin berada dalam posisi yang berlawanan pada ikatan rangkap. Isomer ini dikenal dengan nama isomer trans. (trans : dari bahasa latin yang berarti bersebrangan). Sedangkan yang satu lagi, kedua atom berada pada sisi yang sama dari ikatan rangkap. Dikenal sebagai isomer cis. (cis : dari bahasa latin berarti "pada sisi ini").

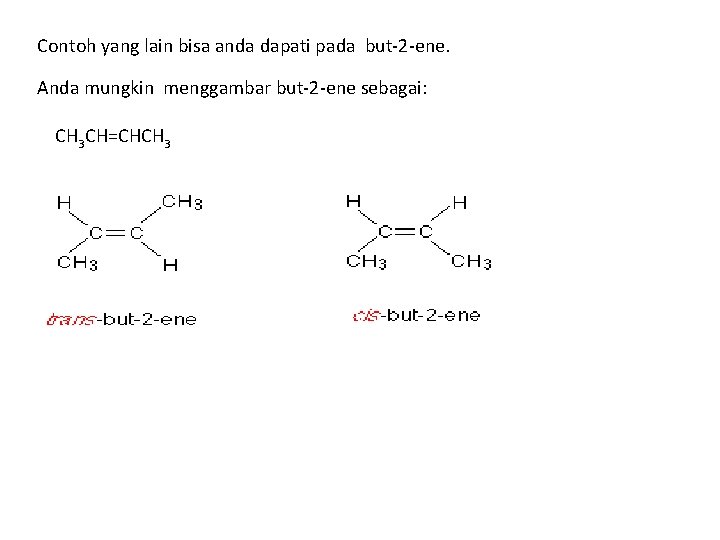
Contoh yang lain bisa anda dapati pada but-2 -ene. Anda mungkin menggambar but-2 -ene sebagai: CH 3 CH=CHCH 3

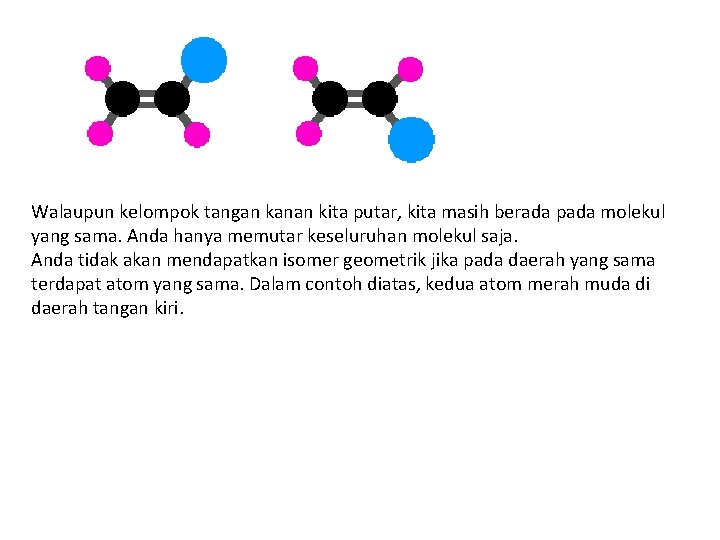
Walaupun kelompok tangan kanan kita putar, kita masih berada pada molekul yang sama. Anda hanya memutar keseluruhan molekul saja. Anda tidak akan mendapatkan isomer geometrik jika pada daerah yang sama terdapat atom yang sama. Dalam contoh diatas, kedua atom merah muda di daerah tangan kiri.

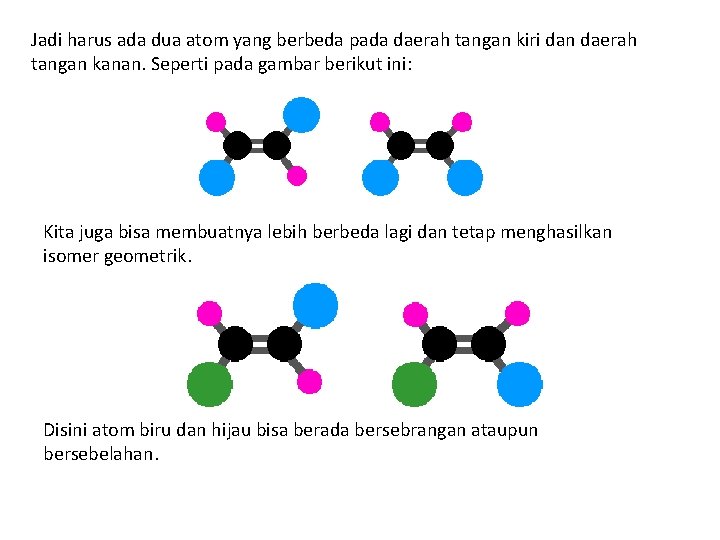
Jadi harus ada dua atom yang berbeda pada daerah tangan kiri dan daerah tangan kanan. Seperti pada gambar berikut ini: Kita juga bisa membuatnya lebih berbeda lagi dan tetap menghasilkan isomer geometrik. Disini atom biru dan hijau bisa berada bersebrangan ataupun bersebelahan.

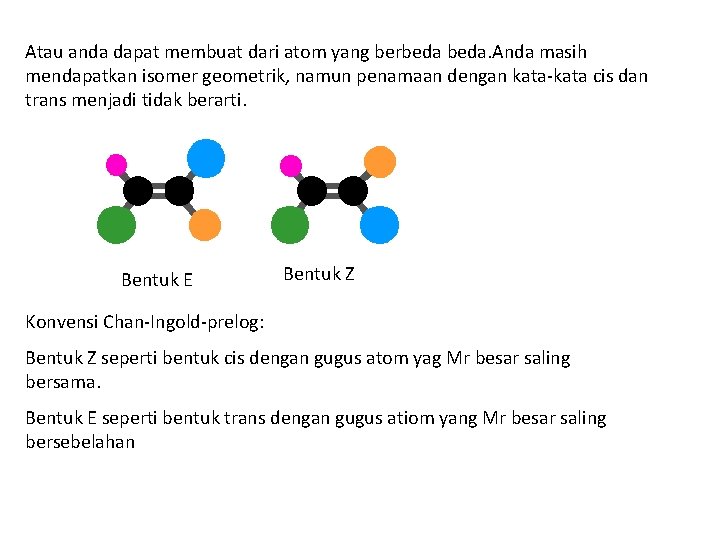
Atau anda dapat membuat dari atom yang berbeda. Anda masih mendapatkan isomer geometrik, namun penamaan dengan kata-kata cis dan trans menjadi tidak berarti. Bentuk E Bentuk Z Konvensi Chan-Ingold-prelog: Bentuk Z seperti bentuk cis dengan gugus atom yag Mr besar saling bersama. Bentuk E seperti bentuk trans dengan gugus atiom yang Mr besar saling bersebelahan

• Bila kedua gugus yang lebih tinggi prioritasnya berada pada sisi yang sama dari ikatan rangkap, maka senyawa tersebut diberi labeli atau dinyatakan memiliki konfigurasi Z (Z = zusammen, German, “bersama”), • Bila kedua gugus yang lebih berprioritas terletak berseberangan dari ikatan rangkap, dinyatakan memiliki konfigurasi E (E = entgegen, German, berseberangan”).

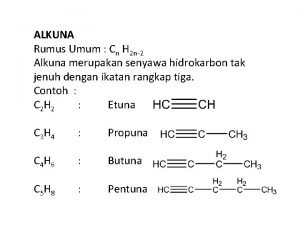
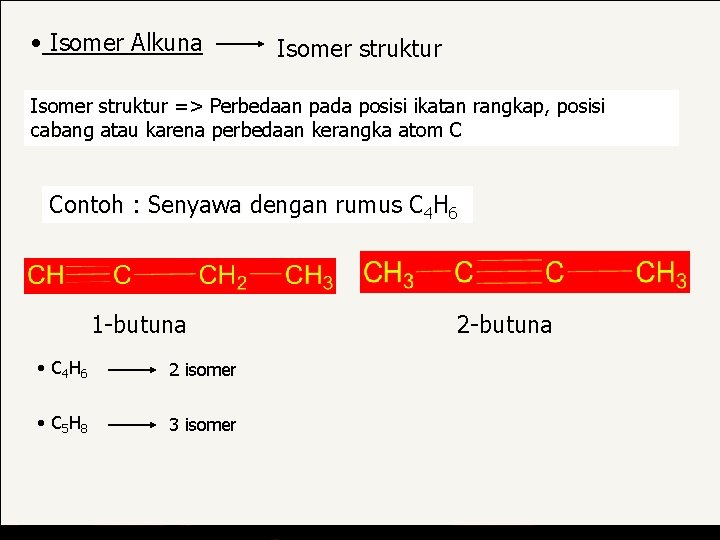
• Isomer Alkuna Isomer struktur => Perbedaan pada posisi ikatan rangkap, posisi cabang atau karena perbedaan kerangka atom C Contoh : Senyawa dengan rumus C 4 H 6 1 -butuna • C 4 H 6 2 isomer • C 5 H 8 3 isomer 2 -butuna



 Isomer cis trans 1 2 dikloroetana
Isomer cis trans 1 2 dikloroetana Sistem lingkaran terbuka
Sistem lingkaran terbuka 1 metil siklopentanol
1 metil siklopentanol Hidrocarbon
Hidrocarbon Hidrogenizacija alkena
Hidrogenizacija alkena Alkena
Alkena Pengertian senyawa karbon
Pengertian senyawa karbon Sagorevanje alkena
Sagorevanje alkena Sintesis alkena
Sintesis alkena Isomer metameri
Isomer metameri Homologni niz alkana
Homologni niz alkana 5–bromo–2–metilheks–3–ena
5–bromo–2–metilheks–3–ena Alkini su
Alkini su Nomenklatura alkena
Nomenklatura alkena Di propil eter
Di propil eter Alkuna
Alkuna Piramida stasioner
Piramida stasioner Rumus umum dilatasi
Rumus umum dilatasi Contoh aum ptsdl
Contoh aum ptsdl Rumus struktur propil
Rumus struktur propil Dispersi
Dispersi Formula gillies
Formula gillies Satuan kwintal
Satuan kwintal Neraca bank umum
Neraca bank umum Contoh struktur algoritma pemilihan
Contoh struktur algoritma pemilihan Soal uas teori organisasi umum 1 gunadarma
Soal uas teori organisasi umum 1 gunadarma Asesmen dalam bk
Asesmen dalam bk Struktur laporan asil observasi ana ....
Struktur laporan asil observasi ana .... Teori umum dan teori khusus
Teori umum dan teori khusus Definisi umum adalah
Definisi umum adalah Gambaran umum pekerjaan di bidang teknologi informasi
Gambaran umum pekerjaan di bidang teknologi informasi Batas jantung normal
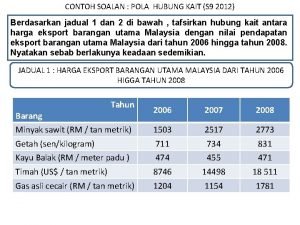
Batas jantung normal Pola hubungkait pengajian am
Pola hubungkait pengajian am Tujuan dan manfaat etika wirausaha
Tujuan dan manfaat etika wirausaha Jabatan perkhidmatan awam bahagian pasca perkhidmatan
Jabatan perkhidmatan awam bahagian pasca perkhidmatan Verryn stuart mengemukakan ada dua tugas bank, yaitu
Verryn stuart mengemukakan ada dua tugas bank, yaitu Gambaran umum akuntansi
Gambaran umum akuntansi Kebijakan umum pembinaan dan pengembangan guru
Kebijakan umum pembinaan dan pengembangan guru Prasyaratan umum emisi saham istimewa
Prasyaratan umum emisi saham istimewa Iman secara etimologi berasal dari bahasa
Iman secara etimologi berasal dari bahasa Permutasi dan kombinasi bentuk umum
Permutasi dan kombinasi bentuk umum Pengenalan komputer secara umum
Pengenalan komputer secara umum Mycosporium
Mycosporium Pengendalian manajemen pada perusahaan jasa keuangan
Pengendalian manajemen pada perusahaan jasa keuangan Suatu pola umum
Suatu pola umum Prinsip umum
Prinsip umum