Air dan Larutan Dr Ridla Bakri MPhil Dept

Air dan Larutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Air Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

H 2 O Zat Menakjubkan • Air adalah pelarut yang sangat penting. – – – Pelarut yang universal (Universal solvent) Pelarut Biologis (Biological solvent) Cair (Liquid, not a gas, at room T and normal P) Ukurannya kecil (Small size) BJ nya lebih besar dari es (Density of water is greater than ice) Mempunyai ikatan hidrogen (Hydrogen Bonding) Sangat Polar (Very polar) Titik Didihnya tinggi (High boiling point =100 °C) Mempunyai Tegangan Permukaan Tinggi Sangat Transparan (dapat dilalui cahaya untuk fotosintesa tanaman dalam air) Mempunyai Kapasitas Panas Tinggi (Heat Capacity) Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
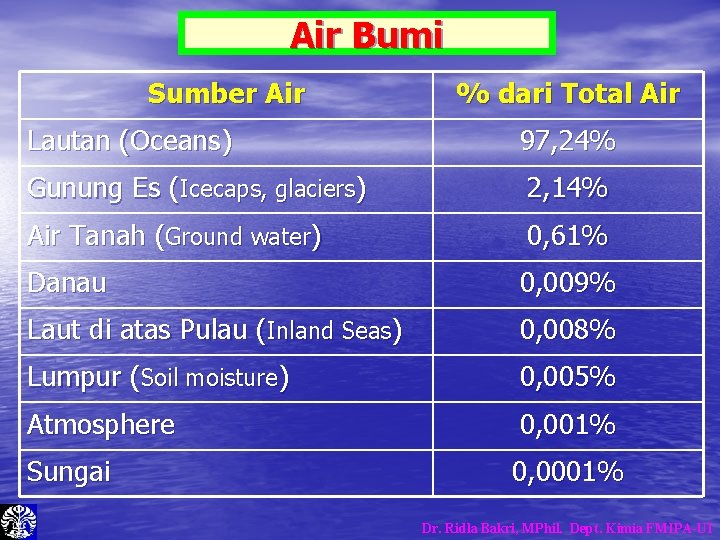
Air Bumi Sumber Air % dari Total Air Lautan (Oceans) 97, 24% Gunung Es (Icecaps, glaciers) 2, 14% Air Tanah (Ground water) 0, 61% Danau 0, 009% Laut di atas Pulau (Inland Seas) 0, 008% Lumpur (Soil moisture) 0, 005% Atmosphere 0, 001% Sungai 0, 0001% Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
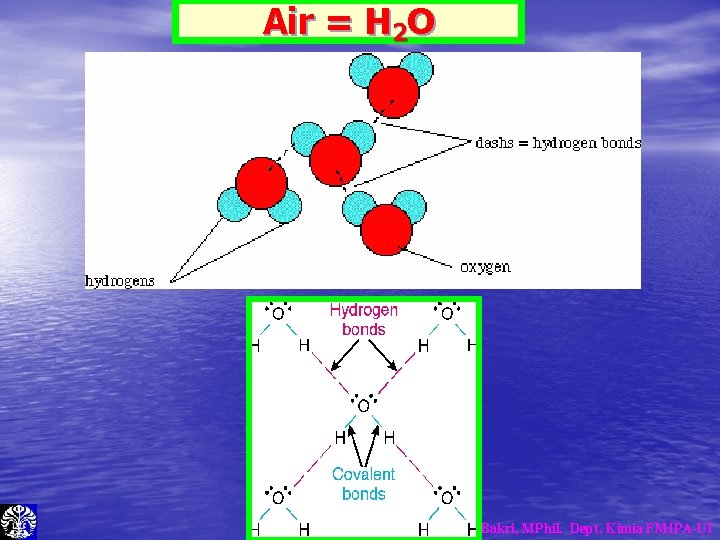
Air = H 2 O Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
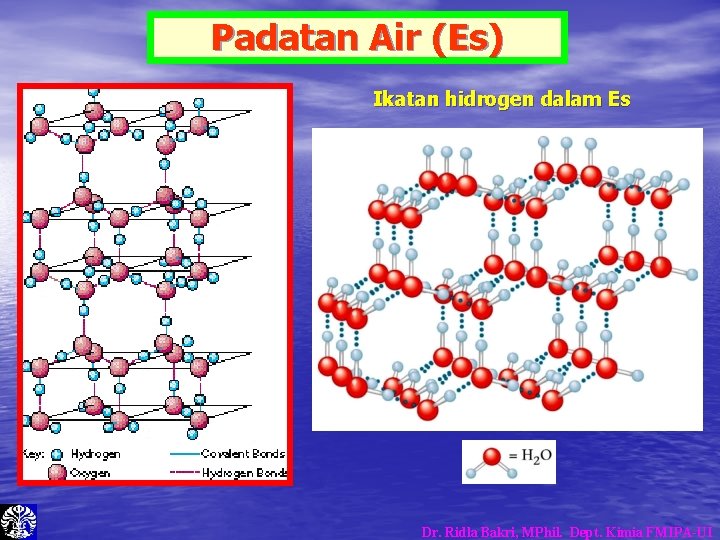
Padatan Air (Es) Ikatan hidrogen dalam Es Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
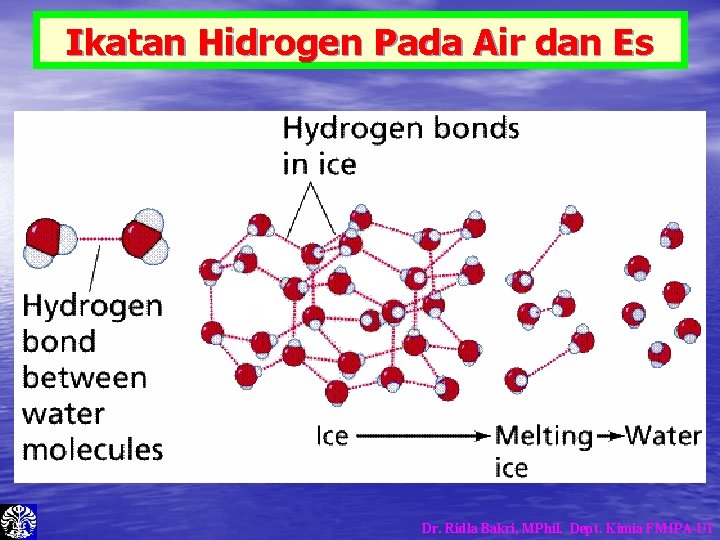
Ikatan Hidrogen Pada Air dan Es Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
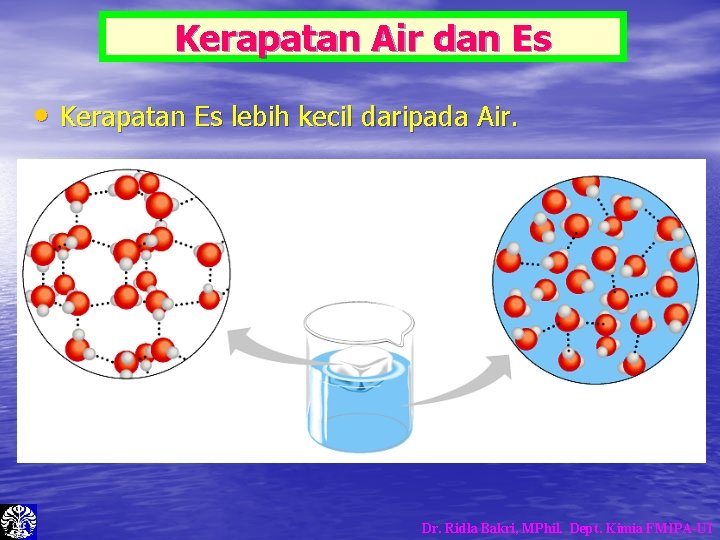
Kerapatan Air dan Es • Kerapatan Es lebih kecil daripada Air. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
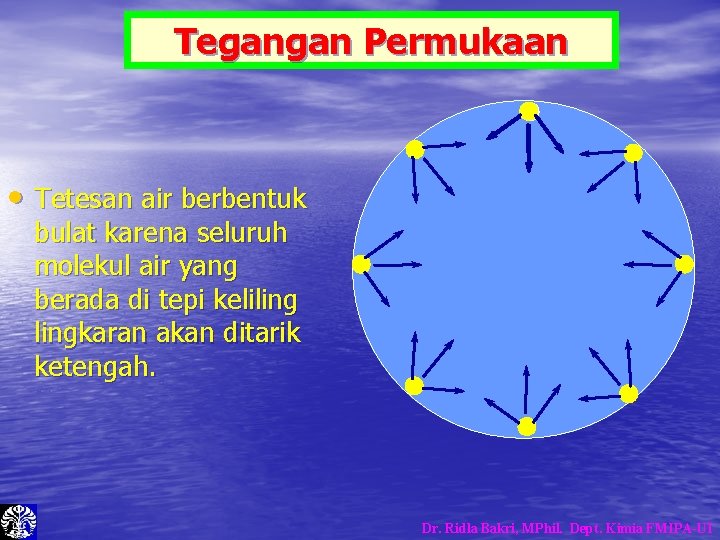
Tegangan Permukaan • Tetesan air berbentuk bulat karena seluruh molekul air yang berada di tepi kelilingkaran akan ditarik ketengah. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
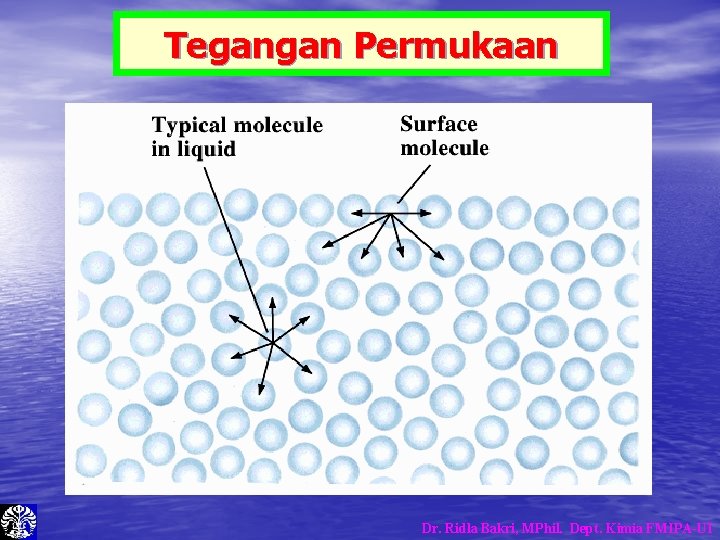
Tegangan Permukaan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Miniskus Pipa Kaca Pipa Plastik Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Kapasitas Panas • Air mempunyai kapasitas panas (sama seperti panas specifik) yang besar. • Air menyerap 1 cal/gºC, sedangkan besi hanya menyerap 0, 107 cal/gºC. Hitung panas yang dibutuhkan untuk menaikkan suhu air dan besi sebesar 75ºC. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Panas Penguapan • Air mempunyai ikatan Hidrogen yang kuat, oleh karena itu air membutuhkan energi yang cukup besar untuk berubah fasa dari cair menjadi gas (uap). • Panas penguapan air = 540 cal/g • Untuk mendidihkan air diperlukan energi yang cukup besar. • Jumlah Energi yang sama pula akan dibutuhkan ketika Air meng-kondensasi (mengembun). Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Air Minum • Air untuk minum umumnya berasal dari Air Permuka- an (surface water) atau dari Air Tanah (ground water). • Surface water – danau, sungai dan cadangan air lainnya di permukaan Bumi. Ø Umumnya Air mengandung zat-zat yang harus dihilangkan sebelum dijadikan air minum. • Ground water – air yang di pompa (melalui pengebor- an) dari dalam tanah. Ø umumnya bebas dari kandungan zat berbahaya, namun tidak selalu bersih. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Struktur dan Kelarutan • Molekul-molekul yang mempunyai momen dipole (polar) umumnya dapat larut dalam air. • Sedangkan senyawa non-polar larut dalam pelarut non-polar. • “Like dissolve like” Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

LARUTAN Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Larutan: campuran dua atau lebih senyawa yang homogen. Zat Terlarut Senyawa dengan jumlah kecil yang dilarutkan disebut zat terlarut. Zat terlarut dapat berupa gas, liquid (cairan), atau solid (padat). Pelarut Senyawa dengan jumlah besar disebut pelarut. Pelarut dapat berupa liquid (cairan) atau solid (padat). Aqueous solution ; suatu larutan yang menggunakan air sebagai pelarut. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Sifat Zat Terlarut Dalam Larutan Ø Partikel zat terlarut mempunyai diameter < 1 nm Ø Partikel terdistribusi merata di dalam larutan Ø Tidak dapat dipisahkan dengan penyaringan Ø Dapat dipisahkan melalui penguapan atau destilasi Ø Partikel zat terlarut tidak dapat dilihat, larutan merupakan campuran yang transparan Ø Dapat menghasilkan warna kepada larutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
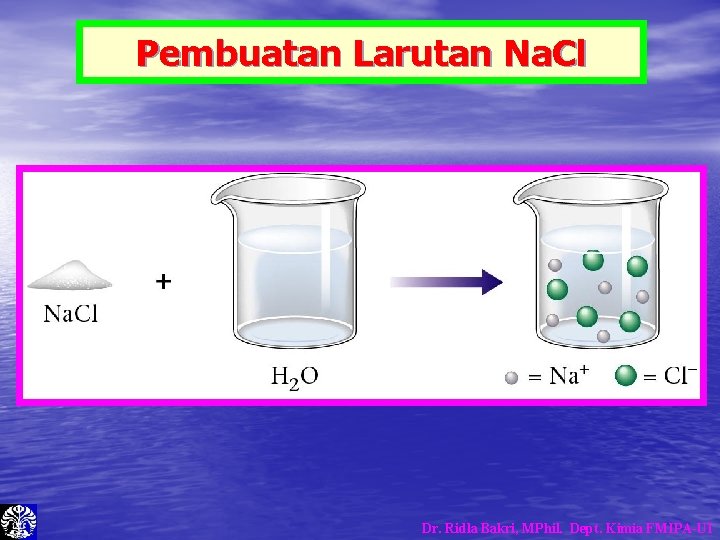
Pembuatan Larutan Na. Cl Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
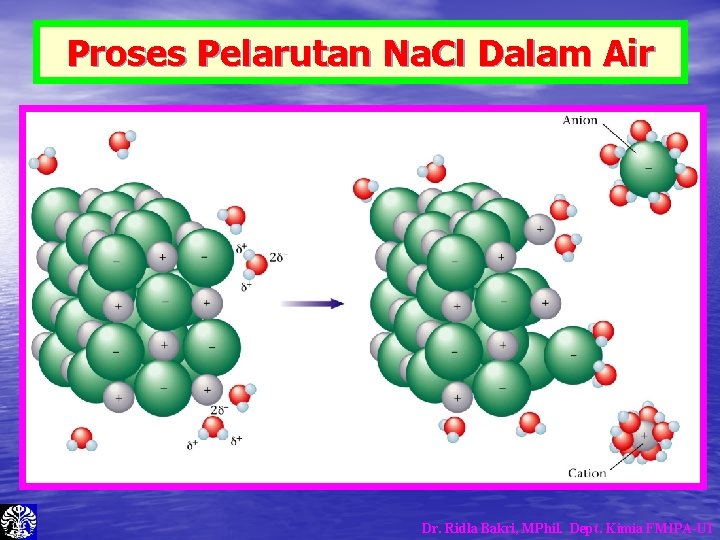
Proses Pelarutan Na. Cl Dalam Air Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Proses Pelarutan Padatan Ionik • • • Proses pelarutan dengan air disebut Hidrasi. Air memecahkan/memisahkan muatan + dan – kemudian mengelilingi masing-masing muatan tersebut. Padatan akan terlarut jika gaya tarik dari molekul air lebih kuat daripada gaya tarik kristal. Jika tidak maka padatan tidak akan melarut. Air tidak dapat melarutkan molekul non-polar, karena molekul air tidak dapat berikatan kepada molekul tersebut. Molekul air berikatan dengan sesamanya, dan terpisah dari molekul non-polar. Proses pelarutan dengan pelarut lainnya disebut Solvasi. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
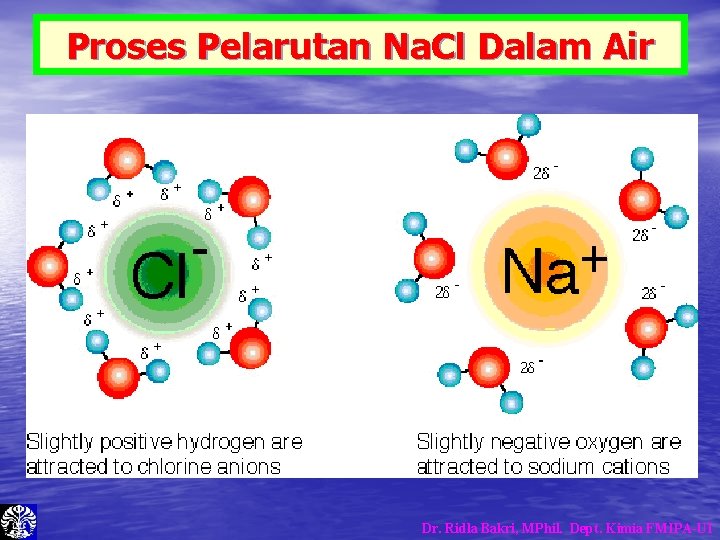
Proses Pelarutan Na. Cl Dalam Air Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Jenis Larutan Udara O 2 gas and N 2 gas/gas Soda CO 2 gas dalam air gas/liquid Air Laut Na. Cl dalam air Kuningan copper and zinc solid/liquid solid/solid Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Larutan Jenuh dan Tidak Jenuh Ø Larutan Jenuh (Saturated) adalah suatu larutan yang mengandung zat terlarut dalam keadaan maksimum yang dapat terlarut. Zat yang tidak larut akan tertinggal Ø Larutan tidak jenuh (unsaturated) mengandung zat terlarut bukan dalam keadaan maksimum dapat terlarut. Ø Larutan Supersaturated Larutan yang mengandung zat terlarut lebih banyak dari keadaan kelarutan normalnya. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Kelarutan adalah, jumlah maksimum zat terlarut yang dapat melarut dalam sejumlah pelarut (umumnya 100 g). g zat terlarut 100 g Air Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Suhu dan Kelarutan Padatan Temperatur 0° C 20° C 50° C 100° C Kelarutan KCl(s) 27, 6 34, 0 42, 6 57, 6 (g/100 g H 2 O) Na. NO 3(s) 74 88 114 182 Umumnya kelarutan suatu padatan akan bertambah dengan kenaikan temperatur. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Suhu dan Kelarutan Gas Temperature 0° C 20° C 50° C Kelarutan (g/100 g H 2 O) CO 2 (g) 0, 34 0, 17 0, 076 O 2 (g) 0, 0070 0, 0043 0, 0026 Kelarutan Gas umumnya akan berkurang dengan adanya kenaikan temperatur. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Konsentrasi Larutan • Konsentrasi adalah perbandingan jumlah zat terlarut dengan pelarut. • Konsentrasi : – Molalitas (m) : jumlah mol zat (ions or molecules) per kilogram pelarut. – Molaritas (M) : jumlah mol zat (ions or molecules) per liter larutan. – Persen Berat (% m) : berat zat terlarut per berat total larutan x 100 % – Fraksi mol ( A) : mol zat terlarut per Total jumlah mol larutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Perhitungan Banyak Zat Terlarut Asam lambung terdiri dari Larutan 0, 10 M HCl. Berapa jumlah HCl yang terdapat dalam 1500 m. L larutan asam lambung? Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Perhitungan Konsentrasi Larutan Jika 4, 0 g Na. OH dilarutkan ke dalam 500 m. L. Berapakah konsentrasi dalam M larutan tersebut? 4, 0 g Na. OH x 1 mole Na. OH 40, 0 g Na. OH = 0, 10 mole Na. OH 500 m. L x = 0, 500 L 1 L_ 1000 m. L 0, 10 mole Na. OH 0, 500 L = 0, 20 mole Na. OH 1 L = 0, 20 M Na. OH Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Konsentrasi dalam Persen • Menjelaskan jumlah zat terlarut di dalam 100 bagian larutan • % Berat % massa/massa = g zat terlarut 100 g Larutan x 100% • % Volume % volume/volume = • % massa/volume = m. L zat terlarut x 100 % 100 m. L Larutan g zat terlarut 100 m. L Larutan x 100% Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Contoh 1. 4, 0 gram KCl dilarutkan dalam 46, 0 g air, maka % berat larutan adalah, 2. Larutan infus dibuat dengan cara melarutkan 25 g glukosa (C 6 H 12 O 6) dalam air 500 m. L air. Hitunglah berapa % (m/v) larutan tersebut. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Contoh 1. 4, 0 gram KCl dilarutkan dalam 46, 0 g air, maka % berat larutan adalah, % berat = 2. 4, 0 g KCl 50, 0 g larutan KCl x 100 = 8, 0 % KCl Larutan infus dibuat dengan cara melarutkan 25 g glukosa (C 6 H 12 O 6) dalam air 500 m. L air. Hitunglah berapa % (m/v) larutan tersebut. %(m/v) = 25 g glukosa x 100 500 m. L larutan = 5, 0 % (m/v) larutan glukosa Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Jenis Larutan 1. Larutan Elektrolit • Larutan yang dapat menghasilkan ion positiv (+) dan ion negatif (-) di dalam air • Dapat menghantar arus listrik 2. Larutan Non-Elektrolit – Larutan yang tidak dapat membentuk ion, zat terlarut melarut hanya dalam bentuk molekul – Tidak dapat menghantar arus listrik C 6 H 12 O 6 (s) H 2 O C 6 H 12 O 6 (aq) Glukosa Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Larutan Elektrolit 1. Larutan Elektrolit Kuat. Larutan yang terionisasi sempurna (100%) Garam Na. Cl(s) Ca. Br 2(s) Asam HCl(g) 100% ion H 2 O Na+(aq) + Cl-(aq) Ca 2+(aq) + 2 Br- (aq) H 3 O+(aq) + Cl-(aq) Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

2. Larutan Elektrolit Lemah Ø Di dalam larutan, zat terlarut sebagian besar berada dalam bentuk molekul Ø Hanya sebagian kecil zat terlarut yang terionisasi HF + Asam H 2 O NH 3 + H 2 O H 3 O+(aq) + F- (aq) NH 4+(aq) + OH- (aq) Basa Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
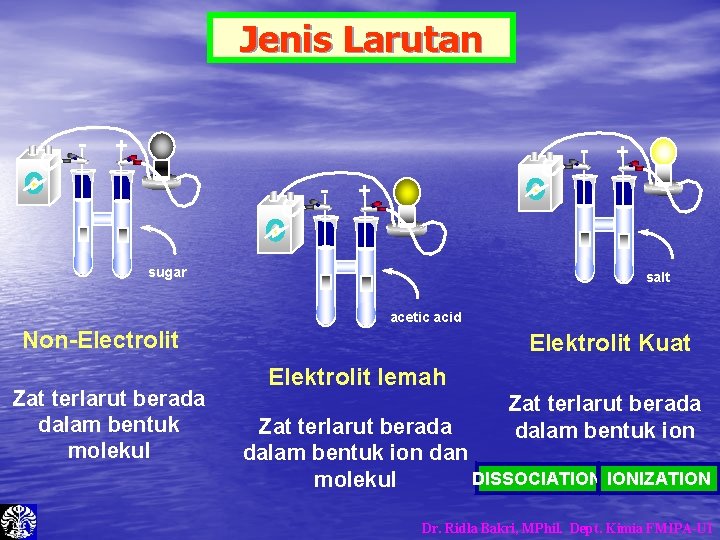
Jenis Larutan - + + sugar salt acetic acid Non-Electrolit Zat terlarut berada dalam bentuk molekul Elektrolit Kuat Elektrolit lemah Zat terlarut berada dalam bentuk ion dan DISSOCIATION IONIZATION molekul Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Sifat Koligatif Larutan • Sifat Koligatif adalah sifat larutan yang tergantung dari jumlah molekul zat terlarut • Sifat Koligatif Larutan : – Tekanan Osmose – Penurunan Titik Beku – Kenaikan Titik Didih – Tekanan Uap Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Tekanan Osmose – – ∏ = Tekanan Osmose n = jumlah mol V = Volume M = Molaritas R = Tetapan Gas • Di dalam tubuh manusia, sifat koligatif larutan yang terpenting • • adalah, tekanan OSMOSE Karena di dalam tubuh banyak terdapat selaput semi permeable dalam bentuk membran sel, yang memisahkan dua jenis larutan yang berbeda Selaput semi permeable dapat dilalui oleh air namun tidak dapat dilalui oleh zat terlarut. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
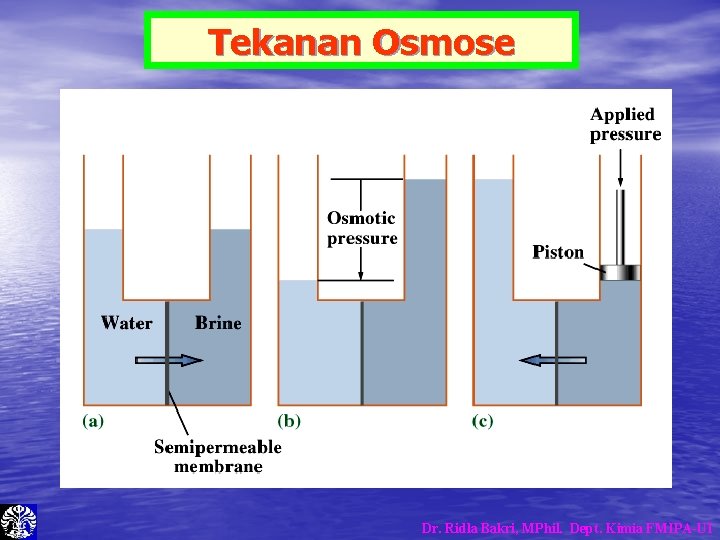
Tekanan Osmose Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
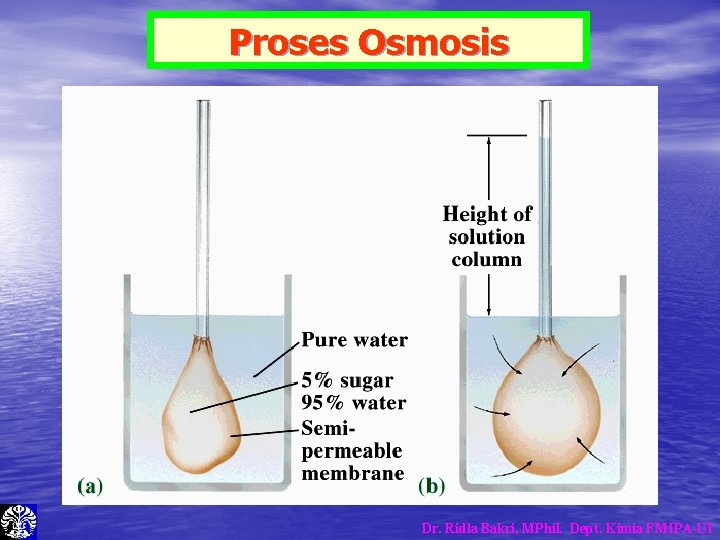
Proses Osmosis Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
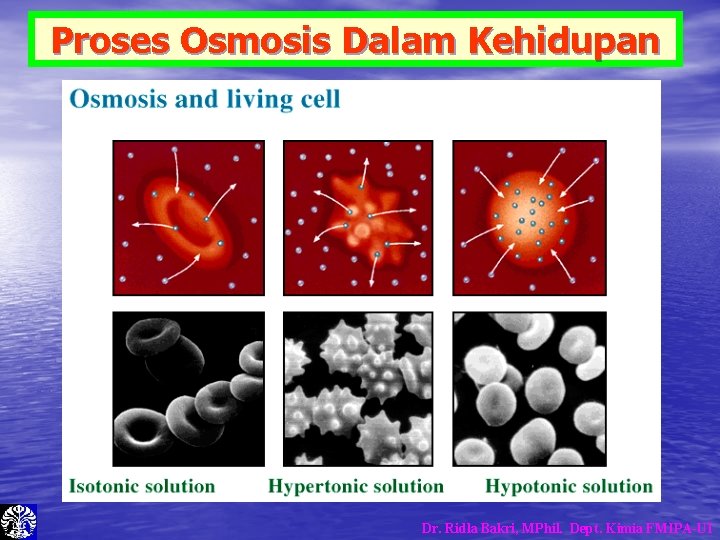
Proses Osmosis Dalam Kehidupan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Penurunan Titik Beku T = Takhir – Tawal ( Tf = fppelarut murni - fplarutan) Tf = k f x m kf = konstanta penurunan titik beku m = molalitas seluruh zat yang terdapat dalam larutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Kenaikan Titik Didih T = Takhir – Tawal ( Tb = bplarutan – bppelarut murni) Tb = k b x m kb = konstanta kenaikan t. d m =molalitas seluruh zat yang terdapat di dalam larutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Tekanan Uap • Tekanan Uap larutan < Tekanan Uap pelarut • Zat terlarut mempengaruhi dan mencegah molekul pelarut terbang ke atmosfer. Vapor Pressure Reduction: Expressed by Raoult’s Law Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
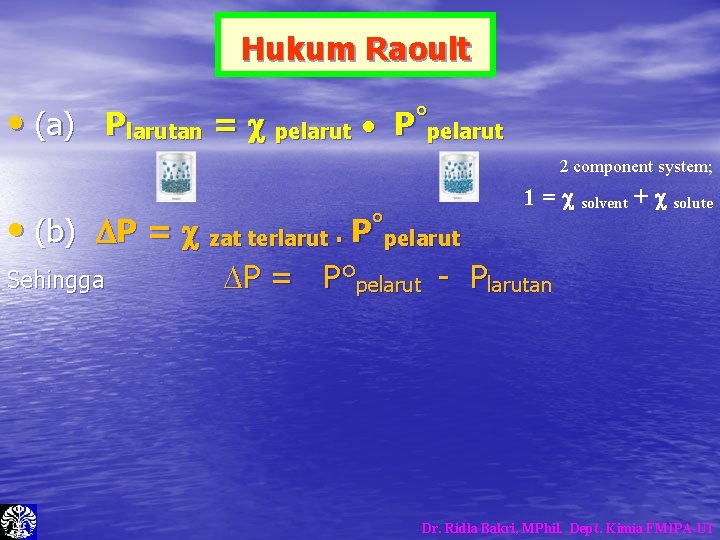
Hukum Raoult • (a) Plarutan = pelarut • P°pelarut 2 component system; • (b) P = zat terlarut. P°pelarut Sehingga 1 = solvent + solute P = P°pelarut - Plarutan Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Contoh Vapor pressure of CHCl 3 is P° = 360 torr at T = 40. 0°C. What is the vapor pressure reduction when 10. 0 g of phenol (C 6 H 5 OH : MW=94 g/mol) is added to 95. 0 g of chloroform (MW=119. 5 g/mol). What is the vapor pressure above the chloroform? Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Contoh Vapor pressure of CHCl 3 is P° = 360 torr at T = 40. 0°C. What is the vapor pressure reduction when 10. 0 g of phenol (C 6 H 5 OH : MW=94 g/mol) is added to 95. 0 g of chloroform (MW=119. 5 g/mol). What is the vapor pressure above the chloroform? = mol phenol = (10. 0 g • 1 mol/94 g) Tot. mol soln (10. 0 g • 1 mol/94 g)+ (95. 0 g • 1 mol/119. 5 g) = 0. 106 = 0. 118 0. 901 P = xphenol • P°CHCl 3 = 0. 118 • 360 torr = 42. 48 torr = 42. 5 torr • Psolvent = 360 torr - 42. 48 torr = 317. 52 torr = 318 torr Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Campuran yang bukan Larutan • Suspensi : campuran heterogen yang perlahan-lahan akan mengendap jika didiamkan. – Diameter Partikel suspensi, lebih besar dari 100 nm. – Dapat dipisahkan dengan penyaringan. • Koloid : campuran heterogen dari partikel yang mempunyai diameter antara diameter partikel suspensi dan larutan (1 -100 nm) Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

Koloid • Partikel-partikel sangat kecil yang disebut fasa terdispersi, tersebar merata di dalam media dispersi. • Koloid pertama adalah lem (glues). Kemudian campuran seperti gelatin, paint, aerosol sprays, dan asap (smoke). • Umumnya pada keadaan pekat, koloid terlihat keruh/tidak jernih (cloudy or milky), namun kelihatan hampir jernih ketika encer. – Tidak dapat di endapkan – Tidak dapat disaring Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI

• Koloid menghasilkan Efek Tyndal – memantulkan dan menyebarkan sinar visibel kesegala arah. – Suspensi juga memperlihatkan Efek Tyndall • Cahaya akan terlihat dipantulkan, ketika kita mempelajari koloid di bawah mikroskop. • Cahaya yang direfleksikan disebut – Pergerakan Brownian untuk menjelaskan ketidak teraturan pergerakan (chaotic) dari partikel. Dr. Ridla Bakri, MPhil. Dept. Kimia FMIPA-UI
- Slides: 51